Dieser Artikel wurde am 7. März 2022 aktualisiert.
Halsschmerzen
» Zu den Artikeln
Stuttgart - 14.03.2022, 10:45 Uhr
Worauf müssen Apotheken achten, wenn sie T-Rezepte beliefern? (x / Bild: Bundesanzeiger)
Verschreibungen der Wirkstoffe Lenalidomid, Pomalidomid und Thalidomid unterliegen in vielerlei Hinsicht besonderen Regeln, die Apotheker:innen beachten müssen: Es braucht beispielsweise ein besonders Formular, sie haben eine verkürzte Gültigkeit, es gibt besondere Dokumentationspflichten und vieles mehr. Wir haben die wichtigsten Fragen und Antworten zusammengestellt – zum Auffrischen und immer wieder nachlesen.
Nur Arzneimittel mit den Wirkstoffen Lenalidomid, Pomalidomid- und Thalidomid dürfen auf T-Rezepten verschrieben werden. Die Verordnungen müssen dabei, wie alle anderen Rezepte auch, den allgemeinen Regelungen der Arzneimittelverschreibungsverordnung entsprechen (vgl. § 2 AMVV) und zusätzlich die besonderen Regelungen zum T-Rezept gemäß § 3a AMVV erfüllen.
Nein. Diese Arzneimittel dürfen nur auf Vorlage eines vorschriftsmäßig ausgestellten T-Rezepts abgegeben werden. § 3a Arzneimittelverschreibungsverordnung (AMVV) legt das eindeutig fest. Das gilt unabhängig davon, ob das vorgelegte Rezept aus der EU oder einem Drittstaat stammt.
Nein. Für die Verschreibung benötigt man T-Rezepte. Tierärzte und Zahnärzte sind nicht zum Bezug der zweiteiligen amtlichen Vordrucke nach § 3a Abs. 1 AMVV und somit auch nicht zur Verschreibung der betreffenden Arzneimittel berechtigt. Nach § 3a Abs. 5 Satz 1 AMVV dürfen nur Ärztinnen und Ärzte T-Rezepte beziehen.
Nein. T-Rezepte werden persönlich beim BfArM angefordert und müssen personenbezogen verwendet werden. Auch in Gemeinschaftspraxen und Klinikambulanzen muss jeder Arzt, jede Ärztin die eigenen T-Rezepte verwenden. Mediziner:innen handeln bei der Verwendung der T-Rezepte grundsätzlich eigenverantwortlich – unabhängig von der Organisationform, in der sie tätig sind. Auch Sammelbestellungen für eine Gemeinschaftspraxis oder Klinikambulanz sind nicht möglich.
Einzige Ausnahme: Im Vertretungsfall darf die Vertretung die Rezepte der Person, die sie vertritt, unterschreiben. Allerdings nur, wenn auch der vertretende Arzt/die vertretende Ärztin die Sachkunde nach § 3a Abs. 5 AMVV gegenüber dem BfArM nachgewiesen hat und im T-Register registriert ist, also selbst T-Rezepte beziehen darf.
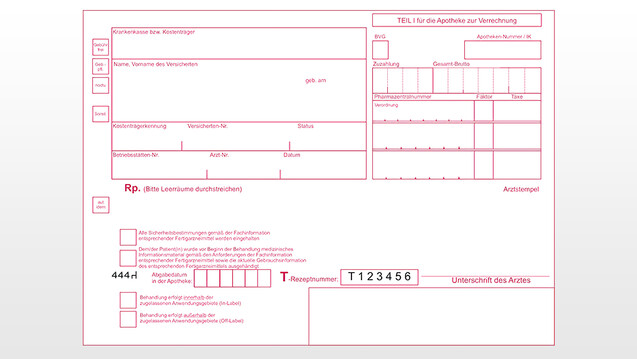
Das T-Rezept besteht aus zwei Teilen: einem Deckblatt (Teil I), das durchschreibend ist, und einer Durchschrift (Teil II). Letztere wird ans BfArM geschickt. Die Angaben, die nicht für das BfArM bestimmt sind, können nicht auf dem zweiten Blatt vermerkt werden. Die beiden Teile des T-Rezepts (Deckblatt und Durchschrift) werden gemeinsam in der Apotheke vorgelegt.
Ein Muster des seit 15. April 2020 ausgegebenen Formulars kann man sich auf der Webseite des BfArM ansehen. Im Unterschied zum Vorgänger wurde auf der Rückseite von Teil II ein Feld für den Apothekenstempel ergänzt. Das soll die Umsetzung der Anforderungen aus § 17 Abs. 6 Satz 1 Nummer 1 Apothekenbetriebsordnung erleichtern. Die alten T-Rezept-Formulare behalten aber weiterhin ihre Gültigkeit und können nach wie vor verwendet werden.
1: Name und Geburtsdatum des Patienten (vgl. § 2 Abs. 1 AMVV)
2: Datum der Ausfertigung (Verschreibung ist bis zu sechs Tage nach dem Tag ihrer Ausstellung gültig) (vgl. § 2 Abs. 1 und § 3a Abs. 4 AMVV)
3: Ankreuzen: Alle Sicherheitsbestimmungen werden eingehalten. (vgl. § 3a Abs. 2 AMVV). Derzeit findet sich noch der Zusatz "und dem/der Patient(in) wurde das medizinische Informationsmaterial ausgehändigt" auf dem Rezept, der kann gestrichen werden. Bei neune Rezepten wird er wegfallen.
4: Ankreuzen: Entweder „In-Label“ oder „Off-Label“ - Anwendung (vgl. § 3a Abs. 2 AMVV)
5: Bezeichnung des Fertigarzneimittels oder des Wirkstoffs inklusive der Stärke, der Darreichungsform und der Menge. Bei Rezepturarzneimitteln die Zusammensetzung nach Art und Menge sowie die Gebrauchsanweisung (Höchstmenge ist begrenzt!) (vgl. § 2 Abs. 1 und § 3a Abs. 3 AMVV)
6: Dosierung: Darauf kann verzichtet werden, wenn der Patient/die Patientin einen Medikationsplan hat, der das verschriebene Arzneimittel enthält, oder eine entsprechende schriftliche Dosierungsanweisung einer verschreibenden Person hat und die verschreibende Person dies auf dem Rezept angegeben hat. Auch wenn das verschriebene Arzneimittel an die verschreibende Person selbst abgegeben wird (vgl. § 2 Abs. 1 Nr. 7 AMVV), ist die Dosierungsangabe erlässlich.
7: Name, Vorname, Berufsbezeichnung und Anschrift der Praxis oder der Klinik der verschreibenden ärztlichen Person einschließlich einer Telefonnummer zur Kontaktaufnahme (vgl. § 2 Abs. 1 AMVV) (Vorname und Telefonnummer der ärztlichen Person sind seit dem 1.Juli 2015 erforderlich.)
8: Die eigenhändige Unterschrift der verschreibenden ärztlichen Person, die im T-Register registriert sein muss (vgl. § 2 Abs. 1 AMVV)


Laut § 17 Abs. 5 ApBetrO sind Apotheker:innen verpflichtet, die Verschreibung auf erkennbare Irrtümer hin zu überprüfen. Zudem muss überprüft werden, ob alle oben genannten Angaben vorhanden sind – in vielen Fällen übernimmt das die Software.
Außerdem ist die Apotheke seit kurzem verpflichtet, die Packungsbeilage auszuhändigen, bislang war das Aufgabe des Arztes. Hintergrund ist die Einführung von Lenalidomid-Generika. Die Neuregelung soll vermeiden, dass die verschreibende Person dem Patienten oder der Patientin eine bestimmte Gebrauchsinformation auszuhändigen hat, obwohl sie nicht weiß, welches Fertigarzneimittel in der Apotheke auf Grund der genannten sozialrechtlichen Bestimmungen abgegeben werden wird.
Geschieht das vorsätzlich, ist es eine Straftat (§§ 96 Nr. 13, 48 Abs. 2 Nr. 7 AMG i.V.m. § 3a AMVV) und kann entsprechend verfolgt werden. Passiert es aus Versehen („fahrlässiges Handeln“), ist das eine Ordnungswidrigkeit (§ 97 Abs. 1 AMG). Dem nachzugehen, ist dann die Aufgabe der zuständigen Landesbehörden.
Die Apotheke muss auf der Verschreibung (Teil I) und auf der Durchschrift der Verschreibung (Teil II) folgende Angaben machen, wie auf jeder anderen Verschreibung auch:
9. Abgabedatum in der Apotheke (vgl. § 17 Abs. 6 ApBetrO)
10. gültige Pharmazentralnummer (PZN) (vgl. § 17 Abs. 6 ApBetrO)
11. Faktor (Anzahl der Packungen) Apotheken-Nummer / IK
12. Name oder Firma des Inhabers der Apotheke und deren Anschrift (vgl. § 17 Abs. 6 ApBetrO)
Außerdem bittet das BfArM, den Apothekenstempel auf der Rückseite der Durchschrift (Teil II) aufzubringen und die Rezepte ordnungsgemäß auszufüllen, weil es sie auswerten möchte.
Handschriftlich oder maschinell: Dazu gibt es in der Arzneimittelverschreibungsverordnung keine Vorgabe.
Nein. Es ist ausdrücklich eine „Bestätigung der ärztlichen Person“ vorgesehen.
T-Rezepte sind bis zu sechs Tage nach dem Tag der Ausstellung gültig (vgl. § 3a Abs. 4 AMVV).
Das geht. Für T-Rezepte gelten dann die gleichen Regeln wie für alle anderen Rezepte. Die Verordnungen im Rahmen des Entlassmanagements müssen laut Rahmenvertrag als Entlassrezepte gekennzeichnet werden (vgl. § 6 Abs. 6 RahmenV) und dürfen nur innerhalb von drei Werktagen zulasten der Gesetzlichen Krankenversicherung beliefert werden. Werktage sind Wochentage von Montag bis Samstag, der Tag der Ausstellung zählt mit.
Arzneimittel mit den Wirkstoffen Lenalidomid, Pomalidomid und Thalidomid dürfen nur auf einem T-Rezept verschrieben werden. Notfall-Verschreibungen sind nicht vorgesehen.
Wirkstoffbezogene Höchstmengen wie bei Betäubungsmitteln gibt es nicht. Die zu überprüfende Höchstmenge bezieht sich auf die individuelle Dosierung für den einzelnen Patienten. Es gibt nämlich einen maximalen Zeitraum, für den verschrieben werden darf: für Frauen im gebärfähigen Alter darf die verschriebene Menge den Bedarf für vier Wochen nicht übersteigen, ansonsten sind es zwölf Wochen. Somit bezieht sich die Höchstmenge auf die individuelle Dosierung für den einzelnen Patienten und der damit verbundenen Anzahl der Packungen mit der entsprechenden Wirkstärke, die dem Patienten verschrieben worden sind. Gibt es Unsicherheiten bezüglich der verschriebenen Menge, muss die Apotheke Rücksprache mit dem Arzt beziehungsweise der Ärztin halten.
Die Apotheke muss die Durchschrift wöchentlich ans BfArM schicken. Die Bundesoberbehörde rät, beim Verschicken darauf zu achten, dass die Dokumente nicht mit Tesafilm, Heftklammern oder ähnlichem in den Briefumschlägen befestigt sind, um eine Beschädigung zu vermeiden, heißt es.
Das Datum des Versands muss dokumentiert werden.
Auf alle ab dem 15. September 2011 vom BfArM ausgegebenen T-Rezepte darf nur noch eine Verordnung, also nur ein lenalidomid-, pomalidomid- oder thalidomidhaltiges Arzneimittel. Die Verordnung von mehreren Packungen des gleichen Mittels mit derselben Wirkstoffstärke ist aber möglich. Verschiedene Stärken gehen nicht.
Auf die von Anfang 2009 bis zum 14. September 2011 ausgegebenen T-Rezepte können bis zu drei Verordnungen umfassen. Da sie weiterhin gültig sind, können sie auch weiterhin drei Verordnungen umfassen.
§ 17 Abs. 6b ApBetrO regelt die Dokumentationspflichten der Apotheke. Demnach ist beim Erwerb und der Abgabe von Arzneimitteln mit den Wirkstoffen Lenalidomid, Pomalidomid oder Thalidomid und dem Erwerb dieser Wirkstoffe folgendes zu dokumentieren:
Außerdem muss das Datum, an dem der Versand der Durchschriften des T-Rezeptes (Teil II) an BfArM erfolgt ist, vermerkt werden.
§ 17 Abs. 6b ApBetrO sieht keine spezielle Aufbewahrungsfrist vor. Nach Ansicht des BfArM empfiehlt es sich daher, sich an die Vorgaben des 22 Abs. 1 ApBetrO zu halten, also alle Unterlagen, die den Erwerb und die Abgabe von lenalidomid-, pomalidomid- und thalidomidhaltigen Arzneimitteln und den Erwerb dieser Wirkstoffe betreffen, mindestens bis ein Jahr nach Ablauf des Verfalldatums, jedoch nicht weniger als fünf Jahre lang aufzubewahren.
Nein. Arzneimittel, die die Wirkstoffe Lenalidomid, Pomalidomid und Thalidomid enthalten, gehören neben der „Pille danach“ zu den Ausnahmen, für die eine Abgabe auf dem Weg des Versandhandels nicht zulässig ist.
Nach Abschluss der Behandlung sollen nicht verwendete lenalidomid-, pomalidomid- und thalidomidhaltige Arzneimittel unbedingt an die Apotheke zurückzugeben werden. Das ist sowohl der Packungsbeilage als auch der Verpflichtungserklärung im Patientenaufklärungsbogen zu entnehmen. Für die Apotheke gibt es keine besonderen Vorschriften im Umgang mit diesen zurückgenommenen Arzneimitteln.
Ja. Weil es sich um ein stoffbezogenes Risiko handelt, gelten die besonderen Verschreibungs- und Abgabemodalitäten sowohl für die in der EU zugelassenen lenalidomid-, pomalidomid- und thalidomidhaltigen Fertigarzneimittel als auch für thalidomidhaltige Rezepturarzneimittel.
§ 3a AMVV, der die Verschreibung von lenalidomid-, pomalidomid- und thalidomidhaltigen Arzneimitteln regelt, gilt sowohl für den ambulanten Bereich, als auch für den stationären Gebrauch in Krankenhäusern und Kliniken.
Stationsanforderungen sind nicht möglich, es muss patientenbezogen auf einem T-Rezept verschrieben werden.
Analog zum niedergelassenen Bereich handeln die ärztlichen Personen bei der Verwendung der T-Rezepte grundsätzlich eigenverantwortlich. Also muss jede ärztliche Person ihre eigenen T-Rezepte verwenden.
Im Vertretungsfall gilt dasselbe wie bei niedergelassenen Ärzten: Dann darf die Vertretung die Rezepte der Person, die sie vertritt, unterschreiben. Allerdings nur, wenn auch der vertretende Arzt/die vertretende Ärztin die Sachkunde nach § 3a Abs. 5 AMVV gegenüber dem BfArM nachgewiesen hat und im T-Register registriert ist, also selbst T-Rezepte beziehen darf.
Bei den patientenbezogen verschriebenen Packungen lenalidomid-, pomalidomid- oder thalidomidhaltiger Arzneimittel handelt es sich im Normalfall um Endverbraucherpackungen, nicht um Klinikpackungen. Es gelten also die Regeln gemäß 31 Abs. 3 ApBetrO. Dort heißt es: „Arzneimittel aus zur Abgabe an den Verbraucher bestimmten Packungen dürfen nur dann ohne äußere Umhüllung abgegeben werden, wenn auf dem Behältnis die Bezeichnung des Arzneimittels, die Chargenbezeichnung und, soweit für das Arzneimittel vorgeschrieben, das Verfalldatum sowie Aufbewahrungshinweise angegeben sind und die Packungsbeilage hinzugefügt wird.“
Eine besondere Stationsdokumentation ist nicht vorgesehen.
Die Dokumentationspflichten gemäß § 17 Abs. 6b ApoBetrO gelten für Krankenhausapotheken analog.
Quelle: https://www.bfarm.de/DE/Bundesopiumstelle/_FAQ/T-Register/_node.html
Dieser Artikel wurde am 7. März 2022 aktualisiert.

0 Kommentare
Das Kommentieren ist aktuell nicht möglich.