
- DAZ.online
- DAZ / AZ
- DAZ 15/2021
- Nach Verdünnung sechs ...
Pandemie Spezial
Nach Verdünnung sechs Stunden haltbar?
Rechtliche und pharmazeutische Aspekte rund um die Impfstoffaufbereitung
Neben den vielen kursierenden Zitaten und Handlungsanweisungen unterschiedlichster Herkunft muss vorweg eines klargestellt werden:
Die rechtsverbindliche Grundlage ist immer die Fachinformation sowie das Arzneimittelgesetz (AMG) ! Bei diesem Punkt ist die Aufsichtsbehörde sehr eindeutig. Bei der Aufbereitung der Impfstoffe handelt es sich um eine Herstellung im Sinne § 13 Arzneimittelgesetz (Definition § 4 Abs. 14 „Herstellen ist das Gewinnen, das Anfertigen, das Zubereiten, das Be- oder Verarbeiten, das Umfüllen einschließlich Abfüllen, das Abpacken, das Kennzeichnen und die Freigabe; nicht als Herstellen gilt das Mischen von Fertigarzneimitteln mit Futtermitteln durch den Tierhalter zur unmittelbaren Verabreichung an die von ihm gehaltenen Tiere.“).
Die Herstellung in den Arztpraxen ist als erlaubnisfreie Herstellung nach § 13 Abs. 2b AMG abgesichert. Dies erlaubt die Herstellung der fertigen Impfstoffe ohne Herstellungserlaubnis auf Basis des Europäischen Arzneibuches und anhand anerkannter pharmazeutischer Regeln gem. § 55 Abs. 8 Arzneimittelgesetz (AMG). Die Herstellung von Parenteralia (die COVID-19-Impfstoffe fallen unter diese Kategorie) stellt hohe Anforderungen an die personellen und apparativen Voraussetzungen. Das Arzneibuch fordert für Injektionslösungen Sterilität im Endbehältnis (SAL 10-6), von der nur in begründeten Ausnahmen abgewichen werden darf. Im Fall unserer doch recht empfindlichen Impfstoffe ist eine Sterilisation im Endbehältnis nicht praktikabel und technologisch nicht sinnvoll.
Es muss aber mindestens aseptisch (SAL 10-3) gearbeitet werden, um den Anforderungen für Parenteralia bzw. Injektionen noch zu genügen (Ph.Eur. 10.0 5.1.1. „Falls eine Endsterilisation nicht möglich ist, wird eine Herstellung unter aseptischen Bedingungen oder eine Filtration durch einen Bakterien zurückhaltenden Filter durchgeführt.“)
Aseptische Herstellung: nur unter Reinraumbedingungen!
Gerade da die zugelassenen Impfstoffe von Biontech, Moderna, Johnson & Johnson und AstraZeneca in den jeweiligen Mehrdosisbehältnissen nicht konserviert sind, muss bei der Herstellung hohes Augenmerk auf die Qualität gelegt werden.
„Unter aseptischer Herstellung von Arzneiformen ist zu verstehen, dass die notwendigen Wirk- und Hilfsstoffe, soweit das möglich ist, sterilisiert zum Einsatz kommen und dass ihre Verarbeitung mit sterilisierten Gerätschaften und das Abfüllen in sterilisierte Behältnisse erfolgen. Alle diese Arbeitsgänge sind in einer Umgebung der Reinraumklasse A (< 1 KBE/m3 Luft) durchzuführen, um die während des Fertigungsprozesses zwangsläufig auftretenden Asepsislücken möglichst gefahrlos zu überbrücken. Alle aseptischen Maßnahmen sind also darauf ausgerichtet, die Gefahr einer Kontamination, die durch die Keimquellen (nicht sterilisierbarer Wirkstoff, manipulierender Mensch und Arbeitszone, in der die Herstellung der Arznei erfolgt) gegeben sind, zu mindern oder auszuschalten.
Hieraus ergeben sich hohe Anforderungen an die räumliche und apparative Ausstattung sowie die Arbeitsvorbereitung und Arbeitsdurchführung. Bei der Validierung einer aseptischen Herstellung durch Nährmedienabfüllung wird das Kontaminationsrisiko im Allgemeinen auf < 10–3 beschränkt, d. h. von 1000 Abfüllungen ist weniger als eine unsteril.“ (Voigt – Pharmazeutische Technologie 12. Auflage)
Insbesondere der Einsatz von Laminar-Air-Flow-Werkbänken mit bis zu 200-fachem Luftwechsel ist hier unerlässlich.
Auch die Auslegungshilfe für § 13 AMG Abs. 2b konkretisiert genau diese Thematik. Unter 1.2. wird noch einmal festgehalten, dass die Bestimmungen des Arzneimittelgesetzes verbindlich sind. Auch wird der § 8 AMG zitiert: „Nach § 8 AMG ist es verboten, Arzneimittel herzustellen, die durch Abweichung von den anerkannten pharmazeutischen Regeln in ihrer Qualität nicht unerheblich gemindert sind.“ Ferner muss durch den Herstellenden die Unbedenklichkeit der hergestellten Impfdosen sichergestellt werden, da es nach § 5 AMG verboten ist, bedenkliche Arzneimittel anzuwenden. (Bei Verstößen gegen § 5 AMG und § 8 AMG ist mit Freiheitsstrafe bis zu drei Jahren oder Geldstrafe zu rechnen → § 95 AMG)
Unter 3.8.7. wird das Verfahren für die „Portionierung“ der Impfdosen aus einem Mehrfachdosenbehältnis präzisiert, laut Auslegungshilfe liegt hier ein hohes Risiko vor, welches nur unter Reinraumbedingungen erfolgen darf!
Sowohl die Fachinformation als auch die gesonderten Herstellerinformationen fordern eine Herstellung unter Einbeziehung aseptischer Techniken. (Laut anerkannten pharmazeutischen Regeln: Reinraum der Klasse A!)
Verwirrende Anweisungen
Unter Punkt 6.3 „Dauer der Haltbarkeit“ der Produktinformationen zu Comirnaty® ist aufgeführt:
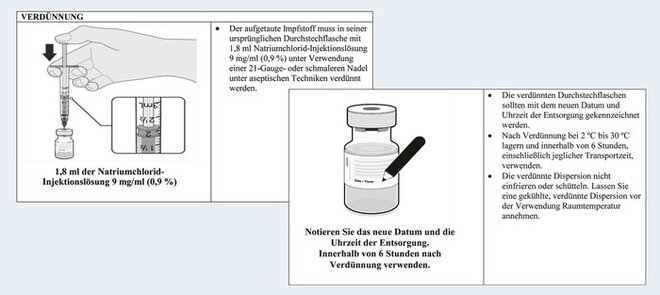
„Verdünntes Arzneimittel: Die chemische und physikalische Stabilität während des Gebrauchs, einschließlich des Transports, wurde 6 Stunden lang bei 2 °C bis 30 °C nach Verdünnung in Natriumchlorid-Injektionslösung 9 mg/ml (0,9%) nachgewiesen. Aus mikrobiologischer Sicht sollte das Produkt sofort verwendet werden. Bei nicht sofortiger Verwendung liegen die Aufbewahrungszeiten und -bedingungen für den Gebrauch in der Verantwortung des Benutzers!“
Den illustrierten Handhabungsanweisungen zufolge (s. Abb.) ist der Impfstoff unter Anwendung „aseptischer Techniken“ zu verdünnen und darf nach 6 Stunden nicht mehr verwendet werden.
Keine Reinraumbedingungen: sofortige Verwendung!
Nur nach sorgfältiger Risikoabwägung des zuständigen Arztes kann die Aufbereitung der Impfstoffe auch außerhalb eines Reinraums erfolgen. Wird der Impfstoff zur sofortigen Verwendung vorbereitet (Die sofortige Verwendung wird seit Urteil des BGH vom 03.11.1981 – V/ZR 119/80 als Zeitraum bis zu einer Stunde definiert), kann auch außerhalb eines Reinraumes gearbeitet werden. Danach muss nicht verbrauchter Impfstoff verworfen werden:
Auslegungshilfe 4.1.: „Wird die Zeitspanne unnötig verlängert oder beträgt diese mehr als eine ‚knappe Stunde‘, so muss von einem ‚erheblichen und leichtfertigen Verstoß gegen die ärztlichen Sorgfaltspflichten‘ ausgegangen werden (Urteil des BGH vom 03.11.1981 – V/ZR 119/80 und Empfehlungen der KRINKO [22 – 25]).“
Im Arzneimittelgesetz unter § 8 Abs. 3 heißt es: „Es ist verboten, Arzneimittel, deren Verfalldatum abgelaufen ist, in den Verkehr zu bringen.“ (Verstöße werden nach § 97 AMG mit Bußgeldern belegt.)
Die Fachinformation für Comirnaty® gibt eine physikalisch-chemische Haltbarkeit in verdünnter Form von sechs Stunden an. „Aus mikrobiologischer Sicht sollte das Produkt sofort verwendet werden. Bei nicht sofortiger Verwendung liegen die Aufbewahrungszeiten und -bedingungen für den Gebrauch in der Verantwortung des Benutzers.“ (s. Kasten „Verwirrende Anweisungen“).
Nun greifen die in der Auslegungshilfe beschriebenen Anforderungen: Um die vollen sechs Stunden Haltbarkeit gesetzeskonform nutzen zu können, ist das Arbeiten unter Reinraumbedingungen unumgänglich. Andernfalls darf maximal eine Stunde vergeben werden.
Nicht zulasten der Qualität!
Bei allen Diskussionen um die Impfgeschwindigkeit in Deutschland darf die Qualität des Arzneimittels nicht in Vergessenheit geraten. Gerade unter dem Druck neuer Mutationen und vereinzelter Impfdurchbrecher muss die korrekte Aufbereitung in den Fokus rücken, damit wir uns auch in Zukunft noch auf den erhofften Impferfolg verlassen können.
Die gesetzlichen Rahmenbedingungen führen sicherlich nicht zu einer Vereinfachung der ohnehin schon komplexen Lage in der Corona-Pandemie, letztendlich muss aber das Wohl des Patienten an allerhöchster Stelle stehen. Die Impfung gegen das Coronavirus ist eine starke Säule zum Weg aus der Pandemie. Daher gilt es, nun wo es durch die Hausärzte auch in die Breite geht, die hohen Qualitätsstandards in Deutschland auch weiterhin aufrecht zu erhalten. |
Weitere Beiträge des Pandemie Spezials in DAZ 2021, Nr. 15
- Testangebot – die wirtschaftliche Seite: Kostenrechnung für Corona-Schnelltests
in Apotheken - Ein bisschen Christkindlesmarkt-Feeling: So testet die Marien Apotheke Bodenmais
- Die verwaiste Kosmetikkabine: So testet die Vital-Apotheke Bad Saulgau
- Zu zweit und nach dem Vier-Augen-Prinzip: So testet die Rathaus Apotheke Hagen
- Schnelltest-Zelt hält Wettertest nicht stand: So testet die Alte Apotheke Feuerbach – theoretisch
- Zwei Impfstoffe für die Arztpraxen: Neue Bestellregeln für Comirnaty® und Vaxzevria®
- Extra-Service ermöglicht Impfstoffanlieferung: Auch auf Amrum können die Hausärzte gegen Corona impfen – dank Apotheke und Großhandel
- Diabetes in Zeiten der Pandemie: Ein gut eingestellter Stoffwechsel schützt vor schweren COVID-19-Verläufen
- Das Dilemma der SARS-CoV-2-Impfstoffbeurteilung: Ein Gastkommentar
- Corona-Ticker: Neues zu SARS-CoV-2 in Kürze
- Woher kommt SARS-CoV-2? Schon Wochen vor dem ersten dokumentierten Fall muss das Virus auf Menschen übergesprungen sein






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.