
- DAZ.online
- DAZ / AZ
- DAZ 6/2021
- Sputnik trumpft auf
Pandemie Spezial
Sputnik trumpft auf
Überraschung: Der russische Vektorimpfstoff soll hoch wirksam und verträglich sein
Die Phase-I/II-Studien zum Vektorimpfstoff Gam-COVID-Vac (Sputnik V) waren im August 2020 mit Hinweisen auf eine starke humorale und zelluläre Immunantwort und eine gute Verträglichkeit abgeschlossen worden. Daraufhin kam es am 11. August 2020 zur provisorischen Zulassung und Anwendung von Sputnik V in Russland bei Hochrisikogruppen. Für die Phase-III-Studie wurden ab dem 7. September 2020 unter Federführung der Entwicklergruppe um Dr. Denis Logunov in 25 Moskauer Krankenhäusern und Polikliniken 22.000 Erwachsene rekrutiert. Die Randomisierung auf Verum oder Placebo erfolgte im (ungewöhnlichen) Verhältnis 3 : 1, die Anwendung erfolgte intramuskulär im Abstand von 21 Tagen. 19.866 Erwachsene erhielten während zwölf Wochen zwei Dosen Impfstoff oder Placebo und kamen in die Endauswertung. Primärer Endpunkt der Phase-III-Studie war der Anteil der Teilnehmer mit einer PCR-bestätigten Diagnose von COVID-19 ab Tag 21 nach Erhalt der ersten Dosis. Ab Tag 21 (dem Tag der zweiten Gabe) wurde bei 16 von 14.964 Teilnehmern (0,1%) in der Impfstoffgruppe und bei 62 von 4902 (1,3%) in der Placebogruppe die COVID-19-Diagnose mittels PCR-Test bestätigt. Die Wirksamkeit des Impfstoffs erreichte demnach in der Gesamtheit der Teilnehmer 91,6% (Konfidenzintervall 85,6 bis 95,2%) [1].
Besser wirksam bei Männern
Die Stratifizierung nach dem Alter (18 bis 30, 31 bis 40, 41 bis 50, 51 bis 60, über 60 Jahre) zeigte mit einer Spanne zwischen 90 und 92,7% eine konsistent gute Wirksamkeit in allen Altersgruppen. Gut jeder Zehnte der Teilnehmenden war über 60 Jahre alt; in dieser Risikogruppe lag die Wirksamkeit bei 91,8%. Der größte Unterschied in der Subgruppenanalyse bestand zwischen den Geschlechtern: 94,2% der Männer waren durch Sputnik V geschützt, aber nur 87,5% der Frauen.
Die weitaus meisten gemeldeten unerwünschten Ereignisse waren leichter Natur, wie grippeartige Beschwerden, Müdigkeit und Lokalreaktionen. 0,3% der Teilnehmer in der Impfstoffgruppe und 0,4% im Placeboarm erlitten schwerwiegende unerwünschte Ereignisse, von denen keines als mit der Impfung in Verbindung stehend angesehen wurde. Auch bei den vier gemeldeten Todesfällen (drei in der Impfstoffgruppe) wurde keiner mit dem Impfstoff in Verbindung gebracht.
„Die Entwicklung des Sputnik-Impfstoffes ist als überhastet und intransparent kritisiert worden, aber die hier berichteten Ergebnisse sind eindeutig und das wissenschaftliche Prinzip der Vakzine wurde belegt“, schreiben Ian Jones und Polly Roy im Kommentar im „Lancet“ [11]. Mit dem proof of principle meinen sie den bisher bei COVID-19 einzigartigen Ansatz, für die Erst- und Booster-Impfung (prime/boost) zwei unterschiedliche Varianten der Vektorvakzine einzusetzen.
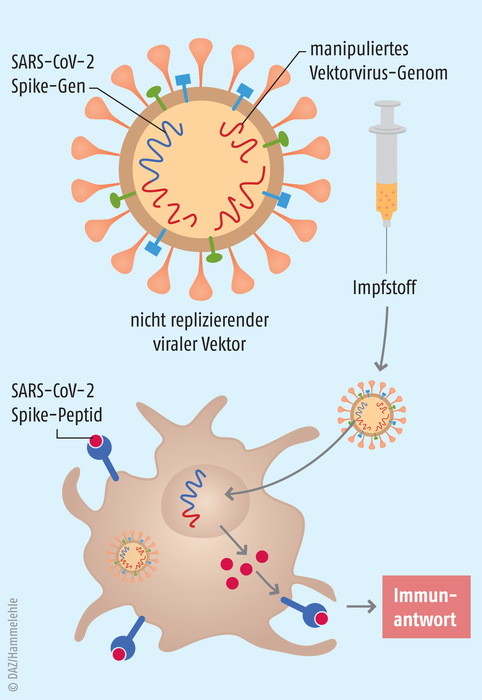
Abb.: Nichtreplizierende virale Vektoren Bei Adenovirus-Vektorimpfstoffen wie Sputnik V wird mittels nichtreplizierender Adenoviren das Erbmaterial für das SARS-CoV-2-Spike-Protein in die Zelle eingeschleust. Da es sich um DNA-Viren handelt, sind diese Informationen in DNA-Form kodiert, die in mRNA umgeschrieben werden. Antigen-präsentierende Zellen präsentieren dann der Immunabwehr Spike-Peptide und lösen so eine Immunantwort aus.
Einziger Impfstoff mit dualem Vektor
Das russische Gamaleya-Forschungszentrum hat mit der Plattformtechnologie, die Adenoviren als „Genfähren“ nutzt, lange Erfahrung. Gam-COVID-Vac stellt einen rekombinanten heterologen Kombinationsimpfstoff dar, der Adenovirus 26 (rAd26-S) und Adenovirus 5 (rAd5-S) als Vektoren nutzt. Beide tragen das gleiche Gen für die Expression des SARS-CoV-2-Spikeproteins in sich. Die Impflinge erhalten im Abstand von 21 Tagen also zwei Impfungen mit unterschiedlichen „Genfähren“. Dahinter steht die Idee, hinderlichen Immunreaktionen auf die erste Dosis vorzubeugen. Über Adenoviren in den Körper geschleuste Antigene sind zwar dafür bekannt, rasch eine Antikörper- und T-Zell-Immunantwort auszulösen – schon nach der ersten Dosis, auch ohne Adjuvanzien. Doch das Immunsystem kann Antikörper auch gegen die Adenoviren bilden. Werden bei der zweiten Impfung die gleichen Adenoviren als Vektoren eingesetzt, wird das Immunsystem die Adenoviren möglicherweise eliminieren, bevor sie in ihre Zielzellen gelangen. Die Booster-Wirkung der zweiten Dosis ist zumindest abgeschwächt.
Die Immunreaktion auf die Vektoren könnte der Grund für die paradoxen Ergebnisse der Studien mit dem AstraZeneca-Impfstoff AZD1222 sein, einem homologen Vektorimpfstoff, der nach einer hohen ersten Dosis nur eine Schutzwirkung von 62% erzielte, hingegen bei einer niedrigen ersten Dosis etwa 90% [2]. Die britischen Entwickler setzten auf ein Adenovirus von Schimpansen (ChAdOx), das bei Menschen in der Regel keine Infektion auslöst. Den Ansatz der homologen Vektor-Vakzine verfolgt auch das Unternehmen Janssen (Johnson & Johnson, Ad26.COV2.S), das nach Zwischenergebnissen einer Phase-III-Studie bei der FDA eine Notfallzulassung beantragt hat [3], und das Beijing Institute of Biotechnology mit dem Ad5-basierten CanSinoBIO-Impfstoff, dessen Phase-III-Studien im September 2020 begannen. Das Gamaleya-Forschungszentrum in Moskau hat den heterologen Ansatz mit zwei unterschiedlichen Vektoren schon 2015 mit der Ebola-Vakzine GamEvac-Combi vorgestellt. Bisher sind die russischen Forscher die einzigen, die das duale Prinzip bei der Entwicklung eines COVID-19-Impfstoffes genutzt haben. Nachdem sie schon im letzten Jahr eine Zusammenarbeit angeboten hatten, wurde eine Kollaboration von AstraZeneca mit den Sputnik-Entwicklern angekündigt [4].
Limitationen der Phase-III-Studie zu Sputnik V
Auf weitere Besonderheiten der russischen Interimsstudie weisen internationale Kommentatoren hin [5].
- Nur symptomatische Patienten wurden gezählt: Der Virologe Prof. Julian Tang, University of Leicester, legt den Fingerzeig darauf, dass die Effektivitätsanalyse lediglich symptomatische Patienten (nach Bestätigung durch PCR-Test) als COVID-19-Fälle zählte. Außer beim Screening und am Tag 21 wurden keine PCR-Tests durchgeführt, es sei denn, die Teilnehmer berichteten selbst COVID-19-typische Symptome. Es könnte also sein, dass ein nennenswerter Anteil asymptomatisch Infizierter nicht erfasst wurde.
- Unklare Dauer des Schutzes: Laut Protokoll erfolgten Untersuchungen der Patienten an den Tagen 28, 42 und 180, aber ohne zwingenden PCR-Test. Die Autoren räumen ein, dass bei der medianen Nachverfolgungszeit von 48 Tagen nach der ersten Dosis keine Aussage über die Dauer der Schutzwirkung gemacht werden kann. Auch die Frage nach einem möglichen Schutz vor Infektiosität, wie sie für die AstraZeneca-Vakzine gezeigt wurde, ist für Sputnik V noch nicht beantwortet.
- Studienprotokoll nicht vollständig veröffentlicht: Dr. Gillies O’Bryan-Tear, ehemals Leiter der klinischen Impfstoffentwicklung bei GlaxoSmithKline, weist auf Unterschiede im Studiendesign zu den Studien von Biontech/Pfizer, AstraZeneca/Oxford und Moderna hin. Der primäre Endpunkt der Sputnik-Phase-III-Studie war der Anteil erkrankter Patienten ab 21 Tage nach der ersten Dosis, während die anderen Impfstoffstudien die vollständigen Ergebnisse nach zwei Dosen reportierten. Umso erstaunlicher erscheint die für Sputnik in der Zwischenauswertung berichtete hohe Wirksamkeit. Dr. O’Bryan-Tear stellt die Validität dieses Ergebnisses nicht infrage, vermisst aber die vollständige Offenlegung des Studienprotokolls, die Aufschluss geben könnte, ob der primäre Endpunkt wie auch das Randomisierungsverhältnis eventuell post hoc im Studienverlauf geändert wurden. Die westlichen Studien hatten Verum- und Placebo-Teilnehmer im Verhältnis 1 : 1 eingeschlossen, die Sputnik-Studie 3 : 1. Die dreifach höhere Verum-Teilnehmerzahl könnte aus ethischen Gründen, sprich der hohen Wirksamkeit der Vakzine, während des Studienverlaufs beschlossen worden sein, wird vermutet.
Indes sind Protokollanpassungen in der derzeitigen Lage nicht singulär, auch in der AstraZeneca/Oxford-Studie war dies im Studienverlauf geschehen, räumt der britische Kommentator ein: Ursprünglich sollte nur eine Dosis des Impfstoffs untersucht werden. Daten aus der Phase-I/II-Studie hatten jedoch gezeigt, dass eine zweite Dosis die Immunreaktion verstärkt [6].
Zulassungsstatus
Der Impfstoff ist in Deutschland und der EU bisher nicht zugelassen. Sputnik V ist nach Herstellerangaben in 16 Ländern registriert: Russland, Belarus, Serbien, Argentinien, Bolivien, Algerien, Palästina, Venezuela, Paraguay, Turkmenistan, Ungarn, Vereinigte Arabische Emirate, Iran, Guinea, Tunesien und Armenien [9]. Darunter ist mit Ungarn auch ein Land der Europäischen Union. Die Frage, ob für deutsche Apotheken im Rahmen eines Einzelimports gemäß § 73 Abs. 3 Arzneimittelgesetz (AMG) die Möglichkeit besteht, den russischen Impfstoff Sputnik V zu beziehen, kann im Moment nicht eindeutig beantwortet werden. Bei Impfstoffen ist zusätzlich zu den Vorgaben zum Einzelimport von in Deutschland nicht (standard)zugelassenen oder (standard)registrierten Arzneimitteln durch eine Apotheke gemäß der in § 73 Abs. 3 AMG genannten Voraussetzungen zu beachten, dass in der Regel keine staatliche Chargenfreigabe gemäß § 32 AMG erfolgte – dies ist bei der Beratung und gegebenenfalls bei haftungsrechtlichen Fragestellungen zu beachten. Zudem sollte grundsätzlich im Vorhinein eruiert werden, ob bzw. inwieweit im Falle einer gesundheitlichen Schädigung durch die Impfung Versorgungsleistungen gemäß § 60 Infektionsschutzgesetz (IfSG) geleistet werden, so die Auskunft der Bayerischen Landesapothekerkammer.
Eine verbindliche Einschätzung, ob der Einzelimport des russischen Impfstoffes Sputnik V nach § 73 Abs. 3 AMG durch eine Apotheke (zum jeweiligen Zeitpunkt) möglich ist, kann nur durch die für die jeweilige Apotheke zuständige Behörde erfolgen.
Potenzial für weltweite Impfungen
Gam-COVID-Vac ist derzeit neben BNT162b2(Comirnaty®
von Biontech/Pfizer) und mRNA-1273 (Moderna) eine der drei COVID-19-Vakzinen mit einer Wirksamkeit von über 90% [8]. Gegenüber den mRNA-Impfstoffen hat der russische Vektorimpfstoff den Vorteil der Lagerfähigkeit bei 2 °C bis 8 °C [9]. Die Biontech-Vakzine muss hingegen bei -70°C transportiert und gelagert werden, die von Moderna soll 30 Tage lang bei 2 °C bis 8 °C stabil bleiben. Sputnik V punktet auch bei den Kosten: Mit einem Preis unter 10 US-Dollar pro Dosis soll er einer der kostengünstigsten Impfstoffe weltweit sein. Laut der Sputnik-Website ist der Impfstoff schon in 16 Ländern registriert. Impfungen sollen Anfang Februar in zwölf dieser Länder beginnen, darunter Ungarn als einzigem Land der Europäischen Union. In den anderen Ländern sei der Impfstoff der erste, der der Bevölkerung zur Verfügung gestellt wird. Die Zulassung für Sputnik V wurde bei der Europäischen Arzneimittelagentur noch nicht beantragt, es hat im Januar 2021 lediglich beratende Gespräche mit der EMA gegeben [10].
Fake News im „Spiegel“?
Online macht das Magazin „Spiegel“ am 8. Februar 2021 mit der Schlagzeile „Zahlendreher, fehlende Daten, verschwundene Probanden“ auf [12]. Bei näherer Betrachtung ist die Kritik am russischen Impfstoff, bei der man sich auf den italienischen Biologen Enrico Bucci beruft, teilweise schlicht falsch und insgesamt geradezu polemisch negativ. Nur zwei Aspekte:
- In der Veröffentlichung im „Lancet“ würden zwei unterschiedliche Probandenzahlen genannt: einmal 21.977 Studienteilnehmer, an anderer Stelle 21.862. Die Erklärung: Es handelt sich um übliche Ausschlüsse von Patienten nach Protokollverletzungen. Wegen verpassten Visiten, fehlerhafter Applikation des Impfstoffs, Randomisierungsfehlern etc. wurden 74 Patienten in der Verum- und 41 in der Placebogruppe von der Auswertung ausgeschlossen. Ein in klinischen Studien normaler und notwendiger Schritt für eine saubere Auswertung, der auch aus der Publikation völlig offensichtlich ist, wird im „Spiegel“ zur „Ungereimtheit“.
- In der Veröffentlichung im „Lancet“ gebe es „Zahlendreher“ bei der Zahl der Teilnehmer, die sich trotz Sputnik-Impfung infizierten: Laut den „Findings“ hätten sich nach 21 Tagen nur 16 von rund 15.000 Probanden angesteckt, an anderer Stelle seien es in dieser Gruppe 61 COVID-19-Fälle an Tag 20. Erklärung: Es handelt sich nicht um Zahlendreher, sondern um Zahlen zu ganz unterschiedlichen Kriterien. Die 16 sind die COVID-19-Erkrankten trotz Impfung, gezählt ab Tag 21 gemäß des primären Endpunkts. Diese Angabe findet sich übereinstimmend in „Findings“ und „Results“. Die 61 sind Personen, die schon vorher erkrankt waren, zu entnehmen der Legende der Abbildung zur kumulativen Inzidenz bestätigter Fälle.
Über 50 Länder sollen Sputnik V schon geordert haben. Die größten Positionen kamen bislang aus Ägypten und Nepal (jeweils 25 Mio. Impfdosen), Argentinien, Brasilien und Venezuela (je 10 Mio. Impfdosen), Mexico (7,4 Mio. Impfdosen) und Bolivien (5,2 Mio. Impfdosen). Es wurden auch Lizenzabkommen zur nationalen Produktion des Impfstoffes geschlossen, unter anderem mit Indien (300 Mio. Dosen), der Republik Korea (150 Mio.) und Brasilien (8 Mio.), mit der Option, dass diese Länder den Impfstoff auch ins Ausland liefern. Weltweite Lizenzen sind nach Ansicht vieler Experten dringlich: „Die ausreichende Herstellung von COVID-19-Impfstoffen könnte noch Monate lang der Flaschenhals bleiben“, sagt Dr. Alexander Edwards von der University of Reading/UK. „Der einzige Weg, ein globales Problem anzugehen, ist eine globale Antwort – das Teilen von Daten, Wissenschaft, Technologien und Arzneimitteln.“ |
Literatur
[1] Logunov DY et al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. Lancet, Published Online 2. Februar 2021, https://doi.org/10.1016/S0140-6736(21)00234-8
[2] Impfstoffe: Warum Sputnik V eine höhere Effektivität gegen SARS-CoV-2 erzielen könnte als AZD1222. Deutsches Ärzteblatt online vom 25. November 2020, www.aerzteblatt.de/nachrichten/118731/Impfstoffe-Warum-Sputnik-V-eine-hoehere-Effektivitaet-gegen-SARS-CoV-2-erzielen-koennte-als-AZD1222
[3] Moll D. Corona-Impfstoff: Janssen: Antrag auf EMA-Zulassung in den kommenden Wochen. DAZ.online vom 5. Februar 2021, www.deutsche-apotheker-zeitung.de/news/artikel/2021/02/05/johnson-amp-johnson-antrag-auf-ema-zulassung-in-den-kommenden-wochen
[4] Kombination der Mittel Sputnik V und AZD1222: AstraZeneca prüft Zusammenarbeit mit Russland bei Corona-Impfstoff. Spiegel online vom 11. Dezember2020, www.spiegel.de/wissenschaft/medizin/coronavirus-astrazeneca-prueft-impfstoff-zusammenarbeit-mit-russland-a-3131ace0-3c83-4ae2-8f15-79872193d45b
[5] O’Bryan-Tear G et al. Expert reaction to study looking at preliminary efficacy and safety results from interim analysis of Russian COVID-19 phase 3 vaccine (Sputnik) trial. 2. Februar 2021, www.sciencemediacentre.org/expert-reaction-to-study-looking-at-preliminary-efficacy-and-safety-results-from-interim-analysis-of-russian-covid-19-phase-3-vaccine-sputnik-trial/
[6] van den Heuvel M. Erste Publikation zur „Oxford-Vakzine“ im Lancet: Was die Daten verraten. Medscape Nachrichten, Stand: 9. Dezember 2020, https://deutsch.medscape.com/artikelansicht/4909529
[7] Voysey M, Costa Clemens SA et al. Single Dose Administration, And The Influence Of The Timing Of The Booster Dose On Immunogenicity and Efficacy Of ChAdOx1 nCoV-19 (AZD1222) Vaccine. Preprint, 1. Februar 2021, https://papers.ssrn.com/sol3/papers.cfm?abstract_id=3777268
[8] Impfstoffe gegen COVID-19: Liste der klinischen Versuche. Infovac - Centre de Vaccinologie CMU, Stand: 2. Februar 2021, www.infovac.ch/de/infovac/aktuell/969-impfstoffe-gegen-covid-19-liste-der-klinischen-versuche
[9] A Vaccine for all mankind: Sputnik V’s efficacy in fighting COVID-19 is validated by internationally peer reviewed data published in The Lancet. The Russian Direct Investment Fund (RDIF), Stand: 2. Februar 2021, https://sputnikvaccine.com/newsroom/pressreleases/a-vaccine-for-all-mankind-sputnik-v-s-efficacy-in-fighting-covid-19-is-validated-by-internationally-/
[10] Number of Sputnik V vaccines bought from Russia 2021, Published by Statista Research Department, 8. Februar 2021, www.statista.com/statistics/1123927/sputnik-v-exports-from-russia-by-country/
[11] Jones I, Roy P. Sputnik V COVID-19 vaccine candidate appears safe and effective. Lancet, Published Online 2. Februar 2021, https://doi.org/10.1016/S0140-6736(21)00191-4
[12] Götze S, Köppe J. Kritik an russischem Impfstoff: Zahlendreher, fehlende Daten, verschwundene Probanden. Spiegel vom 8. Februar 2021, www.spiegel.de/wissenschaft/medizin/corona-impfstoff-sputnik-v-aus-russland-in-der-kritik-zahlendreher-und-fehlende-daten-a-02f720be-f45e-49b1-a348-7931907258d6
Weitere Beiträge des Pandemie Spezials in DAZ 2021, Nr. 6
- Keine frühlingshaften Aussichten: Pharmazie-Professor simuliert Pandemieverlauf und berät politische Entscheider
- Corona-Impfstoffe aus China: Was bislang zu den Kandidaten aus dem Reich der Mitte bekannt ist
- COVID-19-Impfung für Schwangere: Immunisierung kann unter bestimmten Voraussetzungen sinnvoll sein
- Für und wider Pulsoxymeter: Wie können COVID-19-Patienten zu Hause eine drohende Verschlechterung erkennen?
- Corona-Ticker: Neues zu SARS-CoV-2 in Kürze























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.