
- DAZ.online
- DAZ / AZ
- DAZ 21/2020
- Warten auf Evidenz
Pandemie Spezial
Warten auf Evidenz
Ein Update zur Forschung an COVID-19-Therapeutika
Die Datenbank clinicaltrials.gov listet aktuell 850 Interventionsstudien zu COVID-19 (Stand 13. Mai 2020, nicht nur medikamentöse Interventionen), von denen allerdings erst zwanzig als „completed“ ausgewiesen werden. 377 sind „not yet recruiting“, 372 in der Rekrutierungsphase. 93 gehören der Phase I an, 330 der Phase II, 220 der Phase III und 50 der Phase IV.
Das chinesische Clinical trials Register (www.chictr.org.cn) listet 305 Interventionsstudien im Zusammenhang mit COVID-19 (Stand: 13. Mai 2020). 157 sind in der Rekrutierungsphase und nur bei acht ist die Rekrutierung bereits abgeschlossen. Neun sind Phase-I-, sechs Phase-II-, zwei Phase-III- und 59 sind Phase-IV-Studien.
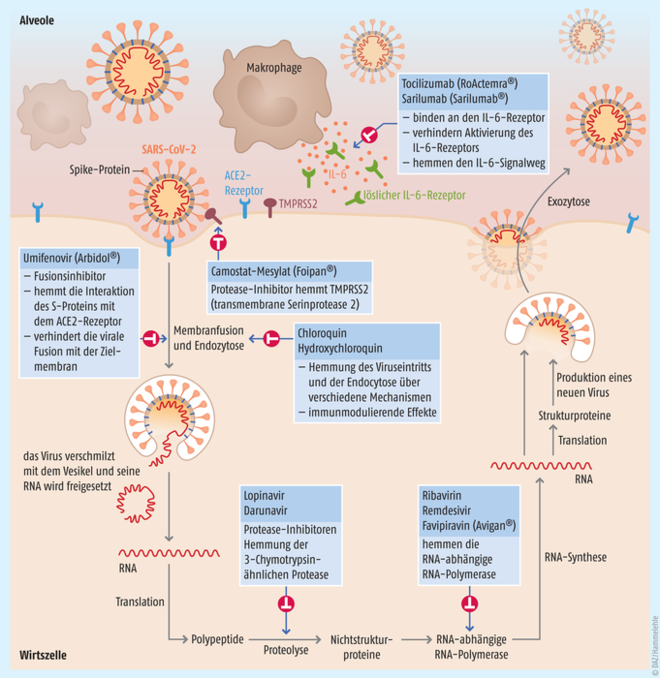
Die rege Entwicklungstätigkeit ist zwar grundsätzlich zu begrüßen, allerdings wird es immer schwieriger die Spreu vom Weizen zu trennen beziehungsweise die berühmte Stecknadel im Heuhaufen zu finden. Abbildung 1 soll einen Überblick verschaffen, an welchen Stellen der Virusvermehrung welche Arzneistoffe angreifen.
Abb. 1: Wirkstoffsuche. Lebenszyklus von SARS-CoV-2 und potenzielle Angriffspunkte für Arzneistoffe [nach Sanders et al., 2020].
Um die klinische Forschung zu rationalisieren, sollen die Unternehmen und Forschungseinrichtungen möglichst gemeinsame multinationale, mehrarmige Studien organisieren. Hier geht die Weltgesundheitsorganisation (WHO) über die SOLIDARITY-Studie mit gutem Beispiel voran. Sie vergleicht an mehreren Tausend Patienten in vier Behandlungsarmen die derzeit vielversprechendsten Wirkstoffe untereinander und mit der Grundbehandlung. An der Studie sollen fünfzehn Länder, darunter auch Deutschland mitwirken. SOLIDARITY ist ein „lebendes“ Modell, das heißt, Studienarme können bei Erfolglosigkeit beendet und neue Arme hinzugenommen werden. Informationen zur Studie finden sich im ISRCTNregistry.
Parallel dazu hat in der EU und UK die Studie DISCOVERY begonnen, die von der französischen Forschungsorganisation INSERM koordiniert wird und 3200 Patienten aus sieben Ländern einbinden soll. Eine weitere große Studie namens RECOVERY haben Mediziner der Universität Oxford in Großbritannien ins Leben gerufen. Außerdem koordinieren die National Institutes of Health (NIH) aus den USA den Adaptive COVID-19 Treatment Trial (ACTT), an dem sich weltweit rund 75 medizinische Einrichtungen beteiligen sollen. Die Studie hat zunächst nur zweiarmig begonnen (Tab. 1).
Medikation | SOLIDARITY | DISCOVERY | RECOVERY | ACTT |
|---|---|---|---|---|
Grundbehandlung allein | + | + | + | + |
Grundbehandlung + Remdesivir | + | + | + | |
Grundbehandlung + Lopinavir/Ritonavir | + | + | + | |
Grundbehandlung + Lopinavir/Ritonavir + Beta-Interferon | + | + (Interferon beta-1a) | ||
Grundbehandlung + Chloroquin bzw. Hydroxychloroquin | + | + | + | |
Grundbehandlung + andere | Dexa-methason, Azithro-mycin, Tocilizumab |
Remdesivir – der Hoffnungsträger
Bei den antiviralen Wirkstoffen ruhen nach wie vor die größten Hoffnungen auf Remdesivir. Die Studienergebnisse sind bislang widersprüchlich. Während die Resultate einer chinesischen randomisierten, doppelblinden und placebokontrollierten Studie (NCT04257656) vom 29. April 2020 eher entmutigend sind – hier war Remdesivir nicht besser als Placebo (Wang 2020) – konnte die Krankheitsdauer im Adaptive COVID-19 Treatment Trial (ACTT, NCT04280705) um einige Tage verkürzt werden. Auch die Daten aus einer Open-Label-Phase-3-Studie (SIMPLE) an 53 Patienten mit schwerer COVID-19-Erkrankung (Grein 2020), waren positiv. Mehr als zwei Drittel der Patienten erlebten nach der Gabe von Remdesivir eine Besserung, obwohl es durch das Fehlen eines Kontrollarms schwer zu beurteilen ist, welche Rolle das antivirale Mittel bei der Genesung gespielt hat.
Weitere Studienergebnisse werden in den nächsten Wochen erwartet. Das BfArM hat derzeit insgesamt vier klinische Prüfungen mit Remdesivir als Prüfpräparat und der Indikation COVID-19 genehmigt, an denen auch deutsche Kliniken beteiligt sind. Alle in diese Studien einbezogenen Patienten sind moderat bis schwer erkrankt und werden stationär behandelt.
Remdesivir-Zulassungen in den USA und Japan
Am 1. Mai 2020 hat die FDA Remdesivir auf der Basis der vorhandenen Daten über eine Notfallgenehmigung (Emergency Use Authorization, EUA) für den Einsatz zugelassen.
Japan folgte diesem Beispiel kurz darauf mit Ausnahmezulassung für das Handelspräparat Veklury® zur Behandlung von Patienten mit schwerem COVID-19.
Der Ausschuss für Humanarzneimittel (CHMP) bei der Europäischen Arzneimittel-Agentur (EMA) hat am 30. April 2020 eine gleitende Überprüfung (Rolling Review) von Remdesivir zur Behandlung von COVID-19 eingeleitet. Damit soll die Agentur ihre Bewertung im Vergleich zu einem regulären Zulassungsverfahren nah am Puls der Wissenschaft deutlich früher abschließen können.
Compassionate Use in der EU erweitert
Trotz fehlender Zulassung ist Remdesivir für die betroffenen Patienten in der Europäischen Union bereits über Compassionate-Use-Programme verfügbar. Die EMA hatte diese zunächst nur für COVID-19-Patienten empfohlen, die eine invasive maschinelle Beatmung benötigen. Die Empfehlung wurde am 11. Mai ausgeweitet auf hospitalisierte Patienten mit nicht-invasiver Beatmung und unter High-Flow-Sauerstofftherapie oder mit ECMO (extrakorporale Membranoxygenierung). Darüber hinaus wurde neben der Zehntagestherapie eine weitere, kürzere Therapiedauer von fünf Tagen eingeführt, und zwar für Patienten, die keine maschinelle Beatmung oder ECMO benötigen. Bei fehlender klinischer Besserung kann die Behandlung dann noch einmal wiederholt werden. Die aktualisierten Empfehlungen zur kürzeren Therapiedauer leitet die EMA aus einer Untersuchung ab, in der eine fünftägige mit einer zehntägigen Behandlungsdauer verglichen worden war (NCT04292899). Auch in Deutschland wird Remdesivir in Härtefallprogrammen untersucht.
HIV-Therapeutikum Lopinavir/Ritonavir
Die Suche nach Lopinavir/Ritonavir in clinicaltrials.gov liefert aktuell rund 30 Einträge, in denen die HIV-Kombination vielfach in Kombination mit dem MS-Therapeutikum Interferon-Beta getestet wird. Etwa zwei Drittel der Studien befinden sich in der Rekrutierungsphase.
Eine bereits abgeschlossene offene randomisierte und kontrollierte Studie an 199 hospitalisierten Personen in China (ChiCTR2000029308) hat die Erwartungen leider nicht erfüllt. Möglicherweise sind die Patienten zu spät behandelt worden, möglicherweise war die Dosis zu niedrig. Vielleicht liefern die Verbundprogramme SOLIDARITY, DISCOVERY und RECOVERY bessere Resultate, in denen die Kombination auch zusammen mit Beta-Interferon verabreicht wird, siehe hierzu auch Kasten „Vorteil für Triple-Therapie aus Ribavirin, Lopinavir/Ritonavir und Interferon beta-1b?“.
Vorteil für Triple-Therapie aus Ribavirin, Lopinavir/Ritonavir und Interferon beta-1b?
Eine multizentrische, prospektive, offene, randomisierte Phase-2-Studie bei Erwachsenen mit COVID-19 aus Hongkong (NCT04276688) bewertete die Wirksamkeit und Sicherheit von
- zweimal täglich 400 mg Lopinavir plus 100 mg Ritonavir, 400 mg Ribavirin und, sofern die Medikation an den Tagen eins bis sechs nach Symptombeginn gestartet wurde, abhängig von der Dauer seit Eintreten der Symptome eine bis drei Dosen von 8 Millionen I.E. Interferon beta-1b (Kombinationsgruppe)
- gegen zweimal täglich 400 mg Lopinavir plus 100 mg Ritonavir alleine (Kontrollgruppe) jeweils über 14 Tage.
Der primäre Endpunkt war die Zeit bis zu einem negativen nasopharyngealen Abstrich. Zwischen dem 10. Februar und dem 20. März 2020 wurden 127 Patienten rekrutiert. Die Kombinationsgruppe hatte eine deutlich kürzere mediane Zeit vom Beginn der Studienbehandlung bis zum negativen Nasopharyngealabstrich (7 Tage) als die Kontrollgruppe (12 Tage). Die frühe dreifache antivirale Therapie war der alleinigen Therapie mit dem HIV-Therapeutikum Lopinavir/Ritonavir aber nicht nur in dieser Hinsicht überlegen. Sie linderte die Symptome innerhalb von vier Tagen vollständig und damit in einer deutlich kürzeren Zeit als die Kontrolle mit acht Tagen. Die Dreifachkombination unterdrückte auch die IL-6-Spiegel und führte zu kürzeren Krankenhausaufenthalten. Die Therapie erwies sich auch als sicher, mit geringeren und selbstbegrenzenden gastrointestinalen Nebenwirkungen.
UAW unter Chloroquin und Hydroxychloroquin
Nach den Ergebnissen mehrerer klinischer Studien aus China sollen Chloroquin und Hydroxychloroquin in unterschiedlichem Ausmaß wirksam gegen die COVID-19-assoziierte Lungenentzündung sein. In einer kleinen offenen, nicht-randomisierten klinischen Studie aus Frankreich zeigte Hydroxychloroquin einen positiven Effekt in Kombination mit Azithromycin (Gautret 2020). Die Verbund-Studienprogramme (siehe Tab. 1), in die entsprechende Kombinationen ebenfalls eingebunden sind, werden hoffentlich neue Erkenntnisse liefern. Ungeachtet dessen hat die FDA bereits eine Notfallzulassung für die Verwendung von Hydroxychloroquin zur Behandlung von COVID-19 in den USA erteilt.
Ein großer Nachteil bei dem Malariamittel ist das stattliche Nebenwirkungspotenzial. So kann es unter der Anwendung zu einer Verlängerung des QT-Intervalls kommen (s. a. DAZ 2020, Nr. 13, S. 46).
In einer doppelblinden randomisierten, adaptiven, zweiarmigen Phase-IIb-Studie in Brasilien (CloroCOVID19, NCT04323527) musste der Hochdosis-Arm mit zweimal täglich 600 mg Hydroxychloroquin vorzeitig gestoppt werden, nachdem einige Patienten gefährliche Herzrhythmusstörungen bekommen hatten. Im Universitätsklinikum in Nizza (CHU) waren ähnliche Komplikationen aufgetreten. Azithromycin, das zusätzlich gegeben worden war, soll ebenfalls Herzrhythmusstörungen begünstigen. Die Kombination mit Azithromycin wird aktuell in zahlreichen weiteren COVID-19-Studien erprobt.
Auch die europäische Arzneimittel-Agentur (EMA) erinnert auf ihrer Webseite an das Risiko schwerwiegender Nebenwirkungen, besonders Herzrhythmusstörungen, bei Anwendung von Hydroxychloroquin (und Chloroquin).
Das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) hat festgestellt, dass derzeit keine Belege zur Wirksamkeit und Sicherheit von Hydroxychloroquin für die Behandlung von COVID-19 aus prospektiven randomisierten kontrollierten klinischen Prüfungen vorliegen. Der Wissensstand sei noch sehr limitiert und im stetigen Wandel.
„Heißer Anwärter“ Favipiravir
Auch der antivirale RNA-Polymerase-Inhibitor Favipiravir gilt als „heißer Anwärter“ unter den raren Therapieoptionen gegen SARS-CoV-2. In Japan ist Favipiravir unter dem Handelsnamen Avigan® seit 2014 zur Behandlung der Influenza zugelassen, allerdings nur als Zweitlinienmedikation. Seit Februar 2020 wird Favipiravir in China zur Behandlung von COVID-19 getestet. Es soll in einer klinischen Studie mit 70 COVID-19-Patienten in Shenzhen bereits vielversprechende Ergebnisse geliefert haben. Im US-Studienregister clinicaltrials.gov sind drei Studien mit Favipiravir gegen COVID-19 eingetragen (NCT04310228, NCT04333589, NCT04303299), davon zwei in verschiedenen Krankenhäusern in China. Das Studienende ist mit Mai bzw. November 2020 angegeben.
Auch Fujifilm, das Unternehmen hinter Favipiravir, hat am 31. März den Start einer Phase-III-Studie mit Avigan®-Tabletten gegen COVID-19 angekündigt. In Europa hat die italienische Arzneimittelbehörde AIFA den versuchsweisen Einsatz von Favipiravir gegen COVID-19 in Studien am 22. März genehmigt.
Influenza-Mittel Umifenovir
Umifenovir (Arbidol) ist in Russland und China für die Behandlung von Influenza-Virus-Infektionen zugelassen. Es soll die virale Fusion mit der Zielmembran hemmen, wodurch das Eindringen des Virus in die Zelle blockiert wird. In China wurde Favipiravir gegen Umifenovir in einer randomisierten offenen multizentrischen Studie im Zeitraum vom 20. Februar 2020 bis zum 12. März 2020 getestet. Die 7-Tage-Erholungsrate für die Umifenovir-Gruppe betrug 55,86%, die der Favipravir-Gruppe 71,43% (Chen, 2020). In weiteren Studien wird Umifenovir mit einer Grundbehandlung (NCT04260594) sowie mit Oseltamivir und Lopinavir/Ritonavir (dreiarmig, NCT04255017) verglichen, mit Lopinavir/Ritonavir (NCT04252885) und mit dem Antibiotikum Carrimycin (NCT04286503).
Eintritt verhindern mit Camostat?
Ein weiterer Kandidat ist der Protease-Inhibitor Camostat. Das Handelspräparat mit dem Salz Camostat-Mesilat (Foipan®) ist in Japan schon seit 2006 zugelassen. Indikationen sind Entzündungen der Bauchspeicheldrüse und postoperative Refluxösophagitis.
Camostat-Mesilat hemmt die transmembrane Serinprotease 2 (TMPRSS2), ein zelluläres Protein, das für den Eintritt des Virus in die Wirtszelle verantwortlich ist. Forscher von der Berliner Charité wollen so bald wie möglich eine Studie starten, in der COVID-19-Patienten mit Camostat-Mesilat behandelt werden. In Dänemark steht eine Investigator-initiated Randomized, Placebo-controlled, Phase IIa-Studie mit dem Kürzel CamoCO-19 kurz vor dem Start (NCT04321096).
Ivermectin – warten auf klinische Studien
Bei der fieberhaften Suche nach potenten COVID-19-Therapeutika ist auch das Antiparasitikum Ivermectin in den Fokus des Interesses gerückt. Australische Wissenschaftler hatten beobachtet, dass Ivermectin SARS-CoV-2 in einem Zellmodell innerhalb von 48 Stunden so gut wie vollständig eliminierte. Damit sei aber die Wirksamkeit beim Menschen noch lange nicht bewiesen, geben die Wissenschaftler zu bedenken. Hierzu bedürfe es weiterer präklinischer Tests und vor allem klinischer Studien. Der nächste Schritt soll die Bestimmung der richtigen Dosierung beim Menschen sein.
Europäische Studie mit APN01
Das rekombinante humane Angiotensin Converting Enzym 2 (APN01) von APEIRON Biologics, Wien, wird in einer klinischen Phase-II-Studie mit zunächst 200 schwer an COVID-19 erkrankten Patienten in Deutschland, Österreich und Dänemark getestet (NCT04335136). APN01 soll sowohl die Infektion von Zellen mit SARS-CoV-2 verhindern als auch die COVID-19-Patienten vor schweren Entzündungsreaktionen in der Lunge schützen.
Interferone zur Virenabwehr
Die Interferone sollen SARS-CoV-2 nicht direkt bekämpfen, sondern die körpereigene Virenabwehr verbessern.
Interferon alpha-1b, Interferon alpha-2b (BioCubaFarma bzw. Changchun Heber Biological Technology), Peg-Interferon-alpha 2a (hergestellt von Roche), Peg-Interferon alpha-2b oder Novaferon (Genova Biotech) werden in einer Reihe von Studien mit COVID-19-Patienten entweder alleine oder zusätzlich zu anderen Wirkstoffen erprobt, wobei Alpha-Interferon teilweise in inhalierbarer Form verabreicht wird. Alle sind zumindest in einigen Ländern zur Therapie bestimmter Virusinfektionen wie der Hepatitis B oder C zugelassen.
Demgegenüber besitzen Arzneimittel mit Interferon beta-1a und Interferon beta-1b, die ebenfalls gegen COVID-19 klinisch erprobt werden, in der EU bislang keine Zulassung zur antiviralen Therapie.
Immunmodulatoren gegen Immunreaktionen
Bei schweren Verlaufsformen von COVID-19 kommt es häufig zu überschießenden Immunreaktionen, dem sogenannten „Zytokinsturm“. Zahlreiche Projekte testen Wirkstoffe, die die überschießende Immunabwehr des neuartigen Coronaviruses dämpfen sollen (Tab. 2).
Wirkstoff Handelsname Unternehmen | Wirkstoffklasse | (zugelassene) Indikation | Stand der Forschung (nicht abschließend) |
|---|---|---|---|
Tocilizumab RoActemra® Roche | Interleukin-6-Rezeptor-Antagonist | mehrere rheumatische Erkrankungen, Immunmodulation bei Krebspatienten, die eine CAR-T-Zell-Therapie erhalten | weltweite Phase-III-Studie COVACTA zur Wirksamkeit bei stationären erwachsenen Patienten mit schwerer Covid-19-Pneumonie im Vergleich zu Placebo plus Standardbehandlung (NCT04320615) Diverse weitere Studien, u. a. in China (NCT04310228, ChiCTR200002976), |
Sarilumab Kevzara® Sanofi und Regeneron | Interleukin-6-Rezeptor-Antagonist | Rheuma-Therapie | u. a. placebokontrollierte Phase-II/III-Studie an hospitalisierten Patienten mit COVID-19 in den USA (NCT04315298) |
Canakinumab (Ilaris®) Novartis | Interleukin-1β-Blocker | mehrere Autoimmunkrankheiten | Phase-III-Studie in den USA, Spanien und UK Ende April gestartet (NCT04362813). |
Bevacizumab Avastin® | humanisierter mono-klonaler Antikörper | bestimmte Krebsarten | Studien in China laufen (Phase II/III, NCT04275414) sowie NCT04305106 |
Fingolimod Gilenya® Novartis | Sphingosin-1-Phosphat-Rezeptor-Regulator | multiple Sklerose | Phase-II-Studie in China (NCT04280588) läuft noch bis Juli 2020 |
Opaganib Yeliva® RedHill | Sphingosinkinase-2 (SK2)-Inhibitor | Entwicklung für die Krebsbehandlung | Härtefallprogramm in Italien, Phase-II-Studie in den USA genehmigt. |
Baricitinib Olumiant® Eli Lilly | Januskinase-Inhibitor | rheumatoide Arthritis | Studie in Italien (NCT04358614) bereits abgeschlossen, weitere sieben laufen oder sind geplant |
Ruxolitinib Jakavi® Novartis | Januskinase-Inhibitor | bestimmte Krebsarten | Phase-II-Studie unter der Leitung der Universität Jena gestartet (NCT04338958), weitere 13 laufen oder sind geplant |
Antikörper aus Rekonvaleszentenplasma
Die meisten Projekte zur Neuentwicklung von Therapeutika gegen SARS-CoV-2 beschäftigen sich mit der Verabreichung von „Rekonvaleszentenserum“ also Plasma von Personen, die eine Infektion mit SARS-CoV-2 bereits überstanden haben. An einigen deutschen Kliniken wird die Antikörpertherapie auf Basis von Rekonvaleszentenplasma bereits als Heilversuch praktiziert. Außerdem werden vielerorts Genesene zu den dringend benötigten Plasmaspenden eingeladen. In Deutschland hat das Paul-Ehrlich-Institut (PEI) am 6. April die Genehmigung für eine erste klinische Prüfung mit COVID-19-Rekonvaleszentenplasma erteilt. Die Studie CAPSID (A randomized, prospective, open label clinical trial of convalescent plasma compared to best supportive care for treatment of patients with severe COVID-19), an der mehrere Kliniken teilnehmen werden, soll 106 Patienten einbeziehen.
Außerdem plant das Zentrum für Klinische Studien Köln (ZKS Köln) eine offene Phase-II-Studie zur Bewertung der Wirksamkeit und Sicherheit der Behandlung von COVID-19 -Patienten mit Plasma rekonvaleszenter Patienten (ConVIDence, EudraCT-Nummer 2020-001401-23). Die schweizerische Arzneimittelbehörde Swissmedic hat ebenfalls die erste COVID-19-Therapiestudie mit Rekonvaleszentenplasma genehmigt.
Selektierte Antikörper und Gentherapien
Einige Unternehmen gewinnen auch bereits die Antikörper aus solchem Plasma, um damit Infusionen herzustellen (polyklonales Anti-SARS-CoV-2 Hyperimmunglobulin (H-IG). Hierfür haben sich eine Reihe von Unternehmen in der CoVIg-19 Plasma Alliance zusammengeschlossen. Andere Entwickler versuchen, aus dem Rekonvaleszenten-Serum die am besten geeigneten Antikörper herauszufiltern, um diese dann biotechnisch zu reproduzieren. In Deutschland verfolgt das CORAT-Konsortium diesen Ansatz. Ihm gehören unter anderem das Braunschweiger Biotech-Unternehmen Yumab, das Helmholtz-Zentrum für Infektionsforschung (Braunschweig), die TU Braunschweig und die Universität Tübingen an.
Noch einen Schritt weiter gehen ein Konsortium von Forschungseinrichtungen in den USA im Rahmen der DARPA Pandemic Preparedness Platform wie auch ein Kooperationsprojekt der Unternehmen Ethris und Neurimmune (Planegg bei München und Schweiz). Sie wollen den Erkrankten die mRNA der Gene applizieren, die für die Antikörperproduktion sorgen. Das hört sich genial an, birgt aber noch viele Unsicherheiten, denn bislang gibt es kein zugelassenes Arzneimittel, das auf diesem Prinzip basiert.
AK genesener SARS-CoV- oder MERS-Patienten
Mehrere Projekte für neue Medikamente nutzen außerdem „Rekonvaleszentenplasmen von vormals an SARS-CoV oder MERS erkrankten Personen, um daraus Antikörper (AK) zu gewinnen, die auch gegen SARS-CoV-2 wirken, so zum Beispiel Wissenschaftler der Universität Utrecht (Niederlande) und der Firma Regeneron (REGN3048 und REGN3051). Vir Pharmaceuticals und Alnylam Pharmaceuticals aus den USA wollen sogenannte siRNA-Wirkstoffe entwickeln, die das Virus dadurch blockieren, dass einige seiner Gene ausgeschaltet werden (Gene Silencing).
Wer hat die Nase vorn?
Mitte April hat sich die Zeitschrift Genetic Engineering & Biotechnology News (GEN) mit einem Ranking der Therapieoptionen gegen COVID-19 beschäftigt und die Kandidaten auf der Grundlage ihres bisherigen Entwicklungs- und (gegebenenfalls) klinischen Fortschritts in vier Kategorien unterteilt:
- „Front runner“ (fortgeschrittene Aktivitätsstadien, günstige Daten oder beides): 18 Kandidaten, darunter mehrere Arzneimittel, die in den Medien große Aufmerksamkeit erregt haben, wie Remdesivir, Chloroquin/Hydroxychloroquin, Favipiravir, aber auch Tocilizumab, alleine oder in Kombination mit Favipiravir sowie Sarilumab und Ruxolitinib.
- „Definitely maybe“ (frühere Phasen mit den vielversprechendsten Partnern oder fortgeschritteneren Kandidaten): 17 Kandidaten, darunter Lopinavir/Ritonavir, Danopre-vir, APN01.
- „Keeping an eye on“ (interessante Technologien, jedoch ohne konsistent solide Daten): 70 Kandidaten. Hier werden unter anderem der first-in-class selektive sphingosine kinase-2 (SK2) Inhibitor Opaganib und Camostat-Mesilat einsortiert
- „Too soon to tell“ (noch nicht beurteilbar): 56 Kandidaten.
Zusammenfassung
Zahlreiche potenzielle antivirale Therapien werden im Kontext von COVID-19 diskutiert. Es ist derzeit schwierig bis unmöglich, aus diesem Flickenteppich an Prüfansätzen Voraussagen für die Wirksamkeit oder die Überlegenheit einzelner Wirkansätze abzuleiten. Viele Studien rekrutieren gerade erst ihre Patienten. Manche haben noch nicht einmal damit begonnen. Hier ist also noch einiges an Geduld gefragt. Aus der Sicht des BfArM und der EMA gibt es bisher keinen Wirksamkeitsbeleg aus klinischen Prüfungen, der eine Arzneimittelzulassung rechtfertigen könnte. Insofern bleiben im Moment nur individuelle Heilversuche oder der Einsatz vielversprechender Therapieoptionen im Rahmen von Härtefallprogrammen. Die Zulassungsbehörden haben jedoch unisono signalisiert, dass die Genehmigungsverfahren für klinische Studien und Zulassungen mit hoher Priorität bearbeitet werden. Adaptive Zulassungsmodalitäten erlauben flexible Ansätze, mit denen die Präparate schneller zu den Patienten kommen, ohne dass die sorgfältige Abwägung des Nutzen-Risiko-Verhältnisses darunter leiden muss. |
Literatur
Ahsan W et al.. Treatment of SARS-CoV-2: How far have we reached? Drug Discov Ther. 2020 May 6;14(2):67-72. doi: 10.5582/ddt.2020.03008. Epub 2020 Apr 25.
Beschleunigte Zulassung bei der FDA? Widersprüchliches zu Remdesivir – hilft es bei COVID-19?. DAZ.online vom 30.04.2020
COVID-19. Auch in der Schweiz startet Studie mit Rekonvaleszentenplasma. DAZ.online vom 17.04.2020
Grein J et al.. Compassionate Use of Remdesivir for Patients with Severe Covid-19. N Engl J Med. 2020 Apr 10. doi: 10.1056/NEJMoa2007016. [Epub ahead of print]
Herzrhythmusstörungen. Brasilianische Studie stoppt Hochdosis-Gabe von Chloroquin. DAZ.online vom 16.04.2020
Lopinavir/Ritonavir gegen COVID-19. Welche Studien laufen mit Kaletra? DAZ.online vom 15.04.2020.
Phase-II-Studie startet in Deutschland, Österreich und Dänemark. Lösliches ACE2 bei CO-VID-19 auf dem Prüfstand. DAZ.online vom 02.04.2020
Philippidis A. Vanquishing the Virus: 160+ COVID-19 Drug and Vaccine Candidates in Development. Genetic Engineering & Biotechnology News. April 13, 2020. https://www.genengnews.com/a-lists/vanquishing-the-virus-160-covid-19-drug-and-vaccine-candidates-in-development/
Rosa SGV, Santos WC, Clinical trials on drug repositioning for COVID-19 treatment. Rev Panam Salud Publica. 2020 Mar 20;44:e40. doi: 10.26633/RPSP.2020.40. eCollection 2020.
Sanders JM et al.. Pharmacologic Treatments for Coronavirus Disease 2019 (COVID-19): A Review. JAMA. 2020 Apr 13. doi: 10.1001/jama.2020.6019. [Epub ahead of print]
Suche nach Therapien gegen COVID-19. Camostat bald in klinischen Studien gegen SARS-CoV-2. DAZ.online vom 02.04.2020
Tu YF et al.. A Review of SARS-CoV-2 and the Ongoing Clinical Trials. Int J Mol Sci. 2020 Apr 10;21(7). pii: E2657
Vfa. Therapeutische Medikamente gegen die Coronavirusinfektion Covid-19. Update vom 11. Mai 2020. https://www.vfa.de
Wang YM et al.. Remdesivir in adults with severe COVID-19: a randomised, double-blind, placebo-controlled, multicentre trial. Published:April 29, 2020. DOI: https://doi.org/10.1016/S0140-6736(20)31022-9
Wirkstoffkandidaten gegen SARS-CoV-2. Ivermectin als neuer Hoffnungsträger? DAZ.online vom 09.04.2020






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.