
- DAZ.online
- DAZ / AZ
- DAZ 12/2014
- NIR-Spektroskopie in der ...
NIR-Spektroskopie in der Defektur Theoretische Grundlagen der Nahinfrarot-Spektroskopie
NIR-Spektroskopie im Europäischen Arzneibuch
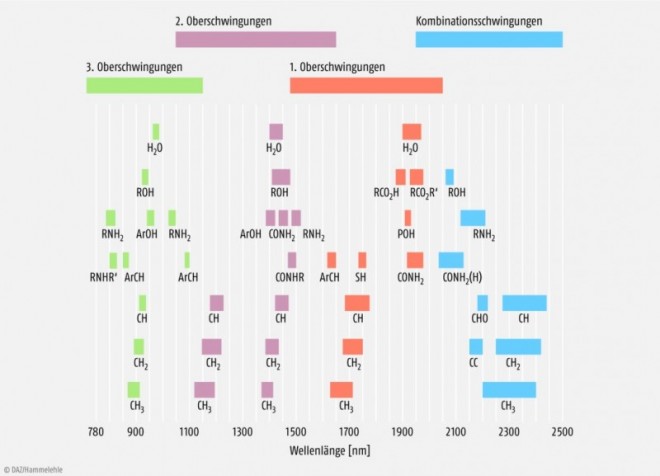
NIR-Strahlung im Sinne des Arzneibuchs ist Infrarotlicht im Wellenlängenbereich von 780 bis 2500 nm bzw. Wellenzahlen von 12.800 bis 4000 cm-1 [1]. Diese Strahlung schließt bei 780 nm unmittelbar an das sichtbare Spektrum an und wird bei 2500 nm von der mittleren IR-Region (seit Ph. Eur. 8.0 auch als MIR bezeichnet) begrenzt, die spektroskopisch insbesondere zur Identifizierung von Arzneistoffen häufig die Methode der ersten Wahl darstellt. In der NIRS werden Wechselwirkungen mit Materie in Form von Molekülschwingungen und dadurch bedingte Absorptionen durch erste bis dritte Oberschwingungen sowie Kombinationsschwingungen der ansonsten in der MIR-Region auftretenden Grundschwingungen beobachtet. In der Hauptsache treten Oberschwingungen auf, deren Grundschwingungen im Bereich zwischen 4000 bis 2000 cm-1 liegen. Dies sind im Wesentlichen Schwingungen von kovalent gebundenen Wasserstoffatomen in Bindungen wie C-H, N-H und O-H (s. Abb. 1). Wegen der in der Regel sehr kleinen Absorptionskoeffizienten für diese Oberschwingungen können Proben mittels NIRS fast immer unverdünnt, also ohne Probenvorbereitung, vermessen werden. In Sekundenschnelle erhält man ohne Substanzverbrauch Transmissions- oder Reflexionsspektren. Dabei können die Proben – im Gegensatz zur MIR-Spektroskopie – in einem handelsüblichen Glasgefäß vermessen werden. Idealerweise werden Einflüsse des Glasgefäßes dadurch minimiert, dass eine Vergleichsmessung mit dem leeren Messgefäß ebenso durchgeführt wird wie eine Messung eines identischen Gefäßes mit einer Reflexionsreferenz wie Titandioxid oder Talkum oder einem PTFE-Polymer-Standard.
Die NIR-Strahlung durchdringt Glas, flüssige, halbfeste oder feste Proben bei dünner Schichtdicke und lässt eine Messung im Transmissionsmodus zu. Für Feststoffe wird in der Regel aber eine Messung der Reflexion bevorzugt, weil dann keine Limitationen bezüglich der Form eines Festkörpers wie einer Tablette auftreten und häufig bessere Ergebnisse erhalten werden. Pulver werden in der Regel ebenfalls im Reflexionsmodus gemessen und müssen dazu lediglich in ein Probenglas geschüttet werden und stellen bei einer Füllhöhe von mehreren Millimetern praktisch eine unendliche Schichtdicke dar.
Während also die Schichtdicke leicht reproduzierbar ist, beeinflussen unterschiedliche Dichte (Schütt- und Stampfdichte) sowie das Ausmaß der nach unten durchfallenden kleineren Partikel das Spektrum. Ein wiederholtes Aufstampfen des Messgefäßes ist daher sinnvoll, um eine weniger zufällige Bedeckung des Gefäßbodens zu erreichen. Um mit einem für Reflexionsmessungen ausgelegten NIR-Gerät auch Flüssigkeiten oder Salben untersuchen zu können, ohne das Gerät umbauen zu müssen, kann eine reflektierende Oberfläche in die Probe eingebracht werden. Eine reproduzierbare Schichtdicke kann dabei einfach dadurch realisiert werden, dass der verwendete reflektierende Körper an der planen Unterseite definierte Abstandshalter aufweist (Abb. 2). Die NIR-Strahlung durchdringt dann die Probe (Transflexion), wird reflektiert (diffuse Reflexion) und durchdringt die Probe auf dem Weg zum Detektor erneut.
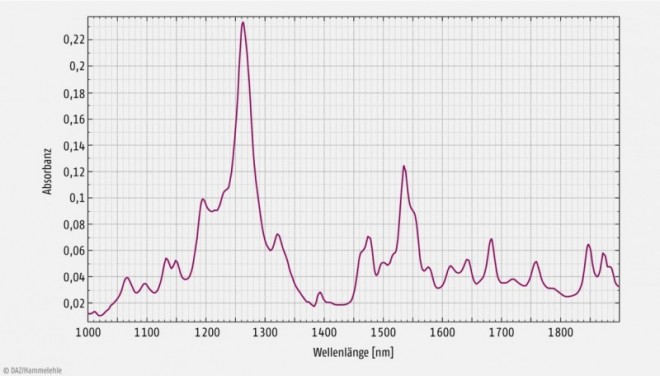
NIR-Spektren sind bandenarm, aber informationsreich und gestatten bei Verzicht auf eine Temperierung von Probe und Detektor vor allem qualitative Aussagen. Eine Reihe physikalischer Parameter (Teilchengröße, Polymorphie) sowie chemischer Parameter (Kristallwasser, adsorbiertes Wasser, Restlösemittel) beeinflussen die Spektren. Dies und der Mangel an scharfen Banden, durch zahlreiche Ober- und Kombinationsschwingungen überlappende Peaks und Schultern, Drift der Basislinie und geringe Signalstärken führten dazu, dass der NIR-Bereich für spektroskopische Zwecke als wenig geeignet galt. Die für die MIR-Spektroskopie entwickelte Interpretationen einzelner Banden lässt sich nicht auf die NIRS übertragen, und die Quantifizierung durch Auswertung einer einzelnen Wellenlänge im Spektrum der Probe ist zwar bei Vorliegen linearer Datenzusammenhänge grundsätzlich möglich, führt aber bei komplexeren Fragestellungen häufig zu unbefriedigenden Ergebnissen. Da die Anwendung chemometrischer Verfahren auch die Auswertung nicht linearer Datenzusammenhänge erschließt, können durch die Kombination der NIRS mit multivariaten Auswertemethoden die Nachteile in der Regel überwunden werden [2–5]. Eine Temperierung und ein höherer apparativer Aufwand sind bei quantitativen Fragestellungen von großer Bedeutung.
Im Bereich der Arzneimittelherstellung wurden die Eignung und Zuverlässigkeit der NIRS von den Aufsichtsbehörden lange als nicht ausreichend belegt angesehen, da kaum valide Untersuchungen publiziert worden waren. In einer Validierungsstudie konnten Plugge und Van der Vlies [6] aber zeigen, dass die NIRS eine geeignete Alternative zu offizinellen Methoden darstellt. Die FDA akzeptierte diese Ergebnisse, und der Einsatz der NIR-Analytik für die beschriebenen Anwendungsbereiche wurde Bestandteil verschiedener Pharmakopöen und ist seit 1997 auch im Europäischen Arzneibuch enthalten [1, 7]. NIRS ist in der Monografie 2.2.40 beschrieben und im Kapitel Kristallinität (5.16) als besonders geeignet zur Untersuchung von polymorphen Kristallformen angeführt [8].
Wegen der geringen Absorption ist die Eindringtiefe der NIR-Strahlung vergleichsweise hoch, und so können neben Haufwerken, halbfesten und festen Zubereitungen sogar sehr inhomogene Proben wie Teedrogen ohne Vorbereitung gemessen werden. Die Identifizierung und In-Prozess-Kontrolle ist damit eine Domäne der NIRS, Spurenanalytik dagegen nicht. Eine Konzentration von mindestens 0,1% des Analyten muss vorhanden sein, um eine Bestimmung durchführen zu können.
Trotz der Vielseitigkeit und Leistungsfähigkeit erfolgt die Verwendung von NIRS-Geräten in der Defekturanalytik noch eher sporadisch. Eine Reihe von Argumenten spricht aber dafür, dass sich dies ändern könnte. Das Arzneibuch (Pharm. Eur. 7.8) forderte bis Ende 2013 beispielsweise unter Datenvorbehandlung: „An understanding of the algorithm is required and in all cases the rationale for the use of transform must be documented.“ Der Anwender musste also die angewendeten Algorithmen verstehen. Diese Anforderung war zu streng, da es eine Vielzahl von mathematischen Methoden gibt, die üblicherweise im Studium nicht angewendet werden. Mit Implementierung der Ausgabe 8.0 im Januar 2014 wurde diese Anforderung abgemildert, denn es wird dort nur noch vorausgesetzt, dass die Anwendbarkeit ausgewählter Algorithmen durch Validierung belegt und dokumentiert wird. In der Praxis ermöglicht dies, bei der Entwicklung individueller Methoden auf Dienstleistungen von Spezialisten zurückzugreifen, ohne selbst chemometrische Verfahren anwenden zu müssen.
NIRS in der Defekturanalytik
Fortschritte in der Miniaturisierung von Bauteilen erlauben den Bau einfacherer und preisgünstiger Geräte, die Kosten der für die Datenbearbeitung notwendigen Computer spielen praktisch keine Rolle mehr. Die novellierte Apothekenbetriebsordnung überträgt zudem mehr Verantwortung in der Zusammenstellung der Laborausstattung an die Apothekenleitung und schreibt eine weitergehende Qualitätskontrolle von in der Apotheke hergestellten Arzneimitteln vor. Die Resolution der Pharmazieräte über die Etablierung einer Risikobeurteilung für die Herstellung von Arzneimitteln differenziert dabei zwischen Anforderungen an die im konkreten Fall notwendige Analytik. Bei einem niedrigen Risikoscore muss keine Analytik nach Industriestandard erfolgen. In dem weiten Feld zwischen der Bestimmung einfacher Surrogatparameter und einer HPLC-Analytik kann die NIRS viele Bereiche abdecken.
NIRS-Anwendungsgebiete in der Defekturanalytik sind:
- Identifikation von Rezepturbestandteilen (Arznei- und Hilfsstoffen) vor und während der Herstellung,
- Identifikation von Teedrogen,
- optional berührungslose und verlustfreie Identifizierung hochpotenter Wirkstoffe und BtM im Originalgefäß aus Glas,
- Identifikation und Qualifizierung von Defekturarzneimitteln nach individueller Erstellung von Referenzdaten.
Die konstruktionsbedingte Leistungsfähigkeit verschiedener NIRS-Systeme führt allerdings dazu, dass sequenzielle Monochromator-Systeme, die ihre Stärke in der extrem effizienten Identifizierung von Arznei- und Hilfsstoffen haben, in der Regel nur bei Zubereitungen aus Stoffen mit einem niedrigen Risikoscore eingesetzt werden können. Sind Quantifizierungen von Rezepturbestandteilen erforderlich, müssen aufwendigere FT-NIR-Systeme mit bauartbedingter Auslegung für diese Anforderung eingesetzt werden (Simultan-Spektrometer mit Interferometer).
In Deutschland marktübliche NIRS-Geräte
Geräte wie das Hiperscan apo-ident verwenden einen schnell rotierenden Scanning-Grating-Spiegel, um monochromatische NIR-Strahlung von ansteigender Wellenlänge auf die Probe zu strahlen. Da die Wellenlängen sehr schnell nacheinander detektiert werden können, können vergleichsweise preisgünstige Thermodetektoren anstelle aufwendigerer Photodiodenzeilen verwendet werden.
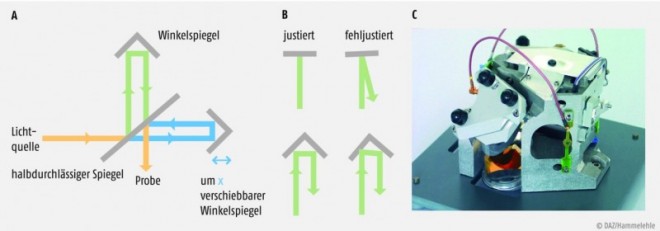
Eine zusätzliche Vereinfachung stellt die Verwendung von nicht thermostatierten Detektoren aus Gallium-Indium-Arsenid dar. Durch Einsatz solcher in der Optoelektronik gängigen Halbleiter-Detektoren können zwar nur Spektren im Bereich zwischen 1000 nm und 1900 nm aufgenommen werden, aufgrund des redundanten Charakters der Informationen aus mehrfachen Oberschwingungen ist für viele Anwendungen der Verzicht auf den Spektralbereich von 1900 bis 2500 nm aber unkritisch. Zur Kalibrierung werden fest eingebaute Proben von Lanthanoxiden mittels Motor regelmäßig in den NIR-Strahl transportiert und gemessen und die Absorptionsmaxima intern von der Gerätesoftware mit den im Arzneibuch geforderten Referenzwerten abgeglichen.Für qualitative und quantitative Fragestellungen entwickelte NIRS-Geräte sind sehr viel aufwendiger gebaut. Einige arbeiten wie MIR-Geräte nach dem Prinzip der Fourier Transformation mithilfe eines Michelson-Interferometers. Hierbei wird die Probe nicht sequenziell mit monochromatischer Strahlung ansteigender Wellenlänge angestrahlt, sondern von allen Wellenlängen simultan. Eine Wolframlampe als thermische Lichtquelle emittiert eine breitbandige IR-Strahlung. Diese fällt auf einen Strahlenteiler, der eine Hälfte des einfallenden Lichtes reflektiert, das dann z.B. auf einen fest montierten Winkelspiegel trifft. Die andere Hälfte des Lichts erreicht einen zweiten, beweglichen Spiegel, der sich auf der optischen Achse präzise um eine Wegstrecke x verschieben lässt (Abb. 4A). Von beiden Spiegeln wird die Strahlung erneut reflektiert. Beim Aufeinandertreffen der Strahlenhälften weisen sie einen Unterschied der doppelten Wegstrecke x auf und interferieren miteinander. Der nun modulierte Strahl trifft auf die Probe und von dort auf einen thermostatierten Halbleiter-Detektor. Zur Steuerung des Interferometers wird in der Regel ein He/Ne-Laser verwendet, um eine erhöhte Wellenlängengenauigkeit und damit präzisere Messungen zu erreichen.
Um eine Unempfindlichkeit gegen mechanische Einflüsse zu erreichen ist ein hoher Aufwand beim Bau solcher Präzisionsgeräte unerlässlich. Bei Winkelspiegeln fallen dabei z.B. durch Erschütterungen bedingte Abweichungen von der idealen Justierung weniger ins Gewicht als bei planen Spiegeln (Abb. 4B). Solche Interferometer-Geräte können auch für die Messung im gesamten IR-Bereich konstruiert werden. PerkinElmer und Thermo (Nicolet) bieten Geräte an, die sowohl Spektren im NIR- als auch im MIR-Bereich registrieren können. Gleich aufwendig, aber bauartbedingt gegenüber mechanischen Einflüssen noch robuster als Michelson-Interferometer sind Polarisations-Interferometer mit einem statischen und einem sich schnell vor- und zurückbewegenden anisotropen Quarzsubstrat-Keil. Dieses Bauteil ermöglicht die Messung im Einstrahlprinzip, weil unter 45° polarisierte polychromatische NIR-Strahlung zunächst in zwei Vektoren zerlegt wird, die den anisotropen Keil mit unterschiedlichen Phasengeschwindigkeiten durchqueren. Durch den bewegten Keil wird die Phasenverschiebung variiert und nach Durchtritt durch den zweiten Kristallkeil ein Interferogramm erhalten. Durch eine Fourier-Transformation können die registrierten Interferogramme in ein Spektrum überführt werden. FT-NIR-Geräte von Bruker, Büchi, Metrohm, PerkinElmer, Thermo oder anderen (aus Platzgründen hier nicht aufgeführten) Herstellern ermöglichen die Aufnahme von Spektren im Bereich von maximal 800 bis 2500 nm.
NIRS und Chemometrie
In der aktualisierten Monografie 2.2.40 gestattet das Arzneibuch den direkten Vergleich von Spektren einer Analysensubstanz mit dem einer Referenzsubstanz, was bisher ausdrücklich ausgeschlossen war. In der Regel werden die Rohdaten aber mit mathematischen Berechnungen so modifiziert, dass störende Faktoren zur Erleichterung der Identifizierung entfernt werden. Dies soll die ermittelten Modelle stabiler gegenüber Unregelmäßigkeiten machen.
Typische Vorbehandlungen für Spektren bestehen in der Umwandlung der Reflexionswerte in Absorptionswerte, Bildung 1. und 2. Ableitungen oder eine Streuungskorrektur in Form einer Multiplikativen Signalkorrektur (Multiplicative Scatter Correction, MSC). Falls diese häufig eingesetzten Operationen nicht zum gewünschten Erfolg führen, stehen dem Analytiker eine Vielzahl weiterer Verfahren zur Verfügung, für die allerdings im Pharmaziestudium kaum Platz ist und die deshalb sinnvollerweise von Spezialisten bei den Geräteherstellern ausgeführt werden.
Die Chemometrie umfasst eine Reihe statistischer Methoden, die es erlauben chemische oder spektroskopische Daten zu interpretieren. Ziel ist es, komplexe Datensätze während einer chemometrischen Kalibrierung auf verwertbare Informationen zu reduzieren, wie beispielsweise die Information zum Gehalt einer Substanz. Die NIR-Spektroskopie ist der erste Anwendungsbereich der Chemometrie, der explizit im Europäischen Arzneibuch aufgeführt wurde. Die ursprünglichen Vorbehalte gegenüber chemometrischen Verfahren basieren möglicherweise auf mangelnder Erfahrung mit dem scheinbaren „Black Box“-Ansatz, da die Spektren nicht wie sonst üblich interpretiert werden und Analysenergebnisse nicht ohne Weiteres nachvollziehbar sind.
Häufig ist es sinnvoll, die Rohdatensätze vor der Erstellung eines Modells zu modifizieren, um unerwünschte Signale auszublenden und erwünschte Signale stärker zu wichten. Beispielsweise können Wellenlängenbereiche identifiziert werden, die für die Vorhersage der relevanten Eigenschaft von hohem Aussagewert sind. Eine wichtige Aufgabe stellt auch das Entfernen bestimmter Teilbereiche des Spektrums dar, welche für die Bestimmung nicht relevant sind bzw. andere Informationen tragen. Ein Ausschluss der Wasserbanden reduziert häufig den Einfluss der Feuchte hygroskopischer Arzneistoffe bei Identitätsprüfungen. Dieses Vorgehen ist keine fragwürdige Datenmanipulation, sondern sinnvoll und notwendig. Dabei ist pharmazeutischer Sachverstand gefragt, denn die unkritische Unterdrückung von Wassersignalen wäre bei der Identifizierung von definierten Hydraten eine Fehlerquelle.
Anschließend an die Datenvorbehandlung können die Daten in einer Hauptkomponentenanalyse (Principal Component Analysis, PCA) oder einer Partial Least Square Regression (PLSR) verarbeitet werden. Auch hier gilt, dass die Vielzahl an mathematischen Methoden nur von Spezialisten beherrscht werden kann.
Charakteristika der NIR-Spektroskopie sind:
- sekundenschnelle Routineanalytik,
- nicht-destruktive Messung,
- minimale oder verzichtbare Probenvorbereitung,
- hoher Informationsgehalt eines Spektrums,
- gleichzeitige Erfassung qualitativer und quantitativer Parameter, physikalischer Zustandsgrößen und chemischer Eigenschaften,
- die erforderliche Auswertung ist häufig nur durch chemometrische Methoden möglich.
Validierung und Kalibrierung
NIR-Spektrometer sind GMP-gerecht qualifizierbar und können einer Prüfmittelüberwachung gemäß Arzneibuch (Ph.Eur. oder auch USP) unterzogen werden. Die Validierung der Auswertemethoden hinsichtlich der Anforderungen des Arzneibuchs dient der Überprüfung der Eignung des erstellten Modells für die Identifizierung der Proben.
Quantitative NIRS-Methoden sind indirekte Analysenmethoden. Die erhaltenen Spektren müssen mit Referenzwerten, die in etablierten Methoden ermittelt werden, in Bezug gesetzt werden. Zudem weisen NIR-Spektren eine Variabilität der optischen Daten auf, die zum Teil im Rauschpegel (noise level) der NIRS-Geräte begründet ist. Einen weitaus größeren Effekt können jedoch Partikelgrößeneffekte, Packungscharakteristik, Verunreinigungen oder unterschiedliche Kristallinität haben. Bei qualitativen Methoden sind diese Herausforderungen sehr viel leichter zu beherrschen, indem bei der Zusammenstellung der Referenzdatenbank genügend verschiedene Proben berücksichtigt und ausgewertet werden. Neue Handelsprodukte mit abweichenden Eigenschaften würden bei einer Identifizierung möglicherweise fälschlich ausgeschlossen, sodass Anbieter von Arzneistoffen ein Interesse daran entwickeln müssten, physikalische Parameter wie Korngrößenverteilung etc. in einem marktüblichen Rahmen zu halten; ein Risiko für Patienten entstünde dadurch nicht.
Treten Arzneistoffe in verschiedenen Kristallformen auf, sind die NIR-Spektren (wie auch die MIR-Spektren) nicht identisch. Deshalb ist es dringend ratsam, in der NIRS für polymorphe Kristallformen unterschiedliche Untergruppen einzuführen. Der Versuch, verschiedene Kristallformen in einem Datensatz zusammenzufassen, ist aufwendig und nicht zielführend. Vielmehr sollte der Analytiker auswählen können, welche Polymorphe der Ausgangsstoffe vorliegen. Praktische Beispiele für Ausgangsstoffe, die in polymorphen Formen vorkommen, sind Ciclopirox-Olamin, Hydrocortison, Dexamethasonacetat, Finasterid oder Triamcinolonacetonid. Sollte ein Hersteller eine nicht marktübliche Kristallform liefern wollen, müsste er damit rechnen, dass die Identitätsbestimmung bei den Kunden fehlschlägt.
Die rückführbaren Standards der Europäischen Arzneibuch-Kommission EDQM werden typischerweise in Mengen von 15 mg gehandelt. Diese Substanzmenge reicht für viele instrumentelle Analysenmethoden aus, nicht aber, um ein NIRS-Messgefäß zu befüllen. Daher müssen handelsübliche Ausgangsstoffe anderweitig, z.B. durch das ZL identifiziert werden, und zwar typischerweise durch die in den Arzneibuchmonografien vorgesehenen Verfahren wie Vergleich von MIR-Spektren, um sie für eine Referenzdatenbank verwenden zu können. Dieses Vorgehen ist sinnvoll, da Eigenschaften von handelsüblichen Ausgangsstoffen bezüglich Partikelgröße und Korngrößenverteilung etc. auf diese Weise bei der Referenzdatenerstellung berücksichtigt werden, und steht einer Validierung der Referenzdatenbank nicht grundsätzlich im Weg.
Bei Defekturarzneimitteln ist die Situation kompliziert. Es ist nicht praktikabel, allgemeingültige Modelle für wirkstoffhaltige Salben zu entwickeln und wie Vergleichsspektren von Arzneistoffen in einer Datenbank abzulegen. Dazu sind die spektralen Eigenschaften von in mehreren Apotheken hergestellten Zubereitungen in der Regel zu unterschiedlich. Zusätzlich würden Abweichungen bei Art und Menge der verwendeten Ausgangsstoffe nicht berücksichtigt werden können. Daher muss stattdessen jede Rezeptur oder Defektur als eigenständige analytische Aufgabe gesehen werden, und z.B. in Zusammenarbeit mit einem Gerätehersteller oder Analytik-Dienstleister gelöst werden. Der Aufwand kann dabei so beträchtlich sein, dass die Methode aus wirtschaftlichen Gründen ausscheidet. Das muss aber nicht in jedem Fall so sein, wie das praktische Beispiel in nachfolgendem Beitrag zeigt. Liegen publizierte Methoden vor, kann eine analoge Erstellung von Referenzspektren auch mit weniger Aufwand erfolgen.
Literatur
[1] Europäisches Arzneibuch 8. Ausgabe, Methoden der Physik und der physikalischen Chemie: 2.2.40 NIR-Spektroskopie. Deutscher Apotheker Verlag, Stuttgart 2014.
[2] Kubelka P, Munk F. Ein Beitrag zur Optik der Farbanstriche. Z. techn. Physik 1931;112(12):593–601.
[3] Kessler W. Multivariate Datenanalyse für die Pharma-, Bio- und Prozessanalytik. 1. Auflage 2007, Wiley-VCH.
[4] Davies AMC. Near Infrared Spectroscopy: Time for the Giant to Wake up. Eur Spectrosc News 1987;73:10–16.
[5] Radtke G, Knop K, Lippold BC. Nahinfrarot (NIR)-Spektroskopie: Grundlagen und Anwendungen aus pharmazeutischer Sicht. Pharm Ind 1999;61:848–857.
[6] Plugge W, Van der Vlies C. Near-Infrared Spectroscopy As an Alternative to Assess Compliance of Ampicillin-Trihydrate with Compendial Specifications. J Pharm Biomed Anal 1993;11(6):435–442.
[7] Europäisches Arzneibuch 8. Ausgabe, Methoden der Physik und der physikalischen Chemie: 2.2.40 NIR-Spektroskopie, Kommentar auf CD-ROM 2011, Wissenschaftliche Verlagsgesellschaft, Stuttgart.
[8] Europäisches Arzneibuch 8. Ausgabe, Allgemeine Texte: 5.16 Kristallinität. Deutscher Apotheker Verlag, Stuttgart 2014.

























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.