
- DAZ.online
- News
- Pharmazie
- Nitrosamine: Behörden ...
NDMA in Metformin
Nitrosamine: Behörden wollen Versorgungsengpässe vermeiden
Stuttgart - 10.03.2020, 11:29 Uhr
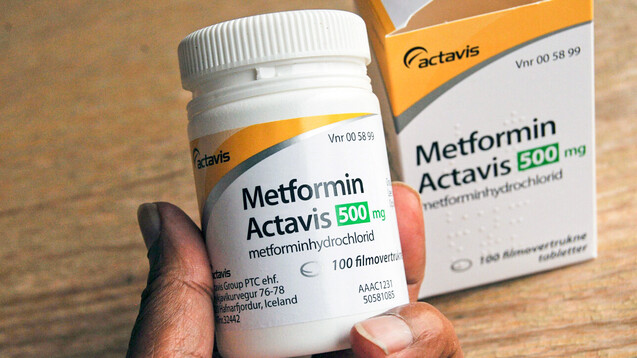
In den USA wurden bislang nur in Metformin von Actavis geringe NDMA-Mengen gefunden. Hier ist ein dänisches Präparat abgebildet. ( t / Foto: imago images / Dean Pictures)
Der Fall um mit Nitrosaminen verunreinigte Arzneimittel ist medial in den Hintergrund getreten. Die US-amerikanische Arzneimittelbehörde FDA hatte Anfang Februar zwar erste Laborergebnisse zur Prüfung von Metformin auf NDMA veröffentlicht, doch die europäische Arzneimittelbehörde EMA äußert sich weiterhin nicht detailliert zu dem Fall. Einer Mitteilung vom vergangenen Mittwoch ist sogar zu entnehmen, dass vor dem 30. April 2020 mit keiner Beurteilung der Situation zu rechnen ist. In Kanada hingegen wurden erste Präparate zurückgerufen.
„Unter Berücksichtigung der Bedenken der Zulassungsinhaber haben die Koordinierungsgruppe für Verfahren der gegenseitigen Anerkennung und dezentrale Verfahren (CMDh) und die EMA vereinbart, dass die Frist für die Einreichung von Prüfergebnissen für Wirkstoffe und metforminhaltige Fertigarzneimittel (die bereits vermarktet werden oder vor der Freigabe stehen) und des zugehörigen Untersuchungsberichts, der die Korrektur- und Vorbeugungsmaßnahmen von Zulassungsinhabern umfasst, in begründeten Fällen bis zum 30. April 2020 verlängert werden kann“, diese Erklärung liest man zum Fall „NDMA in Metformin“ seit dem 4. März 2020 auf dem Internetauftritt des Bundesinstituts für Arzneimittel und Mediziniprodukte (BfArM). Erst nach dem 30. April kann also mit einer Beurteilung durch die nationalen Behörden gerechnet werden. Das Ergebnis dieser Beurteilungen werde mitgeteilt, sobald es verfügbar ist, heißt es.
Mehr zum Thema
Erster Engpass in Deutschland
Metformin: FDA findet NDMA nur in Fertigarzneimitteln, nicht im Wirkstoff
Die US-amerikanische Arzneimittelbehörde FDA hatte hingegen bereits Anfang Februar erste Labor-Ergebnisse zur Prüfung von Metformin auf NDMA veröffentlicht. Daraus ging hervor, dass bislang nur in Metformin von Actavis NDMA gefunden wurde – in Mengen zwischen 0,01 und 0,02 µg. Damit liegt die Menge unter der tolerierten täglichen Aufnahmegrenze von 0,096µg. Bis jetzt hat die FDA somit keine Rückrufaktion für die USA empfohlen. Die Untersuchungen sind aber auch dort noch nicht abgeschlossen.




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.