
- DAZ.online
- News
- Pharmazie
- Nitrosamine: Behörden ...
NDMA in Metformin
Nitrosamine: Behörden wollen Versorgungsengpässe vermeiden
Stuttgart - 10.03.2020, 11:29 Uhr
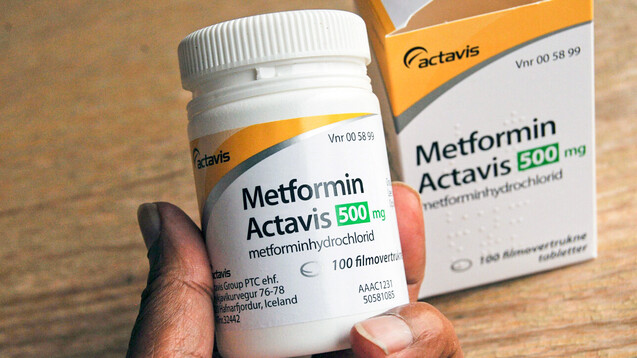
In den USA wurden bislang nur in Metformin von Actavis geringe NDMA-Mengen gefunden. Hier ist ein dänisches Präparat abgebildet. ( t / Foto: imago images / Dean Pictures)
Der Fall um mit Nitrosaminen verunreinigte Arzneimittel ist medial in den Hintergrund getreten. Die US-amerikanische Arzneimittelbehörde FDA hatte Anfang Februar zwar erste Laborergebnisse zur Prüfung von Metformin auf NDMA veröffentlicht, doch die europäische Arzneimittelbehörde EMA äußert sich weiterhin nicht detailliert zu dem Fall. Einer Mitteilung vom vergangenen Mittwoch ist sogar zu entnehmen, dass vor dem 30. April 2020 mit keiner Beurteilung der Situation zu rechnen ist. In Kanada hingegen wurden erste Präparate zurückgerufen.
„Unter Berücksichtigung der Bedenken der Zulassungsinhaber haben die Koordinierungsgruppe für Verfahren der gegenseitigen Anerkennung und dezentrale Verfahren (CMDh) und die EMA vereinbart, dass die Frist für die Einreichung von Prüfergebnissen für Wirkstoffe und metforminhaltige Fertigarzneimittel (die bereits vermarktet werden oder vor der Freigabe stehen) und des zugehörigen Untersuchungsberichts, der die Korrektur- und Vorbeugungsmaßnahmen von Zulassungsinhabern umfasst, in begründeten Fällen bis zum 30. April 2020 verlängert werden kann“, diese Erklärung liest man zum Fall „NDMA in Metformin“ seit dem 4. März 2020 auf dem Internetauftritt des Bundesinstituts für Arzneimittel und Mediziniprodukte (BfArM). Erst nach dem 30. April kann also mit einer Beurteilung durch die nationalen Behörden gerechnet werden. Das Ergebnis dieser Beurteilungen werde mitgeteilt, sobald es verfügbar ist, heißt es.
Mehr zum Thema
Erster Engpass in Deutschland
Metformin: FDA findet NDMA nur in Fertigarzneimitteln, nicht im Wirkstoff
Die US-amerikanische Arzneimittelbehörde FDA hatte hingegen bereits Anfang Februar erste Labor-Ergebnisse zur Prüfung von Metformin auf NDMA veröffentlicht. Daraus ging hervor, dass bislang nur in Metformin von Actavis NDMA gefunden wurde – in Mengen zwischen 0,01 und 0,02 µg. Damit liegt die Menge unter der tolerierten täglichen Aufnahmegrenze von 0,096µg. Bis jetzt hat die FDA somit keine Rückrufaktion für die USA empfohlen. Die Untersuchungen sind aber auch dort noch nicht abgeschlossen.
Metformin-Rückrufe in Kanada
In Kanada hat es hingegen im Februar Metformin-Rückrufe zweier verschiedener Hersteller gegeben. Am 5. Februar waren acht Metformin-Chargen von Apotex Inc. zurückgerufen worden – die enthaltene Menge an NDMA war offenbar zu hoch. Am 26. Februar folgte Ranbaxy Pharmaceuticals Canada Inc. mit dem Rückruf von sechs Chargen Metformin. Zwei der Chargen sollen NDMA-Werte oberhalb des Grenzwertes enthalten haben. Bei den vier restlichen Chargen soll NDMA nahe unterhalb des Grenzwerts enthalten sein.
Sorge vor einem Engpass überwiegt
Rückrufe gibt es wie in den USA auch in Deutschland keine. Tatsächlich hat sich für Deutschland bislang nur bei Metformin von Zentiva – ganz kurzfristig – ein Engpass abgezeichnet: „Fertige Chargen von Metformin sind von uns zur Zeit gesperrt, da diese auf NDMA untersucht werden“, hieß es im Februar. Doch bereits einen Tag später teilte Zentiva DAZ.online mit, dass das Unternehmen wieder ausliefert: „Unsere Produkte wurden getestet und für den Markt freigegeben.“
Mehr zum Thema

Candesartan, Irbesartan, Losartan, Olmesartan, Valsartan
Sartane – BfArM ordnet teils Ruhen der Zulassung an
„Da Metformin als kritisches Medikament gilt, arbeiten die EMA und die nationalen Behörden eng zusammen, um mögliche Versorgungsengpässe zu vermeiden, so dass Patienten weiterhin die benötigten Behandlungen erhalten können“, wird auf der BfArM-Seite vom 4. März erklärt. Ein Metformin-Engpass könnte sich nämlich kritischer auf die Gesundheit der Patienten auswirken, als eine potenzielle NDMA-Verunreinigung: „Im Einklang mit vorherigen Empfehlungen, sollen Patienten ihre metforminhaltigen Arzneimittel weiterhin wie gewohnt einnehmen. Das Risiko einer unzureichenden Behandlung eines Diabetes überwiegt bei weitem die möglichen Risiken, die sich aus der Aufnahme geringer Nitrosamin-Konzentrationen ergeben.“
Auch nichts Neues bei Ranitidin
Im Rahmen eines durch den Ausschuss für Humanarzneimittel (CHMP) der EMA eingeleiteten Verfahrens werden derzeit auch die Ursachen für das Vorhandensein von NDMA in einigen Chargen von Ranitidin untersucht. Laut ursprünglichem Zeitplan der EMA war hier mit einem Ergebnis Ende Februrar zu rechnen – doch dieses steht noch aus.

Keine Nitrosamin-Bildung im Magenmilieu
Ranitidin: FDA hat erhöhte NDMA-Werte veröffentlicht

Neue Arzneibuch-Monographie
Nitrosamin-Kontrollen für alle Stoffe kommen ins Europäische Arzneibuch
Bei Sartanen, Metformin und Ranitidin soll es jedenfalls nicht bleiben: Alle Marktzulassungsinhaber für Humanarzneimittel, die chemisch synthetisierte Wirkstoffe enthalten, müssen ihre Arzneimittel „vorsorglich“ auf das mögliche Vorhandensein von Nitrosaminen prüfen. Dazu hatte der Ausschuss für Humanarzneimittel der EMA (CHMP) Ende September 2019 bereits aufgefordert. Nach der Risikobewertung durch die Unternehmen sollen diese dann alle gefährdeten Produkte auch analytisch testen. Die Risikobewertung sollte spätestens bis Ende März 2020 abgeschlossen sein.




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.