
- DAZ.online
- DAZ / AZ
- DAZ 34/2022
- Opiumtinktur im ...
DAZ aktuell
Opiumtinktur im Versandgefäß ist kein Fertigarzneimittel
Entscheidung des Bundesinstituts für Arzneimittel und Medizinprodukte
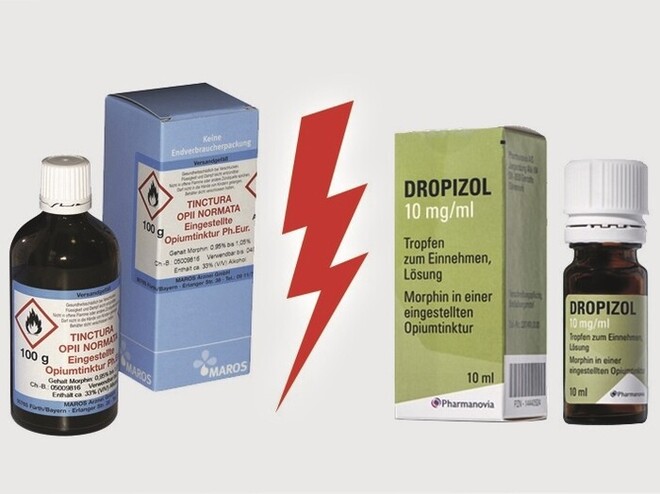
Die Maros GmbH, die Opiumtinktur für Rezepturzwecke anbietet, und die aufgrund von Übernahmen und Umfirmierungen wechselnden Herstellerfirmen eines Opiumtinktur-haltigen Fertigarzneimittels streiten schon lange über die Rechtsstellung des Produktes von Maros. Parallel dazu hatte die Regierung von Oberfranken am 20. Mai 2019 beim BfArM nach § 21 Abs. 4 AMG beantragt, über die Zulassungspflicht zu entscheiden.
Fertigarzneimittel muss für Verbraucher bestimmt sein
Nach über drei Jahren hat das BfArM in einem Bescheid vom 16. August erklärt: „Da das Produkt kein Fertigarzneimittel ist, unterliegt es nicht der Zulassungspflicht nach § 21 Absatz 1 AMG.“ Gemäß dem Bescheid, der der DAZ vorliegt, ist das Produkt ein Funktionsarzneimittel. Weiter heißt es, dass alle Alternativen in der Definition für Fertigarzneimittel gemäß § 4 Abs. 1 AMG das Merkmal „zur Abgabe an den Verbraucher“ voraussetzen. Doch diese Voraussetzung liege hier nicht vor, erklärt das BfArM. Zur Abgabe an den Verbraucher bestimmt sei ein Arzneimittel, wenn es mit einer entsprechenden Zweckbestimmung versehen sei. Zudem müsse es gebrauchsfertig sein. „Ein Arzneimittel, das objektiv nicht zur Abgabe an Verbraucher bestimmt ist, weil es noch weiterer Handlungsschritte in der Apotheke bedarf, ist kein Fertigarzneimittel“, erklärt das BfArM. Erst die Abfüllung in der Apotheke in ein Behältnis mit betäubungsmittelrechtlich zulässiger Abgabemenge mache das Arzneimittel gebrauchsfertig.
Das BfArM erläutert dazu, die Maros GmbH bringe das Produkt in einer nicht zur Abgabe an den Verbraucher bestimmten Packung ohne die für Fertigarzneimittel vorgeschriebene Kennzeichnung in Verkehr. Es habe keine Packungsbeilage, keine Dosierhilfe und keine Kindersicherung. Außerdem lägen die Gebindegrößen über der betäubungsmittelrechtlichen Verordnungshöchstmenge für Endverbraucher. Es sei davon auszugehen, dass das Produkt von Apotheken über den Großhandel bezogen werde, um im Einzelfall daraus ein Rezepturarzneimittel herstellen zu können. Außerdem sei davon auszugehen, dass dabei die DAC/NRF-Rezepturhinweise beachtet würden. Da das Produkt nicht zur Abgabe an Verbraucher bestimmt sei, komme es auf Fragen einer gewerblichen Herstellung und auf weitergehende Fragen zur Herstellung nicht an. Da es kein Fertigarzneimittel sei, unterliege es nicht der Zulassungspflicht.
Das BfArM hat entschieden: Maros-Opiumtinktur, die im Versandgefäß für die Rezeptur in der Apotheke angeliefert wird, ist kein Fertigarzneimittel.
Lange Geschichte vor Gerichten
In früheren Rechtsstreitigkeiten auf der Herstellerebene hatten das Landgericht Hamburg und das Hanseatische Oberlandesgericht ebenfalls entschieden, dass die Opiumtinktur von Maros kein Fertigarzneimittel sei (siehe DAZ 2020, Nr. 21, S. 16). Das Landgericht Düsseldorf hatte dagegen im Juni 2021 entschieden, das Produkt sei doch ein Fertigarzneimittel. Das Berufungsverfahren gegen diese Entscheidung ist anhängig. Das Gericht hatte bereits eingeräumt, dass das Inverkehrbringen durch einen Verwaltungsakt ausdrücklich erlaubt sein könnte und eine mögliche Entscheidung des BfArM gemäß § 21 Abs. 4 AMG erwähnt. Auf die damals ausstehende Entscheidung des BfArM hatte das Landgericht Düsseldorf aber nicht warten wollen (siehe DAZ 2021, Nr. 25, S. 14). Doch nun hat das BfArM im umgekehrten Sinn entschieden. Auch die Hersteller eines Opiumtinktur-Fertigarzneimittels hatten in Briefen an Apotheken unter anderem mit der angeblichen Fertigarzneimitteleigenschaft der Opiumtinktur von Maros argumentiert.
Folgen für Streit auf Apothekenebene?
Von diesen Fragen auf der Herstellerebene muss der Rechtsstreit auf der Apothekenebene unterschieden werden. Das Landgericht Hamburg hatte einer einzelnen beklagten Apotheke verboten, Opiumtinktur abzufüllen. Es hatte am 4. Februar 2021 entschieden, dass dies die Herstellung eines Fertigarzneimittels ohne Zulassung sei (siehe DAZ 2021, Nr. 11, S. 20). Auch gegen diese Entscheidung läuft das Berufungsverfahren. Die jüngste Entscheidung des BfArM bezieht sich zwar auf die von Apotheken bezogene Opiumtinktur und nicht auf die in Apotheken abgefüllte Ware. Doch heißt es im Bescheid des BfArM, es sei davon auszugehen, dass das Produkt von Apotheken bezogen werde, „um im Einzelfall aufgrund einer vorliegenden Verschreibung ein Rezepturarzneimittel im Sinne von § 1a Absatz 8 ApBetrO herstellen zu können“. Von einem Fertigarzneimittel ist dort keine Rede. Zudem verweist das BfArM hier auf einen DAC/NRF-Rezepturhinweis.
Die Entscheidung des BfArM könnte auch zu einem neuen Impuls für den berufspolitischen Umgang mit problematischen Gerichtsentscheidungen zum Rezepturprivileg werden. Die ABDA hatte stets betont, dass Urteile nur Rechtswirkung für die unmittelbar Beteiligten haben, und daher auch aus der Entscheidung gegen eine einzelne Apotheke keine weiteren Konsequenzen abgeleitet. Dagegen hatte der Apothekerverband Westfalen-Lippe vor der unveränderten Abfüllung von Opiumtinktur als Rezepturarzneimittel gewarnt und dabei insbesondere auf das Urteil des Landgerichts Düsseldorf verwiesen, das nun im Widerspruch zur Entscheidung des BfArM steht (siehe DAZ 2021, Nr. 32, S. 18). |





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.