
- DAZ.online
- DAZ / AZ
- DAZ 33/2021
- Spieglein, Spieglein
Stereochemie
Spieglein, Spieglein …
... wer ist der aktivere Arzneistoff?
Derzeit fühlt man sich zurückversetzt in die 1990er-Jahre. Damals wurde in der Fachwelt über den „chiral switch“ diskutiert, das heißt über Zulassungen von Enantiomeren bekannter Racemate. Und tatsächlich, die Bestrebungen zur Zulassung von Eszopiclon existieren schon weit länger als 15 Jahre. Diese Zulassung soll im folgenden Artikel zum Anlass genommen werden, um zu klären, ob Racemate nur unnützen, oder sogar schädlichen Ballast in der Arzneistoffanwendung darstellen, deren Ersatz durch Enantiomere jegliche Aufwendungen rechtfertigt.
Zopiclon (Ximovan®, diverse Generika) ist in Deutschland seit ca. 30 Jahren als ein Mittel zur kurzzeitigen Behandlung von Schlafstörungen (Insomnien) zugelassen. Zopiclon ist dabei als eine der sogenannten Z-Substanzen, bekannt, zu denen auch Zolpidem (Stilnox®, Bikalm®, Generika) und das in Deutschland nicht mehr vertriebene Zaleplon gehören. Die Z-Substanzen entfalten ihre Wirksamkeit an ionotropen GABAA-Rezeptoren. Als allosterische Aktivatoren verstärken sie die Wirksamkeit der Gamma-Aminobuttersäure (GABA) als inhibitorischen Neurotransmitter, durch die der Einstrom von Chlorid-Ionen in die Zelle ermöglicht und damit die neuronale Transmission verringert wird. Dabei zeigen die Z-Substanzen eine Analogie zum Wirkmechanismus der Benzodiazepine [1] und werden daher oftmals auch als Benzodiazepin-Rezeptoragonisten bezeichnet. Allerdings unterscheiden sie sich im pharmakologischen Profil von den Benzodiazepinen, woraus auch eine geringere Gefahr der Toleranz- oder Abhängigkeitsentwicklung resultiert. In der Verschreibungshäufigkeit steht Zopiclon mit 41,2 Mio DDD in Deutschland 2019 an der Spitze der verwendeten Hypnotika und übertrifft damit die Verordnungszahlen des Zolpidems um das Doppelte und aller Benzodiazepine gemeinsam um mehr als das Dreifache [2].
Chemisch gesehen ist Zopiclon ein Cyclopyrrolon-Derivat (Abb. 1), das auch über ein Chiralitätszentrum verfügt, das heißt über ein asymmetrisch substituiertes C-Atom.
Wie war das noch mit der Stereochemie?
Chemisch definierte Arzneistoffmoleküle weisen häufig ein oder sogar mehrere Chiralitätszentren auf, das heißt, dass an einem Kohlenstoffatom vier verschiedene Bindungspartner existieren. Dies führt zu einer bestimmten räumlich festgelegten Konformation. Bei Vorliegen nur eines Chiralitätszentrums resultieren so zwei nicht mehr deckungsgleiche, aber spiegelbildlich zueinander auftretende Moleküle. Entsprechend der Cahn-Ingold-Prelog-Regel (CIP) werden nach Priorisierung der Substituenten dann (R)- und (S)-Enantiomere voneinander unterschieden. Chirale Verbindungen drehen die Schwingungsebene von linear polarisiertem Licht (optische Aktivität), wobei aber die Drehrichtung und der Drehwinkel bei polarimetrischen Messungen nicht mit der (R)- oder (S)-Priorisierung übereinstimmen müssen (s. Beitrag „Licht, das sich ‚dreht‘“ auf Seite 48 in dieser Ausgabe).
Wird eine Arzneistoffsynthese ohne gezielte Steuerung der Raumstruktur achiral durchgeführt, resultiert dann bei einem Chiralitätszentrum im Molekül ein racemisches Gemisch des Arzneistoffes, das heißt die äquimolare Mischung der beiden spiegelbildlichen Enantiomere. In einer räumlich nicht festgelegten Umgebung, z. B. in einer Lösung, verhalten sich die Enantiomere chemisch absolut identisch. Auch können sie durch achirale Analysenmethoden (u. a. IR-, Fluoreszenz- oder UV/Vis-Spektroskopie, Massenspektrometrie) nicht voneinander unterschieden werden. Der Körper ist aber aus chiralen Molekülen aufgebaut, und somit ist die Arzneistoffwirkung durch Targetierung biologischer Strukturen (Rezeptoren, Transporter, Ligand-gesteuerte Membrankanäle oder Enzyme) auch an eine räumlich festgelegte und favorisierte Konformation des Wirkstoffes gebunden. Daher ist die Anwendung eines racemischen Arzneistoffes streng genommen die Kombination zweier aktiver Verbindungen, eines aktiv(er)en, als
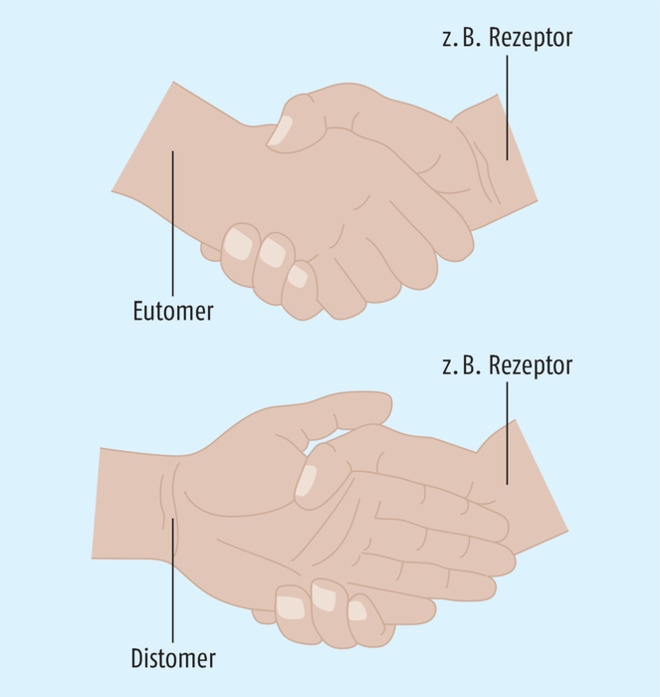
Eutomer bezeichneten, und eines inaktiven als Distomer benannten Enantiomers (Abb. 2). Im Fall des Zopiclons ist das (S)-Enantiomer die pharmakologisch aktive Substanz, die mit dem GABAA-Rezeptor in Wechselwirkung tritt.
Abb. 2: In einem racemischen Gemisch wird das aktive(re) Enantiomer auch als Eutomer bezeichnet, während das weniger aktive bis inaktive das Distomer darstellt. Die Wirkung hängt von der räumlich festgelegten Konformation des Arzneistoffes ab, weil dieser mit biologischen Strukturen wie Rezeptoren, Transportern, Ligand-gesteuerten Membrankanälen oder Enzymen wechselwirkt, die ihrerseits auch aus chiralen Molekülen aufgebaut sind.
Racemate versus Enantiomere – Spreu und Weizen?
Die Frage, warum man Arzneistoffe als racemische Gemische überhaupt zur Anwendung bringt, lässt sich historisch leicht beantworten. Techniken für eine stereoselektive Syntheseführung und insbesondere Methoden der stereoselektiven Enantiomerentrennung sind erst seit ca. zwei Jahrzehnten so weit etabliert, dass heutzutage keine Racemate mehr als neu zugelassene Arzneistoffe zu finden sind.
Ältere Arzneistoffe sind dagegen eher häufig als Racemate in Anwendung. Sehen nun die „alten“ Racemate, wie im Fall des Zopiclons, durch die modernen Techniken der Synthese und Racemattrennung bald alle als reine Enantiomere einem Leben als neue Arzneistoffe entgegen? Diese Fragestellung datiert bereits auf die 90er-Jahre. Nachdem die Zulassungsbehörden (FDA 1992, EMA 1993) mit spezifischen Guidelines auf den Stellenwert der Stereochemie für Arzneistoffe hinwiesen, resultierte unter dem Titel „chiral switch“, eine intensive Diskussion um die nachträgliche Zulassung von Enantiomeren bereits bekannter racemischer Arzneistoffe hinsichtlich Aufwand und Nutzen [3, 4]. Um es vorwegzunehmen: Die Anzahl von „chiral switches“ zu Enantiomeren-reinen Arzneistoffen auf dem Markt ist denkbar gering.
Die Rationale zur Anwendung Enantiomeren-reiner Arzneistoffe liegt klar auf der Hand, spricht doch die höhere Targetselektivität des Eutomers klar für sich und gegen das höhere Interaktionspotenzial bei Verwendung des Racemats. Auch die einfacheren Dosis-Wirkungs-Beziehungen und geringeren individuellen Schwankungen eines Enantiomers versus Racemat sind logische Argumente. Dies lässt sich aber nicht in gleicher Stringenz auf alle Arzneistoffe übertragen und damit eine nachträgliche Enantiomerentrennung rechtfertigen. Entscheidend für eine Bewertung oder Handlung sind die für die jeweiligen Arzneistoffe relevanten pharmakologischen Unterschiede der Enantiomere, das heißt: Geht vom Distomer keine, eine schwache oder sogar eine schädigende Wirkung aus? Unterscheiden sich die Enantiomere neben der Pharmakodynamik (Rezeptorbindung) auch in der Pharmakokinetik oder Metabolisierung und ergeben sich die Wirkunterschiede auf diesen Ebenen? Oder wird im Körper durch Konfigurationsumkehr sowieso eine Umwandlung der Enantiomere vermittelt? Letzteres ist im Fall von Ibuprofen bekannt, bei dem vom racemisch angewendeten Ibuprofen durch eine Epimerase das unwirksame (R)-Ibuprofen in das Eutomer (S)-Ibuprofen umgewandelt wird [5]. Interessanterweise ist dies sogar ein Beispiel eines erfolgten, aber nicht erfolgreichen „chiral switch“, denn das Eutomer Dexibuprofen (Deltaran®) ist in seiner Marktpräsenz gegenüber dem racemischen Ibuprofen kaum wahrnehmbar.
Eine Frage der Wirksamkeit
Entscheidend sind auch regulatorische Aspekte zur Anerkennung eines Enantiomers als neue Wirksubstanz, denn ohne die daraus resultierende Marktexklusivität des Anbieters werden solche Bestrebungen ohnehin nicht vorangetrieben. Ist nun die Zulassung von Eszopiclon als vom unwirksamen (R)-Enantiomer „bereinigten“ Zopiclon ein Einzelfall oder doch der Beginn eines Trends der Neuaufarbeitung der ursprünglich racemischen Arzneistoffe?
Geht man von der Unwirksamkeit des Distomers aus, sollte bei Verwendung des aktiven Enantiomers gegenüber dem Racemat die „Arzneimittellast“ und damit die notwendige Dosierung reduziert werden können. Dies ist auch im Fall des Eszopiclons zutreffend. Es wurde beschrieben, dass Eszopiclon eine bis zu 50fach höhere Bindungsaffinität zum GABAA-Rezeptor als das Distomer aufweist und somit die Dosierung von Lunivia® mit den Stärken 1 mg, 2 mg und 3 mg deutlich geringer gegenüber dem Racemat (3,75 mg und 7,5 mg) gewählt werden kann. Bei angenommener Unwirksamkeit des (R)-Zopiclons sollte also keine Wirkverbesserung durch Eszopiclon resultieren. Obwohl die Wirksamkeit von Eszopiclon bei Insomnien in klinischen Studien bewiesen wurde [6], findet man hingegen kaum direkte Vergleichsstudien zur Wirkeffizienz von Racemat und Eszopiclon. Eine direkte Vergleichsstudie aus dem Jahr 2016 zeigt zwar eine analoge Wirksamkeit, lässt aber keine Hinweise auf eine qualitativ bessere Wirkung des Eszopiclons zu [7]. Eine Vergleichsstudie an Gesunden nach nächtlicher Einnahme von 3 mg Eszopiclon oder 7,5 mg Zopiclon hinsichtlich „next day performance“ zeigte in der primären Datenanalyse keine Unterschiede. Lediglich eine post-hoc-parametrische Analyse der reziproken Daten zur Restaktivität favorisiert das Eszopiclon [8]. Auf diese Daten beziehen sich offensichtlich die Hersteller mit ihrer Aussage zu „geringeren Hangover-Effekten“ bei Anwendung von Eszopiclon gemessen am Racemat.
Allerdings fehlt, rational betrachtet, im Fall des Zopiclons eine qualitativ verbesserte Wirksamkeit von Enantiomer versus Racemat, und dies erklärt auch, dass für lange Zeit die Vermarktung des Eszopiclons in Europa grundsätzlich infrage gestellt war. Während Eszopiclon seit 2005 in den USA (Lunesta®) auf dem Markt existiert und das racemische Zopiclon deutlich in der Anwendung verdrängt hat, verweigerte der Humanarzneimittelausschuss der EMA im Jahre 2009 die Anerkennung des Eszopiclons als neuen Wirkstoff, woraufhin der Hersteller den Zulassungsantrag zurückzog. Ein im Jahr 2018 erschienener Cochrane-Review der klinischen Studien zur Wirkung von Eszopiclon bestätigte dem Wirkstoff eine Wirksamkeit bei geringen unerwünschten Wirkungen bei sachgerechter Einnahme [9]. Ob dies den Ausschlag zum positiven Votum der Zulassung gegeben hat, bleibt bisher noch offen. Aber offensichtlich punktet Eszopiclon im sensiblen Gebiet der Hypnotika auch mit diesen kleinen pharmakologischen Vorteilen. Bisher dürfen die Z-Substanzen gemäß ihrer Zulassung maximal vier Wochen angewendet werden, eine längere Verordnung gilt als Off-Label-Use und erklärt die allgemein bekannte „Untertherapierung“ von Patienten mit Insomnien. Eszopiclon ist für vier Wochen erstattungsfähig und bis zu sechs Monate bei chronischen Schlafstörungen zugelassen, wodurch sich eine höhere therapeutische Sicherheit auf Seiten von Arzt und Patient „in label“ ergibt.
Weitere Beispiele
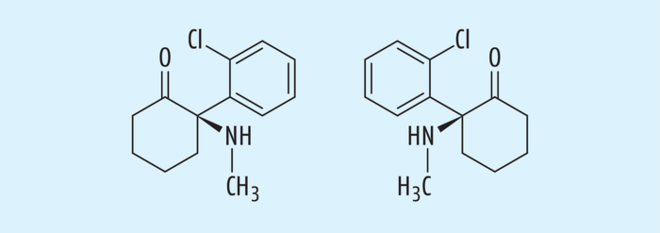
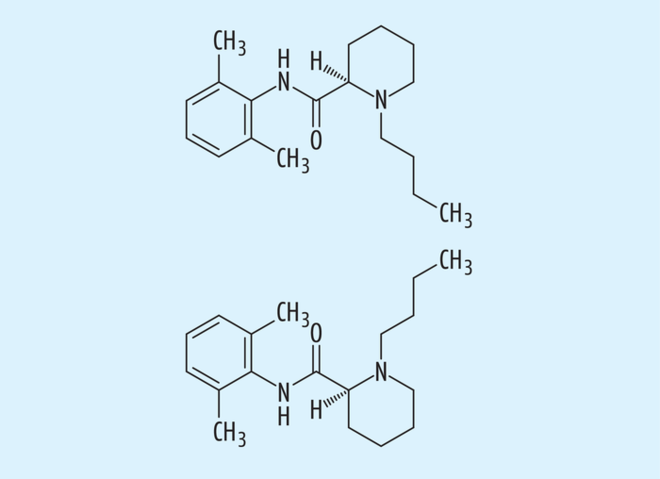
Schaut man auf andere Beispiele von Arzneistoffen mit einer „chiral switch“-Historie, fällt auch aus aktuellem Anlass der Blick auf Ketamin (s. Abb. 3). Auch Ketamin entfaltet wie Zopiclon eine allosterische Wirksamkeit an neurologischen Ligand-gesteuerten Ionenkanälen, und aktuell wurde das Eutomer auch in einer anderen als der ursprünglichen Indikation des Racemats zugelassen. Chemisch gesehen ist Ketamin ein chirales Arylcyclohexylamin, welches seit den 70er-Jahren in Form des Racemats als ein Injektionsnarkosemittel mit analgetischer Wirkkomponente therapeutisch eingesetzt wird. Ketamin wirkt allosterisch als Inhibitor an glutamatergen NMDA-Rezeptoren, sein Wirkprofil aus Analgesie und Sedation unter Erhalt der Schutzreflexe wurde zum Inbegriff für ein „Dissoziatives Anästhetikum“. Dass auch andere zentrale Transmissionen, teilweise über Opioid-Rezeptoren und resultierend halluzinogene Wirkungen dabei beteiligt sind, wird schon aus der Entwicklungsgeschichte ableitbar, da Ketamin als eine Weiterentwicklung des Suchtstoffes Phencyclidin
(Angles Dust) gilt. Grundsätzlich aber ist die anästhetische und analgetische Wirkung schwerpunktmäßig dem (S)-Enantiomer des Ketamins zuzuschreiben, die gegenüber dem (R)-Enantiomer eine ca. vierfach höhere Wirkpotenz aufweist. Dies ist nicht nur auf die ca. dreifach stärkere Bindung des (S)-Enantiomers am Ionenkanal zurückzuführen, das Eutomer weist auch eine leichte agonistische Wirkung an Opioid-Rezeptoren und damit analgetische Wirkung auf. Daher wurde neben dem Racemat bereits vor 20 Jahren das (S)-Enantiomer (Esketamin, Ketanest®) zugelassen, das in halber Dosierung gemessen am Racemat eingesetzt wird. Als ein weiterer Vorteil des Eutomers wird die schnellere Eliminierung sowie das verbesserte Aufwachverhalten benannt.
Eine völlig andere Wirkung des Esketamins wird seit einigen Jahren intensiv diskutiert und nun auch therapeutisch eingesetzt. Seit 2019 in den USA und aktuell auch zugelassen in Europa wird Esketamin in Form eines Nasensprays (Spravato®) zur Behandlung von mittelschweren bis schweren Episoden der Major Depression zusätzlich zu einer Therapie mit oralen Antidepressiva eingesetzt. Diese akute Kurzzeitbehandlung kann depressive Symptome eines psychiatrischen Notfalls rasch lindern, da Esketamin im Gegensatz zu anderen Antidepressiva seine Wirkung unmittelbar entfaltet. Die molekularen Wirkmechanismen dafür, die über eine Regulation der NMDA-Rezeptoren insbesondere auch über die Opioid-Rezeptoren diskutiert werden, sind in ihrer Komplexität nicht vollständig verstanden.
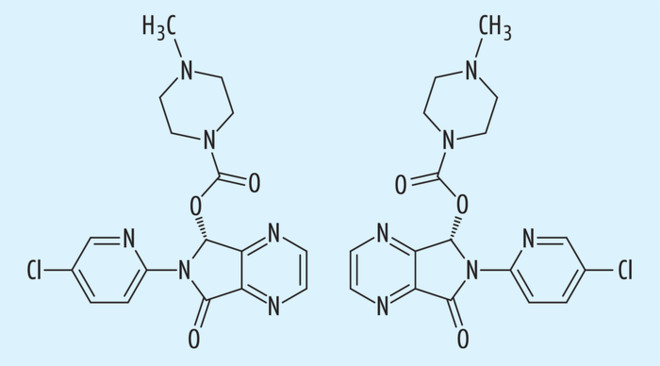
Ein weiteres Beispiel eines erfolgreichen „chiral switch“ ist das Citalopram (s. Abb. 4) . Citalopram, das als racemischer Arzneistoff bereits 1989 auf den Markt kam (Cipramil®), entfaltet seine antidepressive Wirksamkeit durch eine selektive Hemmung der präsynaptischen Serotonin-Transporter (selektive Serotonin-Wiederaufnahmehemmer, SSRI). Aus der erhöhten Serotonin-Konzentration im synaptischen Spalt der Neurone resultiert dann die pharmakologische Wirksamkeit. Diese Aktivität ist allerdings ausschließlich auf das (S)-Enantiomer (Escitalopram) zurückzuführen. In-vitro-Studien haben gezeigt, dass das (S)-Enantiomer eine über 150fach höhere Bindungsaffinität zum Serotonin-Transporter aufweist als das (R)-Enantiomer. Dabei wird dem (S)-Enantiomer zusätzlich eine allosterische Wirksamkeit und damit Verstärkung seiner Wirkung am Serotonin-Transporter zugeschrieben [10], die interessanterweise durch das (R)-Enantiomer sogar abgeschwächt wird [11]. Auch pharmakokinetisch scheint Escitalopram durch eine erhöhte Clearance gegenüber dem (R)-Enantiomer von Vorteil, da es zudem durch seine höhere Wirksamkeit niedriger dosiert wird. Escitalopram weist zusätzlich eine höhere Rezeptorselektivität als das Racemat auf, z. B. ist die Wechselwirkung mit Histamin-Rezeptoren und damit auch das Nebenwirkungspotenzial geringer ausgeprägt. Diese qualitativen Wirkunterschiede haben die Zulassung des Escitaloprams deutlich forciert, so dass Escitalopram (Cipralex®) 2003 als ein früher Erfolg des „chiral switch“ in Deutschland eine Zulassung zur Therapie von Depressionen und Panikstörungen erhielt.
Die Tatsache, dass die unterschiedlichen Wirksamkeiten von Enantiomeren bis hin zu toxischen Effekten des Racemats führen können, wird am Beispiel des Lokalanästhetikums Bupivacain deutlich (s. Abb. 5). Bupivacain wurde bereits 1963 als Racemat zugelassen und ist bis heute als ein langwirksames Lokalanästhetikum vom Amid-Typ für die Anwendung bei der Infiltrations-, Spinal- oder Periduralanästhesie geschätzt. Es entfaltet seine lokale Wirksamkeit in sensorischen und motorischen Nervenfasern durch Blockade spannungsabhängiger Natriumkanäle. Bei einer versehentlichen intravasalen Anwendung oder bei hohen Dosierungen können aber auch Kalium- oder Calcium-Kanäle beeinflusst werden, was dann zu kardialen Nebenwirkungen (Bradykardie, Hypotonie) führen kann. Studien haben gezeigt, dass die kardialen Wirkungen stärker durch das (R)-Enantiomer des Bupivacains induziert werden, nicht aber durch das (S)-Enantiomer (Levobupivacain). In der lokalanästhetischen Wirksamkeit unterscheiden sich beide Enantiomere kaum [12], so dass hier der Begriff Eutomer für das 2004 zugelassene Levobupivacain (Chirocain®) im engeren Sinne nicht für das wirksamere, aber für das weniger toxische Enantiomer steht.
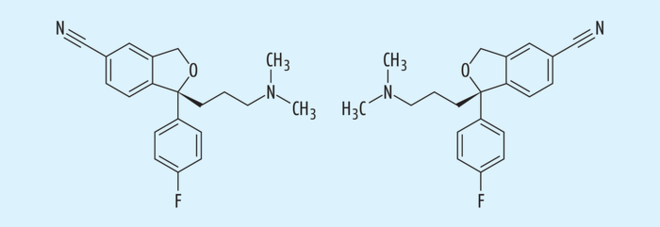
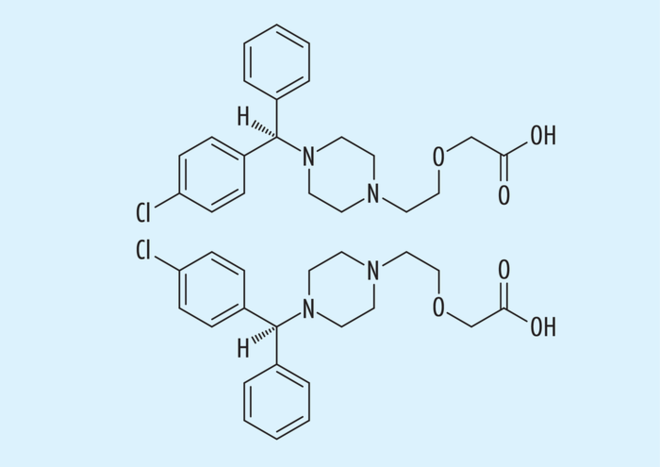
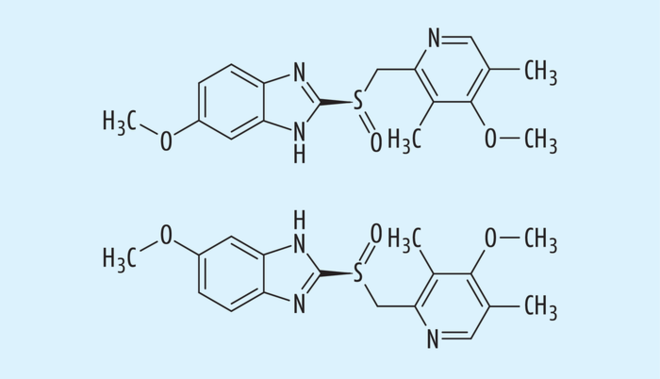
Weitere Arzneistoffe könnten hier als Beispiele für erfolgreiche „chiral switches“ genannt werden, von denen nur die Racemat/Eutomer-Paare Cetiricin/Levocetiricin (s. Abb. 6) aus dem Bereich der Antihistaminika oder Omeprazol/Esomeprazol (s. Abb. 7) als die bekannten Protonenpumpen-Inhibitoren erwähnt werden sollen.
Abb. 6: Cetiricin in seiner Konformation als (R)- (oben, auch Levocetiricin) und (S)-Enantiomer (unten).
Resümee
Ohne jeden Zweifel besitzt der Einsatz Enantiomeren-reiner Arzneistoffe vielfältige Vorteile gegenüber der Verwendung von Racematen, welche faktisch als zwei getrennte Wirkstoffe mit unterschiedlichen Charakteristika aufzufassen sind.
Die Vorteile reiner Enantiomere erstrecken sich von der Ebene der Targetbindung und Targetselektivität zur Pharmakokinetik bis zu einem verminderten Interaktionspotenzial mit anderen Arzneistoffen sowie geringeren interindividuellen Schwankungen bei den unterschiedlichen Patienten. Diese Erkenntnisse sind für neue Arzneistoffe längst umgesetzt, es kommen faktisch keine Racemate mehr auf den Markt. Aber lohnt sich nun die Nachzulassung in Rahmen eines „chiral switch“?
Das aktuelle Beispiel der Zulassung von Eszopiclon erscheint eher als ein Nachzügler einer bereits erfolgten Strategie als ein Indikator einer einsetzenden Welle. Die Aufwendungen für eine solche Zulassung sind enorm und nur im Ausnahmefall auch gerechtfertigt und realistisch. Die hier gezeigten Beispiele belegen zwar eindrucksvoll das unterschiedliche therapeutische Potenzial und den verbesserten Drug Index nachträglich erfolgter Enantiomeren-Trennungen, dies scheint aber auf der Stufe von wenigen Einzelfällen zu verbleiben. |
Literatur
[1] Zhong S, Stark H. Wie war das noch? Beratungswissen zu Z-Substanzen und Benzodiazepinen. DAZ 2020;51:56-65
[2] Schwabe U, Ludwig W-D. Arzneiverordnungs-Report 2020. Springer Berlin Heidelberg; Imprint: Springer 2020
[3] Agranat I, Caner H, Caldwell J. Putting chirality to work: the strategy of chiral switches. Nature Reviews Drug Discovery 2002;1:753-768
[4] Tucker, TG. Chiral Switches. Lancet 2000;355:1085-1087
[5] Schmidt M, Bendas G. Ibuprofen – das Flaggschiff der NSAID – Hintergrundwissen zu einem häufig verordneten Schmerzmittel. DAZ 2021;24:42
[6] Krystal AD, Walsh JK, Laska E, Caron J, Amato DA, Wessel TC et al. Sustained efficacy of eszopiclone over 6 months of nightly treatment: results of a randomized, double-blind, placebo-controlled study in adults with chronic insomnia. Sleep 2003;26(7):793-799
[7] Pinto Jr LR, Bittencourt LR, Treptow EC, Braga LR, Tufik S. Eszopiclone versus zopiclone in the treatment of insomnia. Clinics 2016;71(1):5-9
[8] Boyle J, Groeger JA, Paska W, Groeger JA, Paska W, Cooper JA, Rockett C, Jones S, Gandhi P et al. A method to assess the dissipation of the [corrected] residual effects of [corrected] hypnotics: eszopiclone versus zopiclone. J Clin Psychopharmacol 2012;32(5):704-709, http://dx.doi.org/10.1097/JCP.0b013e3182664eec
[9] Rösner S, Englbrecht C, Wehrle R, Hajak G, Soyka M. Eszopiclone for insomnia. Cochrane Database Syst Rev 2018;10:CD10703, doi: 10.1002/14651858.CD010703.pub2
[10] Wiborg O, Chen F, Larsen MB, Sanchez C. The S-enantiomer of citalopram increases inhibitor binding to the human serotonin transporter by an allosteric mechanism. Comparison with other serotonin transporter inhibitors. Eur Neuropsychopharmacol 2003;13(Suppl 4):215-216
[11] Mork A, Kreilgaard M, Sanchez C. The R-enantiomer of citalopram counteracts escitalopram-induced increase in extracellular 5-HT in the frontal cortex of freely moving rats. Neuropharmacology 2003;45:167-173
[12] Glaser C, Marhofer P, Zimpfer G et al. Levobupivacaine versus racemic bupivacaine for spinal anesthesia. Anesth Analg 2002;94:194-198, doi: 10.1097/00000539-200201000-00037























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.