
- DAZ.online
- DAZ / AZ
- DAZ 33/2021
- Licht, das sich „dreht
Stereochemie
Licht, das sich „dreht“
Wie die Chiralität von Arznei- und Naturstoffen bestimmt wird
Im aktuellen Europäischen Arzneibuch ist die Bestimmung der optischen Drehung bzw. der spezifischen Drehung in mehr als 500 Monographien meist bei der Prüfung auf Reinheit, in einigen Fällen aber auch zur Prüfung auf Identität zu finden. Da diese Methode auch in der Apotheke mit relativ geringem apparativem oder zeitlichem Aufwand durchzuführen ist, soll im Folgenden auf die theoretischen Grundlagen dieses Analysenverfahrens näher eingegangen werden.
Physikalische Grundlagen
Licht der unterschiedlichen Spektralbereiche stellt eine elektromagnetische Welle dar. Charakterisiert wird diese Wellenstrahlung neben der Wellenlänge auch durch die Schwingungsrichtung. Ändert sich diese Richtung schnell und ungeordnet, so spricht man von unpolarisiertem Licht. Licht mit einer konstanten Schwingungsrichtung wird hingegen als linear polarisiert bezeichnet. Das Licht von natürlichen Lichtquellen ist in der Regel nicht polarisiert. Unpolarisiertes Licht kann durch Reflexion an Oberflächen oder durch Brechung an speziellen Stoffen polarisiert werden. In der Technik verwendet man zur Erzeugung von polarisiertem Licht sogenannte Polarisationsfilter oder Polarisationsfolien, in denen Kohlenstoffketten ähnlich wie Gitterstäbe parallel zueinander angeordnet sind. Statt Kohlenstoff können auch Kunststofffolien mit parallel zueinander angeordneten nadelförmigen Herapathit-Kristallen verwendet werden [1]. Diese parallel angeordneten Strukturen wirken wie eine Schlitzblende oder wie ein optischer Spalt: lineare Polarisationsfilter können nur von Licht einer bestimmten Schwingungsebene passiert werden. Deshalb liegt nach Durchgang durch den Polarisationsfilter linear polarisiertes Licht vor, also Lichtwellen, die nur in einer einzigen Ebene schwingen.
Lichtart | Wellenlängenbereich | Arzneibuchmethode |
|---|---|---|
ultraviolettes Licht | ca. 100 nm – 380 nm | 2.2.25 UV-Vis-Spektroskopie 2.2.41 Zirkulardichroismus |
sichtbares Licht | ca. 380 nm – 780 nm | 2.2.1 Klarheit und Opaleszenz von Flüssigkeiten 2.2.2 Färbung von Flüssigkeiten 2.2.6 Brechungsindex 2.2.7 Optische Drehung 2.2.25 UV-Vis-Spektroskopie 2.2.41 Zirkulardichroismus |
Infrarot-Licht | ca. 780 nm – 1 mm | 2.2.24 IR-Spektroskopie 2.2.40 NIR-Spektroskopie 2.2.48 Raman-Spektroskopie |
Röntgenlicht | ca. 1 nm – 10 pm | 2.2.37 Röntgenfluoreszenzspektroskopie |
Unter „optischer Aktivität“ versteht man nun die Tatsache, dass manche Substanzen die Eigenschaft besitzen, die Polarisationsebene (also die Schwingungsebene) von linear polarisiertem Licht zu drehen. Solche Substanzen werden als „chiral“ bezeichnet. Beim Durchgang von linear polarisiertem Licht durch ein optisch aktives Medium wird die Polarisationsebene des Lichts an jedem einzelnen Molekül um einen kleinen Betrag gedreht. Physikalisch erklärt werden kann dieses Phänomen durch eine Wechselwirkung des elektrischen Feldes der Moleküle mit der elektromagnetischen Lichtwelle. Die Einzeldrehungen summieren sich dann nach Durchgang des Lichts durch die Gesamtheit aller Moleküle zu einem großen messbaren Drehwinkel. Dabei wird zwischen „rechtsdrehenden“ Substanzen, die die Polarisationsebene aus Sicht des Beobachters um einen bestimmten Winkel im Uhrzeigersinn drehen, und „linksdrehenden“ Substanzen mit einem Drehwinkel entgegen dem Uhrzeigersinn unterschieden. Entsprechend wird der gemessene Drehwinkel mit einem positiven Vorzeichen (für rechtsdrehend) oder einem negativen Vorzeichen (für linksdrehend) versehen. Da die experimentell ermittelte optische Drehung die Summe vieler einzelner Wechselwirkungen an den Molekülen der chiralen Substanz darstellt, ist der Drehwinkel sowohl abhängig von der Substanzkonzentration in Lösungen als auch von der Wegstrecke des linear polarisierten Lichts. Weitere Einflussfaktoren der optischen Drehung sind die Wellenlänge des Lichts und die Temperatur.
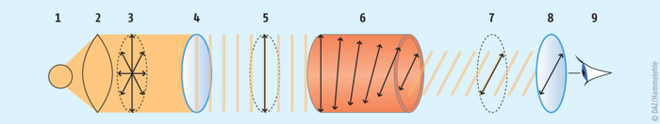
Die Messung der optischen Drehung erfolgt in einem Polarimeter (siehe Abb. 1).
Dieser besteht aus einer monochromatischen Lichtquelle (1). Meist handelt es sich dabei, falls nichts anderes vorgeschrieben ist, um eine Natriumdampflampe, deren Licht mit einer Wellenlänge von 589,3 nm durch eine Sammellinse (2) gebündelt wird. Das unpolarisierte Licht (3) wird durch einen Polarisationsfilter, den sog. „Polarisator“ (4) in linear polarisiertes Licht (5) umgewandelt. Beim Durchgang durch eine Küvette mit der optisch aktiven Substanz (6) wird die Polarisationsebene des Lichts um einen bestimmten Winkel gedreht (7). Dieses wird von einem lichtempfindlichen Detektor (9) – dem Auge oder einer Fotodiode – nach Durchgang durch einen zweiten, mit Winkelmessgerät drehbaren Polarisationsfilter, dem „Analysator“ (8), registriert. Ist der Analysator so ausgerichtet, dass seine Polarisationsrichtung parallel zu der des eintreffenden Lichtes ist, so lässt dieser das Licht vollständig durch und der Detektor registriert maximale Lichtintensität. Steht der Analysator senkrecht zum eintreffenden Licht, so lässt dieser gar nichts durch – der Detektor registriert minimale Lichtintensität.
Bei vorgegebener Wellenlänge des Lichts λ und Temperatur T ist der gemessene Drehwinkel α abhängig von der Konzentration c der Substanz und der Durchgangsstrecke des Lichts, also von der Länge l der Küvette. Daraus ergibt sich die Formel zur Berechnung der spezifischen Drehung nach Ph. Eur. wie folgt [3]:
Da – falls nichts anderes vorgeschrieben – die optische Drehung bei der Wellenlänge der D-Linie des Natrium (589,3 nm) und bei einer Temperatur von 20 °C gemessen wird, wird in der Regel die spezifische Drehung angegeben als:
Stereochemische Grundlagen
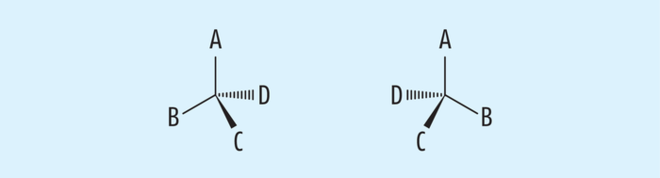
Wie bereits erwähnt, werden Substanzen die optische Aktivität zeigen, als chiral bezeichnet. Unter Chiralität (griech.: Händigkeit) versteht man die Eigenschaft bestimmter Gegenstände oder Systeme, dass ihr Spiegelbild durch Drehung nicht mit dem Original zur Deckung gebracht werden kann. Gängige Beispiele sind die rechte und linke Hand oder rechts- bzw. linksgewundene Schneckenhäuser. In der Chemie bezeichnet Chiralität die räumliche Anordnung von Atomen, bei denen bestimmte Symmetrieoperationen wie z. B. die Spiegelung an einer Molekülebene nicht zu einer Selbstabbildung führen. Chiralität beruht meist auf der unterschiedlichen räumlichen Anordnung von Atomen und Atomgruppen um ein oder mehrere sterische Zentren. So stellen zum Beispiel in vielen organischen Strukturformeln sp3-hybridisierte Kohlenstoffatome mit vier unterschiedlichen Substituenten ein solches sterisches Zentrum dar, bei dem aufgrund der räumlichen Tetraeder-Struktur zwei verschiedene räumliche Anordnungen möglich sind (siehe Abb. 2). Solche Kohlenstoffatome werden auch als asymmetrisch bezeichnet. Neben Kohlenstoff können auch andere Atome wie zum Beispiel Phosphor Stereozentren ausbilden.
Die sterische Anordnung der vier Liganden an einem asymmetrischen Kohlenstoffatom wird in der Nomenklatur der Verbindung entweder aufgrund der Fischer-Projektion mit D bzw. L ausgedrückt [4] oder für jedes einzelne Chiralitätszentrum nach Cahn, Ingold und Prelog mit R bzw. S [5]. Die beiden spiegelbildlichen Formen eines solchen Moleküls werden als Enantiomere bezeichnet. Enantiomere sind also Stereoisomere, die sich wie Bild und Spiegelbild verhalten. Als Diastereomere bezeichnet man Stereoisomere, die sich nicht wie Bild und Spiegelbild verhalten. Zwischen der absoluten Konfiguration eines optisch aktiven Moleküls und dessen Drehsinn besteht keine Korrelation. Weder der Drehwinkel noch der Drehsinn kann also vorhergesagt werden, sondern muss experimentell bestimmt werden.
Der Drehwinkel und damit auch die spezifische Drehung von zwei enantiomeren Substanzen nimmt den gleichen Zahlenwert ein, jedoch mit unterschiedlichem Vorzeichen, also unterschiedlichem Drehsinn. So beträgt die spezifische Drehung von D-Milchsäure - 2,6° und von L-Milchsäure + 2,6°. Ein homogenes Gemisch von zwei Enantiomeren wird als Racemat bezeichnet und ist optisch inaktiv, da sich die Drehwinkel der beiden Enantiomere aufheben.
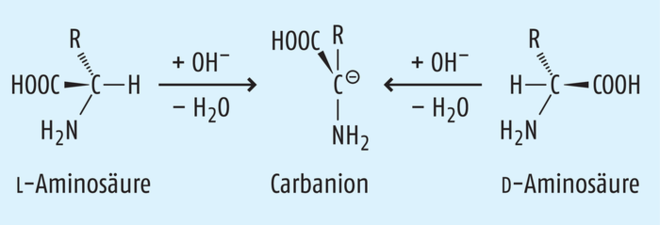
Ursprünglich optisch reine Stereoisomere können unter bestimmten Bedingungen (z. B. bei falscher Lagerung) ihre vorgegebene räumliche Molekülanordnung wieder verlieren und teilweise oder vollständig racemisieren. Besonders häufig ist dies bei Verbindungen mit aciden Wasserstoffatomen im basischen Milieu der Fall. Ein Beispiel hierfür ist die teilweise Racemisierung von L-Aminosäuren zu D-Aminosäuren (siehe Abb. 3):
Da die Racemisierung von L-Aminosäuren zu D-Aminosäuren sowohl im lebenden als auch im abgestorbenen Organismus langsam fortschreitend stattfindet, kann deren Quantifizierung auch zur Altersbestimmung herangezogen werden (siehe Kasten „Eine biologische Uhr im Zahn“) [6].
Eine biologische Uhr im Zahn
Neben der Röntgenuntersuchung des Reifegrads verschiedener Handknochen kann auch die Zahnmedizin Aufschluss über das Alter lebender oder toter Personen geben. So wandeln sich die ursprünglich in der L-Form vorliegenden Aminosäuren in Dentin-Proteinen mit der Zeit in D-Aminosäuren um. Dies erfolgt je nach Aminosäure unterschiedlich schnell.
Besonders schnell racemisiert L-Asparaginsäure, so dass sich damit durch gaschromatographische Bestimmung des D/L-Isomerenverhältnisses relativ kurze Zeitspannen ermitteln lassen. Anwendung findet diese Methode zum Beispiel für die Altersbestimmung von Minderjährigen bei Asylverfahren oder im Strafrecht.
Neben Gerichtsmedizinern haben aber auch Archäologen mit der Bestimmung der Isomerisierungsrate von Aminosäuren spektakuläre Erfolge erzielt. So untersuchten Wissenschaftler in Haaren der Gletscherleiche „Ötzi“ den Racemisierungsgrad von L-Hydroxyprolin. Dieses racemisiert deutlich langsamer als L-Asparaginsäure. Mit einem D : L-Verhältnis von 37% konnte das durch andere Verfahren ermittelte Alter bestätigt werden: Der Mann kam vor rund 5300 Jahren zu Tode.
Die Umkehr der Stereochemie an einem einzigen asymmetrischen Kohlenstoffatom in einer Verbindung mit zwei oder mehr asymmetrischen Kohlenstoffatomen bezeichnet man als Epimerisierung. Epimere sind also Stereoisomere mit mindestens zwei sterischen Zentren, die sich in der räumlichen Anordnung (Konfiguration) an nur einem einzigen Stereozentrum unterscheiden.
Da sowohl eine (teilweise oder vollständige) Racemisierung als auch Epimerisierung die Folge einer Zersetzungsreaktion von Arzneiwirkstoffen in wässriger Lösung sein kann, stellt die Bestimmung der Optischen Drehung eine häufig im Ph. Eur. zu findende Reinheitsprüfung dar.
Die Arzneibuchmethode
In der Ph. Eur. Methode 2.2.7 Optische Drehung [3] wird ursprünglich die Wellenlänge der D-Linie des Natriumlichtes mit einer Wellenlänge von 589,3 nm, eine Temperatur von 20 ±0,5 °C sowie eine optische Wegstrecke von 1,00 dm als Standard definiert. Da manche Polarimeter andere Lichtquellen als Natrium-Entladungslampen verwenden, wird als Referenz eine Wellenlänge von 589 nm (statt 589,3 nm) angegeben. In manchen Monographien sind von diesem Standard abweichende Wellenlängen, Temperaturen bzw. optische Wegstrecken aufgeführt.
Zur Sicherstellung der Leistungsfähigkeit der verwendeten Apparatur schreibt das Ph. Eur. eine Kalibration mit genormten Quarzplättchen oder alternativen Referenzmaterialien (wie Saccharose-Lösungen) vor. Vor jeder Messung ist ein Nullpunkt-Abgleich durchzuführen, der bei unverdünnten Flüssigkeiten mit einer leeren Messzelle bestimmt wird, bei Lösungen mit dem verwendeten reinen Lösungsmittel. Dabei ist darauf zu achten, dass der Nullpunkt-Abgleich unbedingt bei exakt der gleichen Temperatur durchgeführt wird wie die eigentliche Messung.
Die Vorschrift zur Herstellung der für die Messung verwendeten Prüflösung ist der jeweiligen Monographie zu entnehmen. Dort ist auch angegeben, in welcher Form (getrocknet, wasserfrei) die Prüfsubstanz eingesetzt werden muss. Als Sollwert ist in der Monographie jeweils ein unterer und oberer Grenzwert angegeben – entweder für den direkt gemessenen Drehwinkel zur Bestimmung der optischen Drehung oder für den nach obiger Formel aus dem Messwert noch zu berechnenden Wert zur Bestimmung der spezifischen Drehung. Beziehen sich diese Grenzwerte auf die getrocknete, wasserfreie oder lösungsmittelfreie Substanz, so ist das Ergebnis je nach Fall um den Trocknungsverlust (2.2.32), den Wassergehalt (2.5.12 oder 2.5.32) oder um den Lösungsmittelgehalt zu korrigieren.
Physiologische Bedeutung
Die Natur ist chiral. Dafür gibt es zahlreiche makroskopische Beispiele wie die linke und rechte Hand, die Windungsrichtung von Schneckenhäusern, die Verlaufsrichtung der Blattstellung in der Botanik oder die unterschiedliche Form von Kristallen (aufgrund derer Louis Pasteur durch manuelles Aussortieren unter dem Mikroskop im Jahr 1848 erstmalig eine Enantiomeren-Trennung durchgeführt hat [7]).
Auch auf molekularer Ebene spielen stereochemische Eigenschaften und die daraus resultierende Chiralität zahlreicher Biomoleküle eine zentrale Rolle. So gehören fast alle biogenen Aminosäuren der L-Reihe an. Somit sind auch alle aus den Aminosäuren aufgebauten natürlichen Proteine wie z. B. Enzyme oder Rezeptorproteine sterisch einheitlich und damit optisch aktiv. Dies gilt analog für andere Biomoleküle wie Kohlenhydrate oder Nukleinsäuren. Da die meisten Stoffe, um einen bestimmten Effekt auszulösen, mit diesen sterisch einheitlichen, also chiralen Makromolekülen („Targets“) eine Wechselwirkung ausüben müssen, ist nicht verwunderlich, dass die beiden Enantiomere einer Verbindung häufig deutlich unterschiedliche Auswirkungen auf unseren Körper haben können.
Das zeigt sich an dem oft zitierten Beispiel der beiden Enantiomere von Carvon: Während das rechtsdrehende (+)-Carvon nach Kümmel riecht, besitzt das linksdrehende (-)-Carvon einen deutlichen Geruch nach Minze. Die Aminosäure (S)-Valin schmeckt bitter, (R)-Valin hingegen süß. Und auch optisch aktive Arzneistoffe weisen häufig deutliche unterschiedliche Wirksamkeit der einzelnen Stereoisomere auf. Diese enantioselektive Arzneistoff-Wirkung kann auf unterschiedlichen Mechanismen beruhen, die beispielhaft in Tabelle 2 aufgeführt sind.
Wechselwirkung | Wirkstoffbeispiel | Enantioselektivität | Lit. |
|---|---|---|---|
Rezeptor-Affinität | Cetirizin | (R)-Cetirizin bindet etwa 33-mal stärker an H1-Rezeptoren als (S)-Cetirizin | [9] |
Enzym-Affinität | Ofloxacin | (S)-Ofloxacin bindet in vitro bis zu 128-mal stärker an bakterielle Gyrasen als (R)-Ofloxacin | [10] |
Rezeptor-Selektivität | Ketamin | (S)-Ketamin besitzt eine etwa dreifach höhere Affinität zu Opioid-Rezeptoren als (R)-Ketamin | [11] |
Transportsystem-Interaktion | Citalopram | (S)-Citalopram blockiert die Serotonin-Wiederaufnahme etwa 40-mal stärker als (R)-Citalopram | [12] |
unterschiedlicher Metabolismus | Omeprazol | (R)-Omeprazol wird ca. dreimal schneller metabolisiert als (S)-Omeprazol | [13] |
unterschiedliche Toxizität | Bupivacain | (R)-Bupivacain blockiert kardiale Ionenkanäle länger und stärker als (S)-Bupivacain und verursacht deshalb deutlich mehr kardiale Nebenwirkungen | [14] |
Das jeweils stärker wirksame Enantiomer eines chiralen Wirkstoffs wird allgemein auch als Eutomer bezeichnet, das inaktivere Enantiomer als Distomer. Während früher chirale Arzneistoffe meistens als Racemat, also als Stereoisomeren-Gemisch, auf den Markt gebracht wurden, enthalten diese heute vermehrt reine Enantiomere, was in der Regel mit einer besseren Wirksamkeit bei geringerem Anteil an unerwünschten Arzneimittelwirkungen einhergeht (siehe Tab. 3).
Zeitraum | Verhältnis Enantiomere : Racemate |
|---|---|
1999 – 2003 | 15 : 9 (= 62,5 : 37,5%) |
2004 – 2008 | 20 : 5 (= 80 : 20%) |
2009 – 2013 | 11 : 3 (= 78,5 : 21,5%) |
2014 – 2018 | 21 : 1 (= 95,5 : 4,5%) |
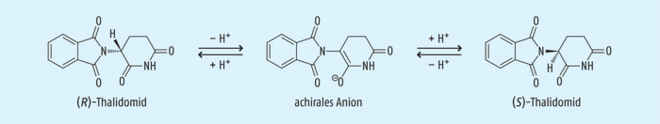
Aber nicht in jedem Fall bringt der Einsatz enantiomeren-reiner Wirkstoffe entsprechende Vorteile mit sich. Dies ist dann ohne Nutzen, wenn nach Resorption des Wirkstoffs im Körper relativ rasch eine Racemisierung eintritt. Bekannt ist dies zum Beispiel vom fruchtschädigenden Contergan®-Wirkstoff Thalidomid (siehe Abb. 4). Es ist bekannt, dass ausschließlich das (S)-Enantiomer die fatale teratogene Wirkung hat. Der Einsatz des reinen (R)-Enantiomers ist dennoch nicht von Vorteil, da aufgrund der C-H-Acidität am asymmetrischen Kohlenstoff-Atom binnen weniger Stunden im basischen Milieu durch reversible Abspaltung des aciden Protons eine Racemisierung zum teratogenen (S)-Thalidomid erfolgt [16].
Polarisiertes „Sehen“
Auch wenn in allen Organismen aufgrund der Chiralität vieler Naturstoffe spezifische Wechselwirkungen mit polarisiertem Licht stattfinden, können doch die meisten Lebewesen wie auch wir Menschen polarisiertes Licht nicht ausdrücklich sehen. Es gibt aber auch Ausnahmen: So dient Bienen das durch Brechung und Reflexion an der Atmosphäre entstehende polarisierte Licht des Himmels zur Orientierung. Damit können sie selbst bei bewölktem Himmel den Sonnenstand ermitteln und diesen zu ihrer Orientierung in der Landschaft nutzen.
Abb. 5: Die Flügel des tropischen Schmetterlings Heliconius cydno reflektieren polarisiertes Licht.
Alison Sweeney konnte 2003 nachweisen, dass die Flügel der tropischen Schmetterlingsart Heliconius cydno polarisiertes Licht in bestimmten Mustern reflektieren [17] (siehe Abb. 5). Dies nutzt der Schmetterling zur Anlockung des anderen Geschlechts bei der Paarung. Die Männchen können durch die polarisierten Lichtsignale, welche sich deutlich von der dunklen Umgebung des Regenwaldes abheben, leichter die zugehörigen Weibchen auffinden. Da Vögel das polarisierte Licht nicht als solches wahrnehmen können, besteht für diese Schmetterlinge keine Gefahr, durch ihre polarisierten „Leuchtfeuer“ ihre Fressfeinde auf sich aufmerksam zu machen. Dies ist ein klarer Vorteil gegenüber auffälliger Muster und Zeichnungen. |
Literatur
[1] Kahr B, Freudenthal J, Phillips S, Kaminsky W. Herapathite. Science 2009;324(5933):1407
[2] Polarimetrie. Informationen der Physikalisch Technischen Bundesanstalt, www.ptb.de/cms/fileadmin/internet/fachabteilungen/abteilung_4/Polarimetrie_new.pdf
[3] Methode 2.2.7: Optische Drehung. Europäisches Arzneibuch Ph.Eur. 9.8. Deutscher Apotheker Verlag Stuttgart
[4] Rules of Carbohydrate Nomenclature. J Org Chem 1963;28(2):281-291
[5] Cahn RS, Ingold C, Prelog V. Spezifikation der molekularen Chiralität. Angewandte Chemie 1966;78(8):413-447
[6] Van den Heuvel M. Eine biologische Uhr im Zahn. Kassenzahnärztliche Vereinigung Bayern, BZB 2013;4:42-43
[7] Pasteur L. On the Relationships between the Crystalline Form, Chemical Composition and the Direction of Optical Rotation. Annales de Chimie et de Physique 1848;24(6):442-459
[8] Wünsch B. Die bessere Hälfte bewährter Arzneistoffe. PZ 2005;30:16-23
[9] Gillard M et al. Binding Characteristics of Cetirizine and Levocetirizine to Human H1 Histamine Receptors: Contribution of Lys191 and Thr194. Mol Pharmaco 2002;61:391-399
[10] Hayakawa I et al. Synthesis and antibacterial activities of optically active ofloxacin. Antimicrob. Agents Chemother 1986;29:163-164
[11] Hirota K et al. Stereoselective Interaction of Ketamine with Recombinant µ, k, and σ Opioid Receptors Expressed in Chinese Hamster Ovary Cells. Anesth 1999;90:174-182
[12] Chen F et al. The S-enantiomer of R,S-citalopram, increases inhibitor binding to the human serotonin transporter by an allosteric mechanism. Comparison with other serotonin transporter inhibitors. Eur Neuropsychopharmacology 2005;15:193-198
[13] Äbelö A et al. Stereoselective Metabolism of Omeprazole by Human Cytochrome P450 Enzymes. Drug Metab. Dispos. 2000;28:966-972
[14] Sorbera LA, Graul A, Castaner J. Levobupivacaine. Drug Fut 1998;23,838-842
[15] Roth HJ. Chirale versus achirale Arzneistoffe – Eine Bilanz der Jahre 2014 bis 2018. DAZ 2019;6:70-73
[16] Reist M, Carrupt PA, Francotte E, Testa B. Chiral inversion and hydrolysis of thalidomide: mechanisms and catalysis by bases and serum albumin, and chiral stability of teratogenic metabolites. Chemical Research in Toxicology 1998;11(12):1521-1528
[17] Sweeney A, Jiggins C, Johnsen S. Insect communication: Polarized light as a butterfly mating signal. Nature 2003;423,31-32


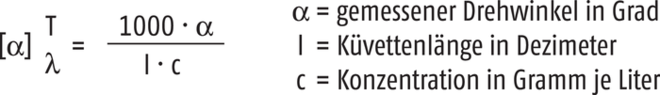
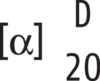






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.