
- DAZ.online
- DAZ / AZ
- DAZ 16/2021
- Rätselhaftes Multisystem...
Pandemie Spezial
Rätselhaftes Multisystem-Entzündungssyndrom
Lebensbedrohliche Erkrankung bei jungen Menschen nach SARS-CoV-2-Infektion bereitet Sorgen
Im April 2020 häuften sich in Großbritannien erstmalig Hyperinflammationserkrankungen mit Multiorganbeteiligung bei Kindern, welche wenige Wochen zuvor – und teilweise unbemerkt – mit SARS-CoV-2 infiziert waren [1]. Seitdem verzeichnen Pädiater weltweit Fälle der mysteriösen Erkrankung in unterschiedlichen klinischen Ausprägungen und Schweregraden. Die WHO verwendet das Akronym MIS-C (multisystem inflammatory syndrome in children) für die neue Entität, so auch die US Centers for Disease Control and Prevention (CDC), im deutschsprachigen Raum und in Großbritannien ist eher die Abkürzung PIMS (pediatric multisystem inflammatory syndrome) gebräuchlich. Beide Begriffe können synonym verwendet werden. Auch wenn das Syndrom mittlerweile einen beziehungsweise zwei Namen hat, bestehen noch viele Unklarheiten, zum Beispiel auch bezüglich der Inzidenz. Schätzungen zufolge tritt in Deutschland nur ein Fall unter 1000 bis 5000 Kindern auf, die mit SARS-CoV-2 infiziert sind.
Symptome
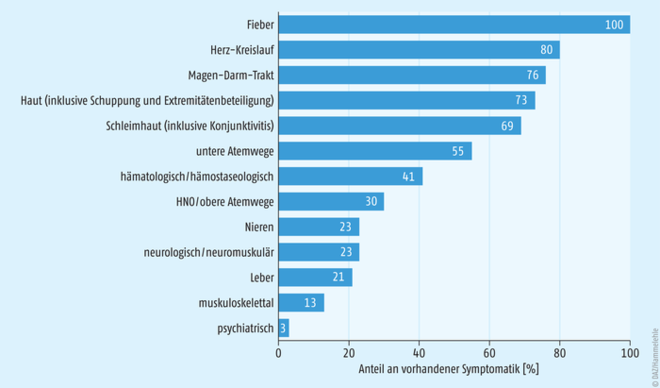
Neben hohem Fieber, welches über mehr als 48 Stunden persistiert und erhöhten systemischen Entzündungsparametern (unter anderem C-reaktives Protein [CrP], Procalcitonin [PCT], Blutsenkungsgeschwindigkeit [BSG]) ohne eindeutige infektiologische Ursachen, werden inflammatorisch bedingte Erkrankungen mehrerer Organsysteme beobachtet. Vornehmlich treten
- kardiovaskuläre (arterielle Hypotension, myokardiale Dysfunktion, Perikarditis, Valvulitis, kardiogener Schock),
- gastrointestinale (Diarrhoe, Abdominalschmerzen, Erbrechen, Entzündungen des Darms, Appendizitis-Verdacht),
- kutane (Exantheme, nicht-eitrige, beidseitige Konjunktivitis, [oromukosale] Schleimhautveränderungen),
- respiratorische und
- neurologische Symptome auf (siehe Abbildung 1).
- Laborchemisch können neben den erhöhten Entzündungswerten Abweichungen im großen Blutbild (Thrombozytopenie, Lymphozytopenie, Granulozytose, milde Anämie) und eine Koagulopathie (PT-, PTT-, d-Dimere-Erhöhung) festgestellt werden.
Abb. 1: Häufigkeitsverteilung der Organbeteiligung bei PIMS, entsprechend der Meldungen im deutschen PIMS-Survey (Mehrfachauswahl möglich). Neben dem beim PIMS obligaten Fieber wurden insbesondere kardiovaskuläre, gastrointestinale und kutane Symptome berichtet (adaptiert nach [2]).
Um der PIMS-Falldefinition der Deutschen Gesellschaft für Pädiatrische Infektiologie e. V. (DGPI) zu genügen, müssen neben Fieber über 38 °C und über zwei Tage mindestens zwei der oben genannten Symptome oder Labor-Auffälligkeiten gleichzeitig zutreffen sowie erhöhte Entzündungsparameter nachgewiesen werden, für die es aber keine triftige infektiologische Ursache gibt. Der Nachweis einer dem Geschehen vorausgehenden COVID-19-Erkrankung, die mittels PCR- oder Antigenschnelltest (direkt) oder serologisch (indirekt) erfolgt, ist nicht zwingend zu erbringen, um eine Meldung des Falls im deutschen Surveillancesystem „PIMS-Survey“ (s. Kasten „Informatives PIMS-Survey“) zu erstellen [2]. Der SARS-CoV-2-Nachweis, beziehungsweise der Kontakt zu einem COVID-19-Patienten, ist jedoch integraler Bestandteil der Definition eines PIMS/MIS-C nach WHO- und CDC-Kriterien.
Informatives PIMS-Survey
Die epidemiologische Situation des PIMS bei Kindern und Jugendlichen bis 19 Jahren wird bundesweit von der Deutschen Gesellschaft für Pädiatrische Infektiologie (DGPI) in einem Surveillance-System, dem sogenannten PIMS-Survey, abgebildet [2]. Im Erfassungszeitraum 1. Januar 2020 bis 11. April 2021 wurden dort bislang 265 PIMS-Fälle beziehungsweise PIMS-Fälle mit Kawasaki-Syndrom systematisch erfasst. Die Meldungen stammten aus 132 deutschen und zum Teil österreichischen Zentren. Wochenaktuell können hier viele informative und detaillierte Analysen in grafisch ansprechender Darstellung eingesehen werden, zum Beispiel zur zeitlichen Verteilung des Auftretens der PIMS-Fälle im Verlauf der Pandemie, zur Alters- und Geschlechterverteilung und zum Outcome bei Entlassung, jeweils abgegrenzt zu stationär behandelten COVID-19-Fällen bei Kindern und Jugendlichen, die dem COVID-Survey der DGPI gemeldet wurden.
Herz in Gefahr
Im Hinblick auf die akute Gesundheitsgefährdung und mögliche Langzeitfolgen imponiert besonders die durch ein MIS-C (PIMS) ausgelöste kardiale Symptomatik. Zu beachten ist, dass die Betroffenen meist keine Vorerkrankungen in diesem Bereich aufweisen. Auffälligkeiten können routinemäßig anhand von laborchemischen Untersuchungen ausgemacht werden, zum Beispiel sind kardiale Marker wie Nt-proBNP- oder Troponin-Werte erhöht. Kardiovaskuläre Veränderungen stellen sich als neu auftretende Herzklappeninsuffizienzen, Perikarderguss, Dilatationen oder Aneurysmen der Koronararterien oder eine eingeschränkte diastolische sowie systolische Funktion des Herzens (zum Beispiel reduzierte linksventrikuläre Ejektionsfraktion, LVEF) dar. Die kardiale Abklärung erfolgt durch transthorakale Echokardiografie und EKG-Messungen und sollte wiederholt erfolgen. Viele Kinder müssen aufgrund der kardialen Beteiligung, zum Beispiel eines Kreislaufversagens, auf eine Kinder-Intensivstation (pediatric intensive care unit, PICU) verlegt und engmaschig überwacht werden. Dort werden sie unter anderem mit kreislaufunterstützenden Katecholaminen (Adrenalin, Noradrenalin, Dobutamin, Dopamin) oder bei schwerer linksventrikulärer Dysfunktion ergänzend mit dem Phosphodiesterase-III-Inhibitor Milrinon behandelt, um lebensbedrohliche Situationen abzuwenden [1, 4, 12]. Im deutschen PIMS-Surveillance-System (siehe Kasten „Informatives PIMS-Survey“) wurde z. B. bei mehr als der Hälfte der gemeldeten Fälle angegeben, dass ein Aufenthalt auf der Intensivstation erforderlich war (57%), meist mit Beatmungspflicht [2]. Bei der Mehrzahl der Betroffenen normalisieren sich die kardialen Veränderungen im Laufe des Klinikaufenthaltes glücklicherweise. Den aktuellen deutschen Daten zufolge trugen jedoch 16 Patienten mit MIS-C nicht näher spezifizierte Folgeschäden im Herz-Kreislauf-System davon, bei insgesamt 54 Patienten zeigten sich nach Entlassung aus dem Krankenhaus diesbezügliche Restsymptome [2]. In einer großen amerikanischen Untersuchung normalisierte sich die LVEF bei 91% der 331 betroffenen Kinder im Verlauf von 30 Tagen, und kardiale Aneurysmen, die bei 57 Patienten vorlagen, waren in 79% der Fälle nach 30 Tagen zurückgebildet (zu 100% nach 90 Tagen) [14].
Ätiologie unklar
Auch ein Jahr nach der Erstbeschreibung des MIS-C tappt man bezüglich der zugrunde liegenden Pathogenese noch im Dunkeln. Vermutet wird unter anderem, dass die Multisystem-Entzündung auf Autoantikörper zurückzuführen ist oder durch eine anderweitige immunologische Reaktion auf die primäre SARS-CoV-2-Infektion getriggert wird. Es wird in Fachkreisen darüber diskutiert, ob SARS-CoV-2 bei betroffenen Kindern nicht vollständig vom Immunsystem eliminiert wurde, dann in bestimmten Organen persistiert, woraus eine prolongierte Antigenstimulation und kontinuierliche Aktivierung des adaptiven Immunsystems resultiert. Aber auch eine endotheliale Dysfunktion, eine Thromboinflammation und eine Beteiligung des Renin-Angiotensin-Aldosteron-Systems kommen als mögliche (Begleit-)Ursachen, neben einer genetischen Prädisposition, in Betracht [5].
Immunologische Auffälligkeiten
Eine Arbeitsgruppe aus Philadelphia verglich die Immunprofile von 14 pädiatrischen MIS-C-Patienten mit denen von 16 Kindern mit schwerem COVID-19-Verlauf und stellte dabei grundlegende Unterschiede fest [8]. Kinder mit MIS-C zeigten eine ausgeprägte T-Zell-Aktivierung und -Proliferation – insbesondere für CD8+-T-Zellen – und dies nicht nur im Vergleich zu den schwerkranken pädiatrischen COVID-19-Patienten, sondern auch zu Erwachsenen. Unter den CD8+-T-Zellen war eine Untergruppe (CX3CR1-positive CD8+-T-Zellen), die vornehmlich vaskulär patrouilliert, auffällig stark aktiviert, und Patienten mit einer hohen Zahl dieser Zellen benötigten vasoaktive Unterstützung [8]. Diese interessante Beobachtung muss noch weiter untersucht werden. Auffällig ist aber, dass bei erwachsenen COVID-19-Patienten ein Zusammenhang zwischen thrombotischen Komplikationen und der Aktivierung von CX3CR1-positiven CD8+-T-Zellen besteht.
Abgrenzung zum Kawasaki-Syndrom
Differenzialdiagnostisch müssen ein toxisches Schocksyndrom (TSS), ein Makrophagenaktivierungssyndrom (MAS) und ein Kawasaki-Syndrom (KS) abgegrenzt werden, die überlappende Merkmale zum MIS-C aufweisen. Beim Kawasaki-Syndrom ist die Ätiologie ebenfalls noch nicht genau geklärt [15]. Es handelt sich aber um eine Erkrankung, die typischerweise im Kleinkindalter auftritt, während das durchschnittliche Alter beim MIS-C bei circa acht bis neun Jahren liegt. Klinisch gibt es weitere Unterschiede der beiden Erkrankungen, besonders die gastrointestinale Symptomatik ist beim MIS-C prägnanter (siehe Tabelle 1).
MIS-C | Kawasaki-Syndrom | |
|---|---|---|
Alter (Durchschnitt) | 8,5 Jahre | 3 Jahre |
Fieber | +++ | +++ |
Exanthem | ++ | +++ |
Konjunktivitis | ++ | ++ |
oromukosale Veränderungen | ++ | ++ |
Extremitätenbeteiligung (mit Schwellung bzw. Rötung der Hände und Füße) | +/- | + |
zervikale Lymphknotenschwellung | +/- | + |
Koronardilatation | + | ++ |
kardiale Dysfunktion | ++ | - |
gastrointestinale Symptome | +++ | + |
Schock/Hypotension | ++ | +/- |
Risikofaktor männliches Geschlecht?
Jungen scheinen häufiger als Mädchen von einem MIS-C betroffen zu sein, wie es auch beim Kawasaki-Syndrom der Fall ist. Im PIMS-Survey wurden 65% der Fälle bei Jungen verzeichnet [2], was in etwa dem Anteil entspricht, der aus Berichten anderer Länder bekannt ist [3, 11, 13, 14]. Zum Vergleich: Bei den wegen einer COVID-19-Infektion stationär behandelten Kindern und Jugendlichen, die dem COVID-Survey der Deutschen Gesellschaft für Pädiatrische Infektiologie e. V. (DGPI) gemeldet wurden, halten sich Jungen und Mädchen in etwa die Waage (52% versus 48%) (s. a. Kasten „Informatives PIMS-Survey“). Auch wenn es Tendenzen hinsichtlich des männlichen Geschlechts als Risikofaktor gibt, sind die Fallzahlen beim MIS-C noch zu gering, um dies zu bestätigen. Als weiterer potenzieller Risikofaktor für die Entwicklung einer Multisystementzündung wurde Übergewicht benannt [1, 2, 14].
Ethnische Besonderheiten
Auffällig ist, dass wenige MIS-C-Fälle aus China bekannt sind, trotz dass das Land gerade zu Beginn der SARS-CoV-2-Pandemie stark betroffen war [10]. Hier könnten allerdings auch Verzerrungseffekte eine Rolle spielen, falls eine systematische Erfassung oder Berichterstattung nicht erfolgt (under reporting). In der aktuell größten, US-amerikanischen Querschnittsstudie waren 71,3% der analysierten Fälle Kinder nicht kaukasischen Ursprungs, hingegen schienen Kinder hispano-, latein- und afroamerikanischer Herkunft disproportional stark betroffen zu sein [3]. Auch andere Studienautoren verzeichnen mehr MIS-C-Fälle bei nicht-kaukasischen Bevölkerungsgruppen [1, 2, 4, 14]. Es ist noch unklar, ob und wenn ja weshalb bestimmte Ethnien häufiger an MIS-C erkranken oder ob die ungleiche Verteilung reflektiert, dass manche Kinder und Jugendliche infolge sozialer Benachteiligungen, prekärer Arbeits-, Lebens- und Wohnsituationen häufiger von COVID-19 betroffen sind.
Wenige Erwachsene betroffen
Zunächst hielt man die neue Erkrankung für eine reine „Kinderkrankheit“. Da mittlerweile auch Erwachsene in der Postakutphase nach einer COVID-19-Infektion mit einer schweren Multisystementzündung diagnostiziert wurden, muss vermutlich umgedacht werden [7]. Für Erwachsene wurde die Bezeichnung MIS-A (A für adult) gewählt. Bei den ersten beiden in Deutschland beschriebenen Fällen fiel zudem auf, dass die Betroffenen somnolent waren und über eine Gelenkbeteiligung in Form von schmerzhaften Arthralgien klagten [5].
Therapieoptionen
Die stationäre Therapie eines MIS-C und MIS-A erfolgt, angelehnt an die beim Kawasaki-Syndrom etablierten Behandlungsmöglichkeiten [15] und je nach klinischer Ausprägung wie folgt [7, 9, 12]:
- Intravenös verabreichte Immunglobuline (IVIg) als Erstlinientherapie, um die Inflammation zu kontrollieren. Einmalige Gabe von 2 g/kg Körpergewicht (KG) über zehn bis zwölf Stunden (unter Verwendung des idealen Körpergewichts), gegebenenfalls kann bei Teilansprechen eine zweite Dosis verabreicht werden.
- ASS, zur Entfieberung, dosiert mit 30 bis 50 mg/kg KG/Tag. Nach 48 bis 72 Stunden Fieberfreiheit Wechsel auf die zur Thrombozytenaggregationshemmung übliche Dosis von 3 bis 5 mg/kg KG/Tag für mindestens sechs Wochen.
- Parallel werden in schweren Fällen – oder je nach Behandlungsprotokoll erst bei ausbleibender Besserung unter Erstlinientherapie – adjuvant Glucocorticoide eingesetzt (Methylprednisolon 2 mg/kg/Tag, aufgeteilt in zwei Dosen, maximale Tagesdosis (TDmax) 60 mg; aber auch Methylprednisolon-Stoßtherapie mit 10 bis 30 mg/kg KG/Tag für ein bis drei Tage, TDmax 1000 mg), dazu begleitend Protonenpumpenhemmer. Fortführung mit oral verabreichtem Prednisolon im ambulanten Bereich und dann ausschleichend absetzen.
- Bei fehlendem Ansprechen kommen als Drittlinientherapie Biologika infrage (Tocilizumab, Anakinra).
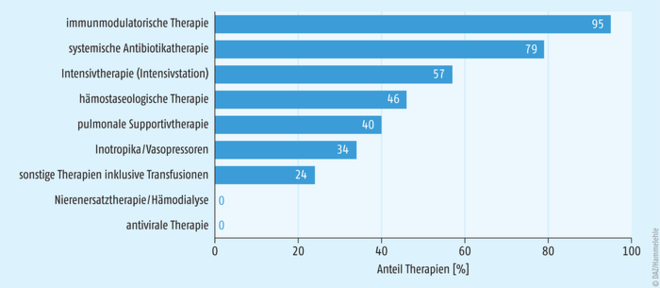
Bei bakterieller Koinfektion, die in vielen Fällen auftritt, ist eine systemische Antibiotika-Therapie angezeigt. Liegt eine signifikant reduzierte LVEF vor, muss eine Herzinsuffizienztherapie (u. a. mit intravenöser Diuretika- und Inotropikagabe) sowie gegebenenfalls eine Antikoagulation eingeleitet werden [10, 12]. Generell bedarf es in der Diagnostik und Behandlung dieses neuen Krankheitsbildes meist der interdisziplinären Zusammenarbeit. Abbildung 2 zeigt Art und Häufigkeit der Therapien, die im deutschen PIMS-Survey registriert wurden.
Abb. 2: Häufigkeitsverteilung der angewandten Therapien bei PIMS, entsprechend der Meldungen im deutschen PIMS-Survey (Mehrfachauswahl möglich). Bei fast allen gemeldeten Fällen kam eine immunmodulatorische Therapie zum Einsatz, um die überschießende Immunreaktion einzudämmen (adaptiert nach [2).]
Gute Prognose
Eine Zunahme der MIS-C-Fälle ist aufgrund weiter steigender COVID-19-Inzidenz zu erwarten. Bei korrekter Diagnosestellung und rechtzeitiger Therapie besteht aber eine gute Prognose, weshalb es wichtig ist, dass neben gut informierten Kinderärzten auch das Apothekenpersonal und Eltern für die Symptomatik sensibilisiert sind. Glücklicherweise traten in Deutschland im Zusammenhang mit MIS-C bisher keine Todesfälle auf [2], letale Verläufe sind aber aus Großbritannien, Spanien und den USA bekannt [1, 11], meist bei Kindern mit Vorerkrankungen. Für die Vereinigten Staaten von Amerika kommen die für die Erfassung von MIS-C-Meldungen verantwortlichen Centers for Disease Control and Prevention (CDC) beispielsweise auf 36 Todesfälle bei 3185 gemeldeten Fällen [13]. Obwohl es sich um ein sehr seltenes Syndrom handelt, sollte es aufgrund seiner Schwere bei der Diskussion um den potenziellen Nutzen der Impfung von Kindern mitberücksichtigt werden. |
Literatur
[1] Riphagen S et al. Hyperinflammatory shock in children during COVID-19 pandemic. Lancet 2020;395(10237):1607
[2] PIMS-Survey Uptdate 2021. Informationen der Deutschen Gesellschaft für Pädiatrische Infektiologie e. V. (DGPI), https://dgpi.de/pims-survey-update/ (letzter Zugriff am 13.04.2021)
[3] Belay ED et al. Trends in Geographic and Temporal Distribution of US Children With Multisystem Inflammatory Syndrome During the COVID-19 Pandemic. JAMA Pediatr 2021, doi:10.1001/jamapediatrics.2021.0630
[4] Samueli S et al. PIMS – eine neue pädiatrische Herausforderung. Monatsschr Kinderheilkd 2021;169:317–321, https://doi.org/10.1007/s00112-021-01139-3
[5] Rieper R und Sturm A. Erste Fälle des Multisystem Inflammatory Syndrome nach SARS-CoV-2-Infektion bei jungen Erwachsenen in Deutschland. Dtsch Med Wochenschr 2021. DOI: 10.1055/a-1404-6763
[6] Vogel TP et al. Multisystem inflammatory syndrome in children and adults (MIS-C/A): Case definition & guidelines for data collection, analysis, and presentation of immunization safety data. Vaccine 2021. https://doi.org/10.1016/j.vaccine.2021.01.054
[7] Bastug A et al. Multiple system inflammatory syndrome associated with SARS‑CoV‑2 infection in an adult and an adolescent. Rheumatology International 2021. https://doi.org/10.1007/s00296-021-04843-1
[8] Vella LA et al. Deep immune profiling of MIS-C demonstrates marked but transient immune activation compared to adult and pediatric COVID-19. Sci. Immunol 2021;6(57). DOI: 10.1126/sciimmunol.abf7570
[9] Son MBF und Friedman K. COVID-19: Multisystem inflammatory syndrome in children (MIS-C) management and outcome. Uptodate 2021 (letzter Zugriff am 08.04.2021)
[10] Son MBF und Friedman K. COVID-19: Multisystem inflammatory syndrome in children (MIS-C) clinical features, evaluation, and diagnosis. Uptodate 2021 (letzter Zugriff am 08.04.2021)
[11] Hoste L et al. Multisysteminflammatory syndrome in children related to COVID-19: a systematic review. European Journal of Pediatrics 2021. https://doi.org/10.1007/s00431-021-03993-5
[12] Harwood R et al. A national consensus management pathway for paediatric inflammatory multisystem syndrome temporally associated with COVID-19 (PIMS-TS): results of a national Delphi process. Lancet Child Adolesc Health 2021;5:133–41
[13] Centers for Disease Control and Prevention (CDC). Health Department-Reported Cases of Multisystem Inflammatory Syndrome in Children (MIS-C) in the United States. https://www.cdc.gov/mis-c/cases/index.html
[14] Feldstein LR et al. Characteristics and Outcomes of US Children and Adolescents With Multisystem Inflammatory Syndrome in Children (MIS-C) Compared With Severe Acute COVID-19. JAMA 2021;325(11):1074-1087. doi:10.1001/jama.2021.2091
[15] Neudorf U et al. Leitlinie Kawasaki Syndrom (S2k Leitlinie). AWMF-Registernummer 185-003. Stand: 16.12.2020






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.