
- DAZ.online
- DAZ / AZ
- DAZ 50/2020
- Was über den Biontech-...
Pandemie Spezial
Was über den Biontech-Impfstoff bekannt ist
Britische Fachinformation zu BNT162b2 gewährt Einblick in die Datenlage
Zugelassen ist der Impfstoff ab einem Alter von 16 Jahren, unter anderem aufgrund der Daten der im Juli 2020 gestarteten Phase-III-Studie von Biontech/Pfizer, die bislang nicht öffentlich zugänglich sind. Die britische Fachinformation beschreibt, dass dazu rund 44 000 gesunde Probanden zwischen 12 und 85 Jahren in Deutschland, der Türkei, Brasilien, Argentinien und Südafrika rekrutiert worden sind. Ausgeschlossen waren immunsupprimierte Patienten und solche, die schon zuvor eine COVID-19-Erkrankung durchgemacht hatten.
Die Hälfte der Probanden erhielt den Impfstoff BNT162b2, die andere Hälfte Placebo in Form von Kochsalzlösung. Verabreicht wurden zunächst eine Dosis und in der Regel 21 Tage später die zweite. Die klinische Wirksamkeit wurde anhand der COVID-19-Erkrankungen nach über 7 Tagen nach der zweiten Impfung ermittelt. In der Verumgruppe wurden acht Fälle registriert, in der Placebogruppe 162. Daraus errechnet sich laut Pressemitteilung von Biontech/Pfizer eine klinische Wirksamkeit von 95% über alle Altersgruppen hinweg und von 94% in der Gruppe der über 65-Jährigen [2].
Die Aufbereitung
Der Impfstoff wird in Gebinden von 195 Multidose-Vials geliefert, tiefgefroren bei -80 °C. Sie müssen zunächst auf eine Temperatur von -2 bis -8 °C gebracht werden. Dazu sind drei Stunden pro Gebinde zu veranschlagen. Für den sofortigen Gebrauch können die gefrorenen Vials auch 30 Minuten bei 25 °C aufgetaut werden.
Aufgetaute Vials mit unverdünntem Impfstoff können dann bei 2 bis 8 °C, also bei Kühlschranktemperaturen, für fünf Tage aufgehoben werden, bei 25 °C, also bei Raumtemperatur, für zwei Stunden.
Vor der Impfung muss der Impfstoff auf Raumtemperatur gebracht und zehnmal vorsichtig zur Durchmischung auf und ab bewegt werden. Der Impfstoff darf nicht geschüttelt werden. Er muss danach eine milchige Konsistenz aufweisen, frei von jedweden sichtbaren Partikeln.
Anschließend muss jedes Vial mit 1,8 ml 0,9%iger, unkonservierter Natriumchlorid-Lösung unter aseptischen Bedingungen verdünnt werden. Nach der Verdünnung kann der Impfstoff bei 2 bis 25 °C gelagert werden, muss aber innerhalb von sechs Stunden verimpft werden. Jedes Vial enthält fünf Impfstoffdosen zu 0,3 ml.
Die Nebenwirkungen
Zu den Nebenwirkungen wird ausgeführt, dass der Impfstoff gut vertragen wurde. Detailliertere Informationen sind der britischen Fachinformation zu entnehmen. Als seltene Nebenwirkung (1 bis 10 von 10 000) werden hier eine Lymphadenopathie und Unwohlsein angegeben, sehr häufig (mehr als einer von 10) waren Kopfschmerzen, Arthralgien, Myalgien, Schmerzen an der Injektionsstelle, Abgeschlagenheit, Müdigkeit und Fieber. Häufige Nebenwirkungen (1 bis 10 von 100) waren Rötungen und Schwellungen an der Injektionsstelle sowie Übelkeit.
Schwangerschaft ausschließen
Für die britsche Notfall-Zulassung lagen keine Daten zur Pharmakokinetik und zu Interaktionsstudien vor, auch reproduktionstoxische Tierversuche sind noch nicht abgeschlossen. Daher wird eine Impfung in der Schwangerschaft nicht empfohlen. Bei Frauen im gebärfähigen Alter sollte eine Schwangerschaft vor der Impfung ausgeschlossen werden. Danach sollte für eine sichere Verhütung für mindestens zwei Monate nach der zweiten Impfung gesorgt werden. Während der Stillzeit ist eine Impfung kontraindiziert, da nicht klar ist, ob der Impfstoff in die Muttermilch übergeht und das Neugeborene gefährden könnte. Zudem wird darauf verwiesen, dass unklar ist, ob der mRNA-Impfstoff BNI162b2 Auswirkungen auf die Fruchtbarkeit hat.
Kein Einbau ins Erbgut
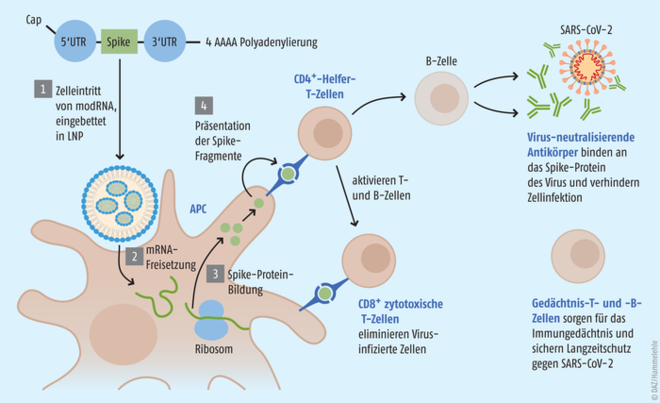
Die zur Impfung genutzte modifizierte mRNA ist in Lipidnanopartikel eingebettet, mit deren Hilfe sie in die Zellen, aber nicht in den Zellkern gelangt. Die in die Zellen freigesetzte mRNA wird an den Ribosomen abgelesen, dort wird das als Antigen fungierende Spike-Protein gebildet. Dieses induziert sowohl die Bildung von neutralisierenden Antikörpern als auch eine zelluläre Immunantwort gegen SARS-CoV-2 und sollen so vor COVID-19 schützen (Abb.). Die Sorge, dass die mRNA ins Erbgut integriert werden könnte, entkräftet das Paul-Ehrlich-Institut wie folgt: „Es besteht keine Gefahr einer Integration von mRNA in das humane Genom. Beim Menschen befindet sich das Genom in Form von DNA im Zellkern. Eine Integration von RNA in DNA ist unter anderem aufgrund der unterschiedlichen chemischen Struktur nicht möglich. Es gibt auch keinen Hinweis darauf, dass die von den Körperzellen nach der Impfung aufgenommen mRNA in DNA umgeschrieben wird.“
Viele offene Fragen
Weitere Fragen, unter anderem zu der Bildung von immunverstärkenden Antikörpern (ADE), der Entstehung von Autoimmunerkrankungen und weiteren möglichen Langzeitfolgen, lassen sich derzeit noch nicht beantworten. Dafür ist die Zeit, rund vier Monate nach Start der Phase-III-Studie, einfach zu kurz. Zudem ist unklar, ob geimpfte Personen nach Viruskontakt weiter ansteckend sind. Auch über die Dauer des Impfschutzes lässt sich noch keine Aussage treffen. |
Literatur
[1] www.gov.uk/government/publications/regulatory-approval-of-pfizer-biontech-vaccine-for-covid-19
[2] Presseinformation von Biontech/Pfizer vom 2. Dezember 2020. https://investors.biontech.de/





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.