
- DAZ.online
- DAZ / AZ
- DAZ 50/2020
- Mundspülungen gegen ...
Pandemie Spezial
Mundspülungen gegen COVID-19
Was zur Wirksamkeit und Toxikologie von aseptischen Mundspüllösungen bekannt ist
Das Coronavirus SARS-CoV-2 ist mittlerweile in seiner Struktur und Funktion gut bekannt. Das umhüllte RNA-Virus weist eine typische „Spike“-Struktur auf seiner Membranhülle auf, die es zum Eindringen in die menschliche Wirtszelle nutzt [Shang et al. 2020]. Dabei interagieren die Spikes mit den Angiotensin-Converting-Enzyme-2(ACE2)-Rezeptoren der Zellen in unserem Mund. ACE2 wird als Transmembranprotein auf der Schleimhaut, dem Zahnfleisch und den Epithelzellen der Zunge und Speicheldrüsen exprimiert. Somit sind Mund-, Nasen- und Rachenraum wichtige Eintrittspforten für SARS-CoV-2. Der Nasen-Rachen-Raum dient als Reservoir, da gerade im Frühstadium der Krankheit die Viruslast im Speichel konstant hoch ist [Yoon et al. 2020]. Speichel spielt eine wichtige Rolle bei der Übertragung des Erregers. In Speichelproben von zwölf COVID-19-Patienten wurde das Virus nachgewiesen, wobei die Anzahl der Kopien bis zu 108 pro Milliliter Speichel betrug [To et al. 2020].
Um die Viruslast im Mund und Speichel zu senken und eine Übertragung des Virus zu verhindern, empfehlen die CDC (Centers for Disease Control and Prevention) und die American Dental Association (ADA) die Verwendung von Mundspülungen mit Wasserstoffperoxid oder PVP-Iod vor oralen Eingriffen [ADA Guidance 2020; CDC Guidance 2020].
Aktuell werden weltweit mehrere klinische Studien durchgeführt, die die Wirksamkeit von antiseptischen Mundspülungen zur Vermeidung der Übertragung von SARS-CoV-2 untersuchen. Zudem gibt es experimentelle Studien sowie Hinweise in der Literatur, die eine Verwendung von antiseptischen Mundspülungen zur Eindämmung von SARS-CoV-2 nahelegen [Herrera et al. 2020, Carrouel et al. 2020]. Möglicherweise geeignet sind demnach wohl Stoffe wie Chlorhexidin (Chlorhexamed® Mund-Antiseptikum ), Octenidin (Octenident®Mundspülung) oder Povidon-Iod (Betaisodona® Mund-Antiseptikum).
Cave: In-vitro-Daten liefern lediglich Hinweise
Während die Aktivität von Antibiotika oder Antiseptika gegen Bakterien und Pilze mit geeigneten Kulturmedien relativ leicht untersucht werden kann, ist die Prüfung von Wirkstoffen auf ihre antivirale Aktivität komplizierter. Da Viren zur Vermehrung auf lebende Zellen angewiesen sind, werden Experimente mit Zellkulturen durchgeführt. Die Zellen werden mit den Viren infiziert und die Beeinflussung ihrer Vermehrung mit entsprechenden Kontrollen verglichen. Dieses System ist artifiziell und die Ergebnisse sind in hohem Maße von den Kulturbedingungen abhängig. Welche Zellen werden verwendet? Welcher Virusstamm? Wie lange wird inkubiert? Wie unterscheidet man Effekte auf die verwendeten Zellen von direkt antiviralen Wirkungen? Welchen Einfluss haben Kälberserum oder Antibiotika, die in der Regel diesen Kulturen zugesetzt werden? Daten aus solchen Versuchen können einen Hinweis auf eine mögliche Wirksamkeit der untersuchten Stoffe beim Patienten liefern, vor einer unkritischen Interpretation der Ergebnisse muss aber gewarnt werden. Direkte Empfehlungen für eine prophylaktische oder therapeutische Verwendung sind nicht möglich.
Zur Erinnerung: Vor einigen Monaten wurde das antiinflammatorisch wirksame Malariamittel Hydroxychloroquin als Heilmittel für COVID-19-Patienten empfohlen, weil es bereits in niedrigen Konzentrationen in virusinfizierten Zellkulturen zu einer Hemmung der viralen Vermehrung führte. Gut durchgeführte klinische Studien kamen jedoch zu einem negativen Ergebnis, im Vergleich zu Placebo bestand kein Unterschied im Therapieerfolg. Zurückhaltung ist daher auch bei der Betrachtung erster Ergebnisse von Experimenten mit Antiseptika in SARS-CoV-2-infizierten Zellkulturen geboten.
Chlorhexidin
Chlorhexidin ist ein Antiseptikum mit breitem antimikrobiellem Wirkungsspektrum. Es wird in der Zahnmedizin zur Unterstützung der Heilungsphase nach parodontalchirurgischen Eingriffen und zur unterstützenden Behandlung bei bakteriell bedingten Zahnfleischentzündungen (Gingivitis) eingesetzt. In Zellkulturversuchen konnte bereits vor Jahrzehnten eine antivirale Wirkung bei lipidumhüllten Viren wie Influenza A oder Zytomegalievirus gezeigt werden, jedoch nicht bei Viren ohne Hülle [Bernstein et al. 1990]. Da auch Coronaviren eine Lipidhülle besitzen, scheinen die Voraussetzungen theoretisch gegeben zu sein, die verfügbare Information ist jedoch sehr limitiert. Bei zwei COVID-19-Patienten reduzierte Chlorhexidin nach einmaliger Anwendung nur vorübergehend für zwei Stunden die Viruslast im Speichel [Yoon et al. 2020].
In einer In-vitro-Studie mit SARS-CoV-2 wurde eine Reduktion der Viruslast durch Chlorhexidin beobachtet. Es handelte sich um eine vergleichende Studie, in der sieben weitere kommerziell verfügbare Zubereitungen von Virologen der Universität Bochum geprüft wurden. Die Autoren haben versucht, die physiologischen Bedingungen zu imitieren, indem der Effekt von nasopharyngealen Sekreten durch Zusatz von Mucin und Protein modelliert wurde. Für 30 Sekunden wurden die Viren mit der Mundspüllösung inkubiert, dann wurde die Wirkung durch Verdünnung gestoppt. Der Effekt des Präparats Chlorhexamed forte® war bei den drei untersuchten Virusstämmen, die in Ulm und Essen isoliert worden waren, leicht unterschiedlich. Ein weiteres Chlorhexidin-haltiges Präparat (Dynexidine® forte 0,2%) zeigte bei allen drei Stämmen einen ähnlichen, etwas schwächeren Effekt. Die Reduktion der Viren lag bei maximal einer log10-Stufe, die Viren wurden also unter diesen Bedingungen zu maximal 90% inaktiviert. Die Tabelle 1 zeigt die Wirkungen der acht Präparate in diesen Zellkulturexperimenten. Die Ergebnisse können nicht im Sinne einer möglichen prophylaktischen oder therapeutischen Wirksamkeit interpretiert werden [Meister et al. 2020].
Präparat | Wirkstoff | Reduktionsfaktor (log) |
|---|---|---|
Cavex oral Pre Rinse (nur in Zahnarztpraxen erhältlich) | Wasserstoffperoxid 1,5% | < 1 |
Chlorhexamed® forte Lösung apothekenpflichtiges Arzneimittel | Chlorhexidindigluconat 2 mg/ml | 1 |
Dequonal® Lösung apothekenpflichtiges Arzneimittel | Dequaliniumchlorid 0,15 mg/ml, Benzalkoniumchlorid 0,3 mg/ml | 3 |
Dynexidine forte 0,2% Lösung nichtapothekenpflichtiges Arzneimittel | Chlorhexidindigluconat 2 mg/ml | < 1 |
Iso-Betadine Mundspülung 1,0% (in Deutschland nicht im Handel) | Povidon-Iod 11 mg/ml | 3 |
Listerine® Cool Mint Lösung sonstiges Nichtarzneimittel | Ethanol, ätherische Öle | 3 |
Octenident® Mundspülung sonstiges Nichtarzneimittel | Octenidin ≥ 0,025 bis < 0,1% w/w | 1 |
Prontoral® Mundspülung Medizinprodukt | Polyhexanid 1,5 mg/ml, Undecylenamidopropylbetain 1 mg | < 1 |
Chlorhexidin ist nicht für eine dauerhafte Anwendung geeignet. Häufige Nebenwirkungen von Chlorhexidin-haltigen Mundspüllösungen, insbesondere bei längerer Anwendung, sind reversible Verfärbungen von Zähnen und Zunge, die durch sachgemäßen Gebrauch und Vermeidung von stark färbenden Lebensmitteln und Getränken reduziert werden können. Auch Geschmacksstörungen, Brennen oder Kribbeln des Mundraumes können während einer längeren Anwendung auftreten. Kontraindikationen schränken die Einsatzmöglichkeiten ein. Der Wirkstoff sollte nicht bei schlecht durchblutetem Gewebe, Wunden und Geschwüren (Ulzerationen) sowie oberflächlichen, nicht-blutenden Abschilferungen der Mundschleimhaut (erosiv-desquamativen Veränderungen) angewendet werden. Schwangere sollten ebenfalls auf eine Verwendung verzichten, da die Erfahrungen begrenzt sind. Auch Kinder unter sechs Jahren bzw. Personen, die die Lösung schlucken könnten, sollten ebenfalls den Mund mit diesem Wirkstoff nicht spülen. Zwar wird Chlorhexidin schlecht resorbiert und systemische Wirkungen sind selbst bei Einnahme größerer Mengen nicht zu befürchten, dennoch kann es zu schweren allergischen Reaktionen im Zusammenhang mit Chlorhexidin-haltigen Antiseptika kommen.
Die Viruslast dort senken, wo die Infektionskette beginnt
Mit antiseptischen Spülungen wird versucht, die Viruslast im Mund zu senken, um so eine Übertragung und das Eindringen von SARS-CoV-2 über die Mund- und Nasenschleimhaut zu verhindern. Verwendet werden kann z. B. das Betaisodona® Mund-Antiseptikum. Es enthält einen Povidon-Iod-Komplex, aus dem im sauren wässrigen Milieu (pH-Wert 2 bis 7) nicht komplex gebundenes Iod freigesetzt wird. Das freie Iod reagiert als starkes Oxidationsmittel vor allem mit ungesättigten Fettsäuren sowie mit leicht oxidierbaren SH- oder OH-Gruppen der Aminosäuren in Enzymen und Strukturproteinen der Mikroorganismen. Dieses unspezifische Wirkprinzip erklärt die Aktivität gegen ein breites Spektrum humanpathogener Mikroorganismen, z. B. gram-positive und gram-negative Bakterien, Pilze, zahlreiche Viren und einige Protozoen. 1 ml Betaisodona® Mund-Antiseptikum enthält 75 mg Povidon-Iod mit einem Gehalt von 10% verfügbarem Iod (entspricht 7,5 mg Iod). Die Lösung ist unverdünnt oder verdünnt zur äußerlichen Anwendung in Mund und Rachen bestimmt.
Unverdünnt wird die Povidon-Iod-Lösung zur einmaligen Antiseptik in der Mundhöhle vor operativen und anderen zahnärztlichen Eingriffen eingesetzt, eine Einwirkungszeit von 30 Sekunden sollte nicht unterschritten werden. Zur mehrmaligen Anwendung in der Mundhöhle wird in der Fachinformation Betaisodona® Mund-Antiseptikum empfohlen, die Lösung 1 : 4 mit warmem Wasser zu verdünnen. Mehrmals täglich sollte - nach den Mahlzeiten - mit der frisch hergestellten verdünnten Lösung ca. drei Minuten der Mund gespült und anschließend ausgespuckt werden. Die Lösung darf nicht geschluckt werden. Kontraindiziert ist Povidon-Iod-Lösung u. a. bei Überempfindlichkeit gegen Iod, bei Kindern unter sechs Jahren, bei Hyperthyreose oder anderen manifesten Schilddrüsen-Erkrankungen oder vor und nach einer Radio-Iod-Anwendung. Alle Iod-haltigen Präparate sollten während einer Schwangerschaft nur nach strenger Indikationsstellung angewendet werden.
[Fachinformation Betaisodona® Mund-Antiseptikum, Stand: 20. August 2020]
Octenidin
Die quartäre Ammoniumverbindung Octenidindihydrochlorid besitzt eine breite antiseptische Wirkung gegenüber Bakterien, Pilzen und behüllten Viren. Es wird zur Haut-, Schleimhaut- und Wundantiseptik angewendet sowie in der Zahnmedizin als mögliche Alternative zu Chlorhexidin eingesetzt. Für das Coronavirus SARS-CoV-2 zeigte Octenidin in dem bereits beschriebenen vergleichenden In-vitro-Experiment eine ähnliche Reduktion der Viren wie Chlorhexidin (s. Tab. 1). Ergebnisse aus klinischen Studien gibt es bisher nicht.
Da Octenidin in Wasser schlecht löslich ist, werden Hilfsstoffe wie Phenoxyethanol hinzugefügt. Für eine orale Anwendung müssen Aroma- und weitere Zusatzstoffe beigemischt werden, da Octenidin einen bitteren Eigengeschmack hat. Während der Anwendung können Zahnverfärbungen auftreten, die jedoch im Vergleich zu Chlorhexidin weniger stark ausfallen. Octenidin wird nicht über die Haut oder Schleimhäute aufgenommen, systemische Nebenwirkungen sind daher nicht zu erwarten. Kontraindiziert ist Octenidin bei tiefen Wunden, da es zu persistierenden Ödemen, Erythemen und Gewebenekrosen führen kann. Ebenso dürfen Kinder unter drei Jahren und Personen, die die Lösung verschlucken könnten, keine Octenidin-haltige Mundspülung verwenden.
Povidon-Iod
Povidon-Iod (Polyvinylpyrrolidon-Iod, PVP-Iod) wird vielseitig in der medizinischen Wundversorgung, zur perioperativen Antiseptik und als Mundspülung in der Zahnmedizin angewendet. Das Wirkungsspektrum ist breit, es umfasst Bakterien, Pilze, Viren, Sporen und Protozoen. Das Antiseptikum ist zudem besser gewebeverträglich als beispielsweise Chlorhexidin- oder Octenidin-haltige Präparate, stört nicht das Gleichgewicht der Mundflora und verursacht keine Zahn- oder Zungenverfärbungen oder Geschmacksstörungen bei kurzfristigen Anwendungen.
Die viruzide Wirkung von PVP-Iod gegenüber Coronaviren, einschließlich SARS-CoV und MERS, wurde bereits vor einigen Jahren nachgewiesen [Eggers et al. 2015]. Auch mit SARS-CoV-2 wurden in den letzten Monaten mehrere In-vitro-Versuche durchgeführt, die bemerkenswerte Ergebnisse lieferten [Meister et al. 2020; Hassandarvish et al. 2020]. Die Bochumer Virologen berichten von einer vergleichsweise hohen antiviralen Aktivität von PVP-Iod gegenüber SARS-CoV-2 (s. Tab. 1). Die kurze Einwirkzeit führte zu einer Virusinaktivierung von mehr als 99,9%. In mehreren, ähnlich konzipierten Versuchen wurde PVP-Iod im Vergleich mit anderen Zubereitungen getestet. PVP-Iod konnte in allen untersuchten Konzentrationen SARS-CoV-2 inaktivieren.
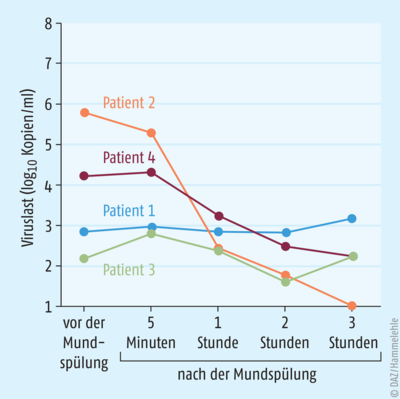
Die Anwendung von PVP-Iod-haltigen Mundspülungen mit Konzentrationen bis zu 2,5% wird über einen Zeitraum von bis zu sechs Monate als sicher angesehen [Frank et al. 2020]. In einem ersten Versuch konnte mit einer 1%igen PVP-Iod-Mundspülung über eine Minute die Viruslast bei COVID-19-Patienten signifikant gesenkt werden. Die Wirkung war bei zwei Patienten mit hohen Ausgangswerten besonders ausgeprägt (Abb. 1) [Martínez Lamas et al. 2020]. Dennoch müssen weitere klinische Studien folgen, um umfassende Aussagen zur Wirksamkeit und Sicherheit von PVP-Iod sowie zum Unterbrechen von Infektionsketten treffen zu können. Die Internetseite www.clinicaltrials.gov listet die momentan laufenden Studien auf. Mehr als ein Dutzend Studien werden zurzeit mit Povidon-Iod und Chlorhexidin, teilweise im direkten Vergleich, durchgeführt.
Abb. 1: Viruskonzentration im Speichel von vier Patienten mit COVID-19. Die Proben wurden vor und an vier Zeitpunkten nach der Mundspülung mit PVP-Iod untersucht. [modifiziert nach Lucia Martinez Lamas et al. 2020]
Vorsicht mit PVP-Iod bei Schilddrüsenerkrankungen
Aufgrund der perkutanen Resorption von PVP-Iod, vor allem bei Wunden, können systemische Effekte und Unverträglichkeiten auftreten. Veränderungen der Schilddrüsenfunktion, Ablagerungen von PVP im retikulohistiozytären System der Leber, metabolische Azidosen und Niereninsuffizienz sind mögliche Folgen. Auch die Entwicklung einer Iod-Allergie durch freigesetztes Iodid ist möglich, jedoch sind die sensibilisierenden Eigenschaften durch die Komplexbildung mit PVP erheblich reduziert. Die Prävalenz für eine Iod-Allergie liegt bei etwa 0,4% [Lachapelle, 2014]. Häufiger treten Hautirritationen auf.
Kontraindikationen für die Iod-haltige Zubereitung bestehen bei Hyperthyreose oder anderen manifesten Schilddrüsenerkrankungen, Dermatitis herpetiformis Duhring, Überempfindlichkeit gegen Iod sowie Anwendung vor und nach Radioiodtherapie. Auch für Kinder unter sechs Jahren ist eine PVP-Iod-haltige Mundspülung aufgrund der möglichen Gefahr des Verschluckens nicht geeignet. Während der Schwangerschaft und Stillzeit ist die Anwendung ebenfalls zu vermeiden, da mit einer Iod-Resorption gerechnet werden muss. Eine gleichzeitige Anwendung von Povidon-Iod und Octenidin darf nicht erfolgen, da es zu einer anhaltenden, intensiv braunen bzw. violetten Verfärbung der betroffenen Hautstelle führt. Das Gleiche gilt für die Kombination mit Wasserstoffperoxid. Nach versehentlicher oraler Einnahme großer Mengen von Povidon-Iod können Symptome einer akuten Iod-Intoxikation auftreten mit akuten Symptomen wie Krämpfen, Erbrechen, Durchfall und Blutdruckabfall [Fachinfo Betaisodona® Mund-Antiseptikum].
Wasserstoffperoxid, Dequaliniumchlorid, Ethanol
Wasserstoffperoxid wird in der Zahnmedizin seit Beginn des Jahrhunderts verwendet. Die farb- und geruchlose Flüssigkeit ist in vitro gegenüber bestimmten Viren wirksam, wobei sich Influenza- und Coronaviren als am empfindlichsten zeigten. In den Zellkulturversuchen mit SARS-CoV-2 war die inaktivierende Wirkung von Wasserstoffperoxid eher gering und ähnlich wie die von Chlorhexidin und Octenidin. In einer Pilotstudie wurde die Wirksamkeit von 20 ml 1%iger Wasserstoffperoxid-Lösung nach 30 Sekunden Gurgeln bei zehn COVID-19 Patienten geprüft. Vor dem Gurgeln wurden sehr variable Viruskonzentrationen zwischen 2,9 × 102 und 4,8 × 106 pro Milliliter ermittelt, nach dem Gurgeln lagen die Werte in ähnlichen Bereichen. Es konnte keine signifikante Abnahme der SARS-CoV-2-Last festgestellt werden, allerdings lassen sich angesichts der hohen Variabilität und der kleinen Zahl untersuchter Patienten keine definitiven Schlüsse aus diesem Ergebnis ziehen [Gottsauner et al. 2020]. Um Klarheit im Umgang mit Wasserstoffperoxid im Rahmen der Prävention von COVID-19 zu bekommen, sind weitere prospektive klinische Studien unabdingbar. Solche Studien werden zurzeit in verschiedenen Ländern, wie USA, Brasilien, China und anderen durchgeführt und stehen teilweise kurz vor dem Abschluss. Wasserstoffperoxid (z. B. Cavex oral PreRinse®) ist in niedrigen Konzentrationen von bis zu 3% im Vergleich zu anderen antiseptischen Wirkstoffen gut gewebeverträglich, aufgrund seiner oxidierenden Eigenschaften sollte es nicht mit anderen Wirkstoffen kombiniert werden.
Ein weiteres kommerziell erhältliches Antiseptikum zur oralen Mundspülung ist Dequonal®, das die quartären Ammoniumverbindungen Dequaliniumchlorid und Benzalkoniumchlorid enthält. Bei einer direkten Exposition der Coronaviren wurde eine deutliche Inaktivierung beobachtet (Tabelle 1). Ob dies auch in der Mundhöhle des Menschen der Fall ist, kann nicht beantwortet werden.
Auf einen Blick
- Der Mund-, Nasen- und Rachen-Raum gilt als wichtige Eintrittspforte für SARS-CoV-2.
- Die Viruslast im Speichel ist besonders hoch. Um sie zu senken und damit eine Übertragung des Virus zu reduzieren, können antiseptische Mundspülungen angewendet werden.
- Chlorhexidin, Octenidin, Povidon-Iod und andere sind antiseptisch wirksam gegenüber Bakterien, Pilzen und behüllten Viren.
- In einer In-vitro-Studie mit SARS-CoV-2 konnte eine Inaktivierung der Viren durch die untersuchten Mundspülungen in unterschiedlichem Ausmaß beobachtet werden.
- Mit jedem Präparat können – insbesondere bei langfristiger Anwendung – unerwünschte Wirkungen auftreten, Kontraindikationen müssen beachtet werden.
- Es liegen bisher keine Ergebnisse aus klinischen Studien zur Wirksamkeit und Sicherheit von antiseptischen Mundspülungen im Rahmen der COVID-19-Pandemie vor.
Ethanol ist zum Beispiel in dem Produkt Listerine® Cool Mint enthalten. Es ist in niedrigen Konzentrationen als Kombinationspartner für Antiseptika geeignet. Gegenüber SARS-CoV-2 zeigte das Präparat in vitro eine signifikante Inaktivierung, ähnlich wie PVP-Iod. Jedoch fehlen auch für alkoholische Lösungen klinische Daten zur Wirksamkeit, die eine Evidenz-basierte Verwendung von Ethanol zur Eindämmung der COVID-19-Pandemie unterstützen würden.
Fazit
Die Verwendung von antiseptischen Mundspülungen zur Unterbrechung von Infektionsketten während der COVID-19-Pandemie scheint eine sinnvolle Maßnahme zu sein. Zellkulturexperimente zeigen, dass Wirkstoffe wie PVP-Iod, Ethanol oder quartäre Ammoniumverbindungen SARS-CoV-2 inaktivieren können. Es besteht jedoch ein deutlicher Mangel an klinischen Daten zur Wirksamkeit und Sicherheit, der eine fundierte Empfehlung derzeit nicht zulässt. Für eine sichere langfristige Anwendung ist es zwingend notwendig, die optimale Konzentration und das beste Dosierungsregime zu kennen. Antiseptika sollten mit Bedacht unter der Berücksichtigung der Vorgaben des Herstellers hinsichtlich Einwirkzeiten, Dosierungen und bestimmungsgemäßem Gebrauch verwendet werden, um nicht nur eine zuverlässige Wirksamkeit zu erreichen, sondern auch um Unverträglichkeiten und Fehlanwendungen zu vermeiden. |
Literatur
American Dental Association. 2020. ADA interim guidance for minimizing risk of COVID-19 transmission. www.kavo.com/en-us/resource-center/ada-interim-guidance-minimizing-risk-covid-19-transmission, Abruf: 25. November 2020
Bernstein D, Schiff G, Echler G, Prince A, Feller M, Briner W. In vitro virucidal effectiveness of a 0.12%-chlorhexidine gluconate mouthrinse. J Dent Res 1990;69(3):874-876, doi: 10.1177/00220345900690030901. PMID: 2109001
Carrouel F, Gonçalves LS, Conte MP, Campus G, Fisher J, Fraticelli L, Gadea-Deschamps E, Ottolenghi L, Bourgeois D. Antiviral Activity of Reagents in Mouth Rinses against SARS-CoV-2. J Dent Res 2020;22:22034520967933, doi: 10.1177/0022034520967933. Epub ahead of print, PMID: 33089717, PMCID: PMC7582358
CDC (Centers for Disease Control and Prevention). Interim infection prevention and control guidance for dental settings during the COVID-19 response. www.cdc.gov/coronavirus/2019-ncov/hcp/dental-settings.html, Abruf: 25. November 2020
Eggers M, Eickmann M, Zorn J. Rapid and Effective Virucidal Activity of Povidone-Iodine Products Against Middle East Respiratory Syndrome Coronavirus (MERS-CoV) and Modified Vaccinia Virus Ankara (MVA). Infect Dis Ther 2015;4(4):491-501, doi: 10.1007/s40121-015-0091-9, Epub 28. September 2015, PMID: 26416214; PMCID: PMC4675768
Frank S, Capriotti J, Brown SM, Tessema B. Povidone-Iodine Use in Sinonasal and Oral Cavities: A Review of Safety in the COVID-19 Era. Ear Nose Throat J 2020;99(9):586-593, doi: 10.1177/0145561320932318, Epub 10. Juni 2020, PMID: 32520599
Gottsauner MJ, Michaelides I, Schmidt B, Scholz KJ, Buchalla W, Widbiller M, Hitzenbichler F, Ettl T, Reichert TE, Bohr C, Vielsmeier V, Cieplik F. A prospective clinical pilot study on the effects of a hydrogen peroxide mouthrinse on the intraoral viral load of SARS-CoV-2. Clin Oral Investig 2020;24(10):3707-3713, doi: 10.1007/s00784-020-03549-1. Epub 2020 Sep 2. PMID: 32876748; PMCID: PMC7464055
Hassandarvish P, Tiong V, Sazaly AB, Mohamed NA, Arumugam H, Ananthanarayanan A, Qasuri M, Hadjiat Y. Povidone iodine gargle and mouthwash. Br Dent J 2020;228(12):900, doi: 10.1038/s41415-020-1794-1, Erratum in: Br Dent 2020;229(2):75, PMID: 32591671; PMCID: PMC7319196
Herrera D, Serrano J, Roldán S, Sanz M. Is the oral cavity relevant in SARS-CoV-2 pandemic? Clin Oral Investig 2020;24(8):2925-2930, doi: 10.1007/s00784-020-03413-2, Epub 23. Juni 2020, PMID: 32577830; PMCID: PMC7309196
Lachapelle JM. A comparison of the irritant and allergenic properties of antiseptics. Eur J Dermatol 2014;24(1):3-9, doi: 10.1684/ejd.2013.2198. PMID: 24492204
Martínez Lamas L, Diz Dios P, Pérez Rodríguez MT, Del Campo Pérez V, Cabrera Alvargonzalez JJ, López Domínguez AM, Fernandez Feijoo J, Diniz Freitas M, Limeres Posse J. Is povidone iodine mouthwash effective against SARS-CoV-2? First in vivo tests. Oral Dis 2020;2:10.1111/odi.13526, Epub ahead of print, PMID: 32615642; PMCID: PMC7362147
Meister TL, Brüggemann Y, Todt D, Conzelmann C, Müller JA, Groß R, Münch J, Krawczyk A, Steinmann J, Steinmann J, Pfaender S, Steinmann E. Virucidal Efficacy of Different Oral Rinses Against Severe Acute Respiratory Syndrome Coronavirus 2. J Infect Dis 2020;222(8):1289-1292, doi: 10.1093/infdis/jiaa471. PMID: 32726430; PMCID: PMC7454736
Shang J, Wan Y, Luo C, Ye G, Geng Q, Auerbach A, Li F. Cell entry mechanisms of SARS-CoV-2. Proc Natl Acad Sci USA 2020;117(21):11727-11734, doi: 10.1073/pnas.2003138117, Epub 6. Mai 2020, PMID: 32376634; PMCID: PMC7260975
To KK, Tsang OT, Yip CC, Chan KH, Wu TC, Chan JM, Leung WS, Chik TS, Choi CY, Kandamby DH, Lung DC, Tam AR, Poon RW, Fung AY, Hung IF, Cheng VC, Chan JF, Yuen KY. Consistent Detection of 2019 Novel Coronavirus in Saliva. Clin Infect Dis 2020;71(15):841-843, doi: 10.1093/cid/ciaa149, PMID: 32047895, PMCID: PMC7108139
Yoon JG, Yoon J, Song JY, Yoon SY, Lim CS, Seong H, Noh JY, Cheong HJ, Kim WJ. Clinical Significance of a High SARS-CoV-2 Viral Load in the Saliva. J Korean Med Sci 2020;35(20):e195, doi: 10.3346/jkms.2020.35.e195, PMID: 32449329, PMCID: PMC7246183
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.