
- DAZ.online
- DAZ / AZ
- DAZ 32/2020
- Testen, testen, testen...
Pandemie Spezial
Testen, testen, testen – aber gezielt!
Wo wir in Sachen Corona-Testungen stehen – ein Update
Dass es nicht nur „den Corona-Test“ gibt, sondern verschiedene Arten für verschiedene Zwecke, dürfte mittlerweile allgemein bekannt sein. RT-PCR-Tests zum direkten Genomnachweis des Erregers werden derzeit als Goldstandard für die Diagnose von akuten SARS-CoV-2-Infektionen empfohlen. Antigentests weisen den Erreger ebenfalls direkt nach, und zwar über Proteine der Virushülle. Antikörper-Tests sind nicht für die Akutdiagnostik bestimmt. Sie zeigen aber durchgemachte, auch symptomlose Infektionen an und geben daher wichtige Hinweise zur Immunität und Durchseuchungsrate. So viel zum „Kleinen Einmaleins“ der Funktionsweise von Corona-Tests. Zu den technischen Varianten und deren Funktionsweise siehe DAZ 2020, Nr. 18, S. 42 – 47.
Wann ist welcher Test überhaupt sinnvoll?
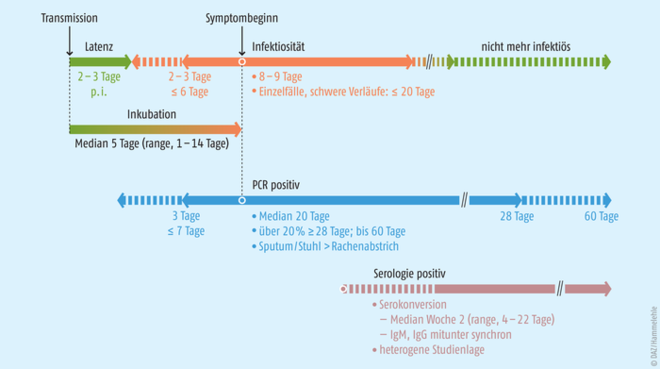
PCR-Tests gelten zwar als zuverlässig, aber falsch-negative Ergebnisse sind dennoch nicht ausgeschlossen. Auch bei Antikörper-Tests gibt es viele Imponderabilien. Da der zeitliche Verlauf der Kinetik und damit auch die Nachweisbarkeit nach einer SARS-CoV-2-Infektion je nach Antikörper variiert, ist der Zeitpunkt der Probenentnahme sehr wichtig für die Aussagekraft des Testergebnisses (Abb. 1). Überdies können Antikörper- ebenso wie Antigen-Tests mit anderen Pathogenen einschließlich anderer menschlicher Coronaviren kreuzreagieren und die meisten COVID-19-Antikörper-Tests messen nur Antikörper, die zwar an den Erreger binden, diesen aber nicht unbedingt neutralisieren. Aussagen über die Immunität sind also nur über zusätzliche Neutralisationstests möglich.
453 Anzeigen von SARS-CoV-2-Tests
Das Deutsche Institut für Medizinische Dokumentation und Information (DIMDI, jetzt BfArM Dienstsitz Köln) betreibt eine Datenbank für die Anzeigen sämtlicher In-vitro-Diagnostika (MPIVDA), die in Deutschland auf den Markt kommen dürfen. Als Auszug aus dieser Datenbank listet das „DIMDI“ in einer werktäglich aktualisierten Tabelle auf der BfArM-Webseite alle SARS-CoV-2-Tests, die bereits behördlich registriert sind. Am 24. Juli 2020 beinhaltete die Tabelle 453 Anzeigen von SARS-CoV-2-bezogenen Produkten, weitaus überwiegend Antikörper-Tests. Rund 75 Produkte wurden durch deutsche Hersteller angezeigt, die anderen durch deutsche Bevollmächtigte mit Herstellern im außereuropäischen Ausland, davon etwa 260 aus China, ca. 50 aus Korea, 32 aus den USA und Kanada und 37 aus anderen Ländern. Welche davon tatsächlich auf dem Markt sind, ist intransparent. Tests, die in einem anderen EU-Mitgliedstaat registriert sind und deshalb auch in Deutschland vermarktet werden dürfen, sind in der Datenbank nicht enthalten. Auf der Webseite der Foundation for Innovative New Diagnostics (FINDX.org) (www.finddx.org/covid-19/) findet sich alles, was weltweit in der Pipeline ist, was bereits vermarktet wird und wie es mit der Datenlage zu einzelnen Tests aussieht.
Cochrane-Review: Genauigkeit von Antikörper-Tests nicht belegt
Ein Team von Cochrane-Autoren um Jonathan J. Deeks von der Universität Birmingham hat die aktuelle Studienlage (bis zum 27. April 2020) zur Genauigkeit von SARS-CoV-2-Antikörper-Tests aufbereitet [1]. Unter Tausenden von Fundstellen fanden die Autoren 54 relevante Studien mit knapp 16.000 Proben. Die meisten Untersuchungen (n = 44) stammten von Krankenhauspatienten. Studien mit ausschließlich asymptomatischen Teilnehmern waren nicht verfügbar. Einbezogen wurden Studien mit 25 kommerziellen und zahlreichen In-House-Tests (enzymgebundene Immunosorbent-Assays [ELISA], Chemilumineszenz-Immunoassays [CLIA] und laterale Durchflusstests [LFIA]). Die Studien betrachteten drei Arten von Antikörpern, IgA, IgG und IgM. Die meisten Tests maßen sowohl IgG als auch IgM, andere nur einen der drei Antikörper oder eine Kombination aller drei.
Die gepoolten Ergebnisse für IgG, IgM, IgA, Gesamtantikörper und IgG/IgM zeigten in der ersten Woche nach Beginn der Symptome nur eine geringe Empfindlichkeit, die in der zweiten Woche anstieg und ihre höchsten Werte in der dritten Woche erreichte. Die Kombination von IgG/IgM hatte in der ersten Woche nach Symptombeginn eine Sensitivität von 30,1 Prozent, in der zweiten Woche von 72,2 und in der dritten Woche von 91,4 Prozent. Das Timing der Probenahme ist demnach absolut entscheidend, um eine überstandene Infektion sicher festzustellen. Die zusammenfassenden Spezifitäten (in 35 Studien) überstiegen für alle Zielantikörper 98 Prozent.
Seit wenigen Tagen steht im Terminal Tango am Flughafen Hamburg ein Corona-Testzentrum für Reiserückkehrer bereit.
Wie viele falsch negativ oder falsch positiv?
Unter der Annahme einer Infektionsprävalenz von 50 Prozent (angenommen für Beschäftigte im Gesundheitswesen mit Atemwegssymptomen) gehen die Autoren davon aus, dass von 1000 Personen, die sich in der dritten Woche nach dem Symptom-Beginn IgG/IgM-Tests unterziehen, 43 falsch negativ und sieben falsch positiv wären. Bei einer Prävalenz von 20 Prozent (Hochrisikoumgebungen) wären von 1000 getesteten Personen 17 falsch negativ und zehn falsch positiv. Bei einer niedrigeren Prävalenz von 5 Prozent (wahrscheinlich für nationale Erhebungen) wären pro 1000 Getesteten vier falsch negativ und zwölf falsch positiv. Überzeugende Unterschiede bezüglich der Genauigkeit verschiedener Arten von Antikörper-Tests fanden die Cochrane-Autoren nicht. Die Forscher geben zu bedenken, dass die Studien im Allgemeinen klein waren und methodische Mängel hatten. Außerdem ließen sie keinen Rückschluss auf die Genauigkeit der Antikörper-Tests bei Menschen mit einem leichteren Erkrankungsverlauf oder ohne Symptome zu. Insgesamt sind sich die Cochrane-Reviewer angesichts der mageren Datenlage unsicher, ob Antikörper-Tests tatsächlich für Seroprävalenzerhebungen herhalten sollten, aus denen weitreichende Massnahmen für das öffentliche Gesundheitsmanagement abgeleitet werden.
EUnetHTA-Bericht: Immunität nicht sicher nachweisbar
Gestützt wird diese Einschätzung durch einen HTA-Bericht, den das europäische Netzwerk zur Gesundheitstechnologie-Bewertung (EUnetHTA) zu COVID-19-Antikörper-Tests vorgelegt hat [2]. Der Bericht, an dem als deutscher EUnetHTA-Partner auch das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) beteiligt war, kommt nach der Auswertung von 40 Studien zu dem Schluss, dass die Antikörper-Tests eine zurückliegende Infektion mit dem SARS-Corona-Virus 2 zwar nachweisen können, jedoch mit unzureichender Genauigkeit. Außerdem sei fraglich, ob ein positives Testergebnis wirklich anzeigen könne, dass eine Person immun sei und ob sie nicht weiterhin andere anstecken könne.
Welche Rolle spielt die Methode?
Zu ähnlichen Ergebnisse kommen weitere, zum Teil kleinere Reviews und Metaanalysen von Studien Zur Genauigkeit von COVID-19-Antikörper-Tests. Ein brasilianisches Wissenschaftlerteam evaluierte die Ergebnisse von 40 Studien (davon nur vier an ambulanten Patienten und nur zwei zu Point-of-Care-Tests) hinsichtlich der Sensitivität und Spezifität, stratifiziert nach der Methode der serologischen Tests (Enzym-linked Immunosorbent Assay [ELISA], Lateral Flow Immunoassay [LFIA], oder Chemiluminescent immunoassay [CLIA]) und Immunglobulin-Klasse (IgG, IgM oder beides) [3]. Die gepoolte Sensitivität der ELISAs, die IgG oder IgM maßen, betrug 84,3 Prozent, der LFIAs 66,0 Prozent und der CLIAs 97,8 Prozent. Die gepoolten Spezifitäten lagen zwischen 96,6 Prozent und 99,7 Prozent. Die Autoren kommen zu dem Ergebnis, dass die verfügbaren Beweise die weitere Verwendung serologischer Point-of-Care-Tests nicht stützen. Sie empfehlen eine Kombination von klinischen, molekularen und serologischen diagnostischen Verfahren, um eine ausreichende Empfindlichkeit und Spezifität zu erzielen.
Aktuelle Testzahlen und Testkapazitäten
Die bundesweiten SARS-CoV-2-Testzahlen werden wöchentlich am Robert Koch-Institut (RKI) zusammengeführt. Wie dem jüngsten Epidemiologischen Bulletin 30 des RKI vom 23. Juli 2020 zu entnehmen ist, wurden in Deutschland seit Beginn der Testungen bis einschließlich KW 29 etwas über 7,4 Millionen PCR-Labortests erfasst, von denen knapp 238.700 positiv waren (cave: Mehrfachtestungen). Die Testkapazitäten sollen ab der KW 30 bei knapp 177.700 Tests pro Tag liegen, woraus das RKI eine wöchentliche Testkapazität von etwa 1,18 Millionen PCR-Tests zum Nachweis von SARS-CoV-2 errechnet hat.
Deutschland „spitze“ bei den Testungen
Nach Angaben auf dem Portal „Statistica.com“ hatte Russland am 23. Juli 2020 mit rund 26 Millionen in Europa die meisten Coronavirus-Tests durchgeführt, gefolgt von Großbritannien mit 10,2 Millionen und Deutschland mit über 7,4 Millionen, wobei Deutschland für sein Testprogramm besonders gelobt wird, weil die Sterblichkeitsrate im Vergleich zu anderen Ländern relativ niedrig ist. Ein Positionspapier des Verbandes der Diagnostika-Hersteller (VDGH) mit dem Titel „Warum Deutschland bei der Testung auf das Coronavirus spitze ist“ nennt dafür vier wesentliche Erfolgsfaktoren: die leistungsstarke Industrie, effiziente Laborstrukturen, die Größe und Innovationsfreudigkeit im Diagnostika-Markt und die proaktive Gesundheitspolitik.
Auch eine aktuelle Studie des Wissenschaftlichen Instituts der PKV (WIP) führt den guten Stand Deutschlands in der Corona-Krise wesentlich auf die deutschen Teststrategien zurück. Durch die frühe Entwicklung der diagnostischen Tests auf Covid-19 konnte hierzulande bereits ab Mitte Februar routinemäßig auf die Infektion getestet werden. Außerdem hat es sich nach Meinung der WIP-Autoren in Deutschland als sehr vorteilhaft erwiesen, dass die Infizierten meistens ambulant getestet und zunächst auch ambulant behandelt wurden. In anderen Ländern wurde dagegen überwiegend in Krankenhäusern getestet, was die Infektionsgefahr für das medizinische Personal und andere Patienten vor Ort deutlich erhöht hat.
Studien mit Antikörper-Tests für zukünftige Strategien
Das klingt alles eher beruhigend, aber die Unsicherheit und die Angst vor neuen „Hotspots“ und „Superspreader-Events“ bleiben. Deshalb wird durch punktuelle Studien versucht, sich ein genaueres Bild der Lage und der Mechanismen des viralen „Spreadings“ zu verschaffen und die Ergebnisse, sofern möglich, zu extrapolieren.
Hierzu hat das Robert Koch-Institut drei epidemiologische Antikörper-Studien initiiert:
- In der serologischen Untersuchung an Blutspendern in Deutschland (SeBluCo) werden in Zusammenarbeit mit 13 Blutspendediensten über 20 Wochen alle 14 Tage jeweils ca. 5000 anonyme Restproben von Blutspenden aus 28 Regionen in ganz Deutschland auf Antikörper untersucht. Die Studie hat im Mai 2020 begonnen. Ein Zwischenbericht von ca. 12.000 Proben mit Stand Ende Juni 2020 liegt bereits vor [4]. Hiernach wiesen lediglich 1,3 Prozent der knapp 11.700 ausgewerteten Probanden spezifische Antikörper gegen SARS-CoV-2 auf.
- In der seroepidemiologischen Studie „Corona-Monitoring lokal“ sollen an vier besonders betroffenen Orten in Deutschland in repräsentativen Stichproben jeweils etwa 2000 Personen untersucht werden (www.rki.de/corona-monitoring-lokal). Am 19. Mai begannen die Tests in Kupferzell in Baden-Württemberg und am 23. Juni 2020 in der oberbayerischen Gemeinde Bad Feilnbach.
- Die dritte, bundesweite bevölkerungsrepräsentative seroepidemiologische Studie (Corona-Monitoring bundesweit) befindet sich derzeit in Planung.
Auf der Website des RKI finden sich darüber hinaus Übersichtstabellen zu weiteren derzeit laufenden oder geplanten seroepidemiologischen Studien in Deutschland, die sich auf die Allgemeinbevölkerung, ausgewählte Bevölkerungsgruppen und bestehende Kohortenstudien erstrecken. Rund fünfzig Studien sind bereits dort gelistet.
Nationale Teststrategie: „Testen, testen, testen – aber gezielt!“
Aktuell gibt es in Deutschland nach der Einschätzung der Labore keine Engpässe bei der Durchführung von PCR-Testungen auf das Coronavirus SARS-CoV-2. Trotzdem erachtet das Bundesministerium für Gesundheit ein zielgerichtetes Vorgehen bei den Testungen für essenziell. Nach der nationalen Teststrategie werden in Deutschland derzeit die folgenden Personengruppen nach bestimmten Vorgaben getestet:
- Symptomatische Personen sowie ärztlich begründete Verdachtsfälle,
- Kontaktpersonen bestätigter COVID-19-Fälle,
- Bewohner von Betreuungseinrichtungen und Patienten in Krankenhäusern sowie bei bestätigter SARS-CoV-2-Infektion auch Besucher,
- Personal in Krankenhäusern und stationären und ambulanten Pflegeeinrichtungen,
- Personen in Gemeinschaftseinrichtungen (z. B. Arztpraxen, Schulen, Kita, Asylbewerberheim, Notunterkunft, Justizvollzugsanstalt) bei Ausbrüchen,
- Teile bzw. die gesamte Bevölkerung (auch asymptomatische Personen) in Epidemie-Regionen.
Wer bezahlt die Tests?
Welche Tests nicht selbst bezahlt werden müssen, regelt eine spezielle Verordnung des Bundesministeriums für Gesundheit vom 8. Juni 2020, die rückwirkend zum 14. Mai 2020 in Kraft getreten ist [5]. Mit einer Änderungsverordnung vom 31. Juli 2020 wurde der Anwendungsbereich der Verordnung zum 1. August 2020 erweitert [6]. Nach der Verordnung haben auch asymptomatische sowohl GKV-Versicherte als auch Nicht-GKV-Versicherte unter bestimmten Bedingungen Anspruch auf kostenfreie Tests (Testungen von Kontaktpersonen, Personen im Rahmen der Bekämpfung von Ausbrüchen sowie zur Verhütung der Verbreitung des Coronavirus SARS-CoV-2, §§ 2 bis 4 der Verordnung).
Seit dem 1. August können alle aus dem Ausland einreisenden Personen sich nach Maßgabe der Verordnung bei ihrem Gesundheitsamt oder durch einen niedergelassenen Arzt (nicht nur beim Hausarzt) kostenlos testen lassen, wenn die Einreise nicht mehr als 72 Stunden zurückliegt. Für Reisende aus Ländern, die vom Robert Koch-Institut als Risikogebiete ausgewiesen sind, gilt die 72-Stunden-Beschränkung nicht. Antikörper-Tests werden vorerst nicht bezahlt.
Testungen bei Reisenden
Im Moment sind Corona-Testungen bei Reiserückkehrern ein großes Thema. Für Einreisende nach Deutschland, die sich zu einem beliebigen Zeitpunkt innerhalb der letzten 14 Tage in einem Risikogebiet (siehe: www.rki.de/covid-19-risikogebiete) aufgehalten haben, kann gemäß den jeweiligen Quarantäneverordnungen der Bundesländer eine Quarantänepflicht bestehen. Ausnahmen sind möglich, wenn ein Rückkehrer durch ein ärztliches Zeugnis nachweisen kann, dass er nicht infiziert ist (negatives PCR-Testergebnis). Der Test darf höchstens 48 Stunden vor der Einreise durchgeführt worden sein. Alternativ sind auch Tests nach der Einreise möglich. Derzeit werden für diesen Zweck auf deutschen Flughäfen vielerorts Corona-Testzentren eingerichtet. Mit einer weiteren Anordnung, die noch nicht in Kraft ist, soll darüber hinaus in Kürze eine Testpflicht für Einreisende aus Risikogebieten eingeführt werden.
Aber auch die Abreise in den Urlaub oder zu anderen Zwecken sollte derzeit nicht blind angetreten werden. Das Centrum für Reisemedizin CRM hat ein kostenloses Online-Tool, den „Corona-Einreise-Checker“, entwickelt, der aktuelle Informationen aus verschiedenen, zuverlässigen Quellen zu Einreise- und Quarantänebestimmungen in verschiedenen Ländern bündelt (crm.de/rc/corona/). Den Checker gibt es auch als App.
Splitter aus dem Corona-Test-Markt
Im Folgenden soll ein kleiner Einblick in neuere Entwicklungen auf dem Markt der Corona-Tests gegeben werden.
- Roche kann sowohl mit PCR-Tests als auch mit einem Antikörper-Test auf das neuartige Coronavirus aufwarten. Der CE-IVD markierte molekulare Cobas-SARS-CoV-2-Test, der seit dem 13. März weltweit verfügbar ist, läuft auf den vollautomatischen Roche-Systemen cobas 6800 oder cobas 8800. Diese liefern Ergebnisse für die ersten 96 Tests nach 3 drei Stunden. Zeiten für höhere Probenmengen hängen vom System ab. Der neue, ebenfalls laborbasierte Elecsys®-Anti-SARS-CoV-2-Antikörper-Test von Roche hat Ende April die CE-Kennzeichnung und Anfang Mai die FDA-Notfallzulassung (Emergency Use Authorization, EUA) erhalten. In Deutschland ist er seit Mitte Mai verfügbar. Der Test kann auf den weltweit verbreitet und in Deutschland flächendeckend installierten immunologischen Roche-Analysegeräten der Serie cobas e durchgeführt werden. Er soll eine Spezifität von 99,8% haben und keine Kreuzreaktivität auf eines der vier zirkulierenden humanpathogenen Coronaviren aufweisen.
- Das auf seltene Erkrankungen spezialisierte Gendiagnostik-Unternehmen Centogene mit Sitz in Rostock hat einen SARS-CoV-2-RT-PCR-Test zur Selbsttestung entwickelt. Besteller bekommen den Cento-Kit-19 nach Hause geschickt, nehmen den Rachenabstrich dort eigenständig vor. Der Test wird auch über Amazon vertrieben. Das Laborergebnis gibt es über das datensichere Corona-Portal des Unternehmens, und zwar innerhalb von zwölf bis 24 Stunden nach Probeneingang.
- Das Diagnostik-Unternehmen IFFMEDIC in Ahrensburg vertreibt seit Kurzem den neuen molekularen HG-COVID-19-Test, der von der Firma HiberGene Diagnostics (HG), Dublin/Irland, mit Fördermitteln der Europäischen Union entwickelt wurde und im Mai die CE-Zertifizierung erhalten hatte. Der Test nutzt ein firmeneigenes gefriergetrocknetes molekulares Reagenzienformat, das einfach zu handhaben sein soll, und ein kleines tragbares HG-Swift-Instrument. Bei Proben mit hoher bis mäßiger Viruslast soll die Detektion zuverlässig sein, wobei positive Ergebnisse im Durchschnitt innerhalb von 30 Minuten zu erwarten sind. Dies soll eine schnelle Diagnose der Krankheit im frühen und hochinfektiösen Stadium ermöglichen. Negative Befunde sollen innerhalb von 60 Minuten verfügbar sein.
- Das Mainzer Start-up Digital Diagnostics (digid) hat einen neuen Antigen-Schnelltest im „Westentaschenformat“ entwickelt, der das Virus in nur fünf Minuten per Mikrochip über ein elektrischen Signal mithilfe eines einfaches Lesegeräts (Sensor Hub) identifizieren soll. Durch die Anbindung an eine Datenbank sollen die Sensordaten zudem mit Geodaten verknüpft und für Großdatenanwendungen anonymisiert verarbeitet werden können. Dies könnte dabei helfen, regionale Hotspots zeitnah und präzise zu ermitteln. Bevor der Test in den Regelbetrieb gehen kann, muss er allerdings in klinischen Studien noch weiter geprüft werden. Eine Sonderzulassung beim Bundesinstitut für Arzneimittel und Medizinprodukte soll bereits beantragt worden sein.
- Das Freiburger Start-up SpinDiag geht mit der innovativen Rhonda-Diagnostik-Plattform zum Nachweis des SARS-CoV-2-Virus ins Rennen. Das „Mini-Labor“ wurde nach Unternehmensangaben speziell für den dezentralen Einsatz am Ort der Probenentnahme entwickelt. Das System basiert auf einem zweistufigen PCR-Verfahren. Ob eine Person mit dem Coronavirus infiziert ist oder nicht, soll sich innerhalb von 30 bis 40 Minuten bestimmen lassen können. Mit einer Marktzulassung in Deutschland und der EU rechnet SpinDiag im dritten Quartal 2020.
Gurgellösung als Probe
Pharmazeuten von der Universität Halle-Wittenberg haben mithilfe der Massenspektrometrie kleinste Mengen des Coronavirus SARS-CoV-2 in Gurgelproben nachgewiesen [7]. Das Verfahren misst die Peptide, die von dem Virus stammen und nicht das genetische Material. Die neue Methode könnte künftig als Ergänzung für bisher übliche Tests dienen. Aktuell kann der Test in circa 15 Minuten durchgeführt werden. Die Arbeitsgruppe versucht nun, die Analysezeiten weiter zu verkürzen.
Hunde erschnüffeln Coronavirus
Forscher von der Stiftung Tierärztliche Hochschule Hannover (TiHo) gehen zusammen mit der Bundeswehr einen ganz anderen Weg. Sie glauben, dass eigens hierfür ausgebildete Hunde das Coronavirus erschnüffeln können. Das scheint tatsächlich zu klappen, wie eine Studie mit acht spezialisierten Spürhunden der Bundeswehr (Schäferhunde, Spaniel, Retriever) gezeigt hat [8]. Nach gerade mal einer Woche Training konnten die Hunde anhand von rund 1000 Speichel- oder Tracheobronchialsekretproben infizierte und nicht infizierte Individuen mit einer durchschnittlichen Sensitivität von 83 Prozent und einer Spezifität von 96 Prozent unterscheiden. Die Forscher erklären das Phänomen damit, dass Hunde durch ihre feine Nase erkennen, wenn sich der menschliche Zellstoffwechsel aufgrund einer Krankheit im Körper verändert. Diese Zellen geben dann gewissermaßen einen anderen „Geruchscocktail“ als gesunde Zellen ab. Vorstellbar wären Einsätze der Hunde an Flughäfen, bei Sport- und anderen Großveranstaltungen sowie an Grenzen. Bis dahin ist es jedoch noch ein weiter Weg.
Fazit
In den letzten Wochen hat sich auf dem Gebiet der Corona-Testungen viel getan. Die Unsicherheit hinsichtlich des Nutzens von SARS-CoV-2-Antikörper-Tests für epidemiologische Erhebungen besteht jedoch weiter. Auch wenn es mit den Tests gelingen sollte, hochspezifische Antikörper gegen SARS-CoV-2 sicher nachzuweisen, bleibt unklar, welchen Wert diese Antikörper haben, das heißt, ob und wie lange sie eine Person tatsächlich vor einer Neuinfektion schützen können. Auch die nationalen und internationalen Zahlen zur epidemiologischen Lage, die im Wesentlichen auf den Testungen basieren, sollten nicht überinterpretiert werden. Die einzelnen Länder nutzen unterschiedliche Testprotokolle und Verfahren für die Auswertung der Ergebnisse. Diese Abweichungen haben wahrscheinlich erhebliche Auswirkungen auf die gemeldeten Statistiken, einschließlich Fall- und Testzahlen, Sterblichkeitsraten und Falldemografien. Auf jeden Fall ist davon auszugehen, dass in den meisten Ländern erheblich zu wenig getestet wird, um die tatsächliche Situation überhaupt abbilden zu können. Da nicht alle regelmäßig getestet werden können, kommt es auf die richtige Strategie an. |
Literatur
[1] Deeks JJ et al. Antibody tests for identification of current and past infection with SARS CoV 2. Cochrane Database of Systematic Reviews 2020, Issue 6. Art. No.: CD013652. doi:10.1002/14651858.CD013652
[2] EUnetHTA Joint Action 3 WP4. Rapid collaborative review on the current role of antibody tests for novel coronavirus SARS-CoV-2 in the management of the pandemic. Project ID: RCR OT 01. Version 1.2, 22 June 2020
[3] Lisboa Bastos M et al. Diagnostic accuracy of serological tests for covid-19: systematic review and meta-analysis. BMJ. 2020 Jul 1;370:m2516. doi:10.1136/bmj.m2516
[4] Robert Koch-Institut. Serologische Untersuchungen von Blutspenden auf Antikörper gegen SARS-CoV-2 – SeBluCo-Studie. Zwischenauswertung – Datenstand 30.6.2020. Epidemiologisches Bulletin 29, 2020, S. 14
[5] Bundesministerium für Gesundheit. Verordnung zum Anspruch auf bestimmte Testungen für den Nachweis des Vorliegens einer Infektion mit dem Coronavirus SARS-CoV-2 vom 8. Juni 2020. BAnz AT 09.06.2020 V1
[6] Bundesministerium für Gesundheit. Verordnung zur Änderung der Verordnung zum Anspruch auf bestimmte Testungen für den Nachweis des Vorliegens einer Infektion mit dem Coronavirus SARS-CoV-2 vom 31. Juli 2020. BAnz AT 31.07.2020 V1
[7] Christian Ihling C et al. Mass Spectrometric Identification of SARS-CoV-2 Proteins from Gargle Solution Samples of COVID-19 Patients. J Proteome Res. 2020, June 22, 2020. doi.org/10.1021/acs.jproteome.0c00280
[8] Jendrny P et al. Scent dog identification of samples from COVID-19 patients - a pilot study. BMC Infect Dis. 2020 Jul 23;20(1):536. doi:10.1186/s12879-020-05281-3
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.