
- DAZ.online
- DAZ / AZ
- DAZ 27/2011
- Neue Hoffnung bei entzü...
Schwerpunkt Nano
Neue Hoffnung bei entzündlicher Darmerkrankung
Die Entstehung und der Verlauf von chronisch entzündlichen Darmerkrankungen werden durch ein komplexes Zusammenspiel von genetischen und ökologischen Faktoren bestimmt. Die genaue Ätiologie der Erkrankung ist unbekannt. Nach neueren Forschungen wird aber davon ausgegangen, dass die natürliche Barrierefunktion der Darmschleimhaut geschwächt und gleichzeitig die Immunantwort auf Antigene der natürlichen Darmflora abnormal erhöht sind. Die Folge ist eine chronische Entzündung der betroffenen Darmabschnitte.
In der Gruppe der chronisch entzündlichen Darmerkrankungen sind vor allem Colitis ulcerosa und Morbus Crohn von Bedeutung. Bei ersterer sind die Schleimhäute von Mast- und Dickdarm betroffen. Die Entzündung verläuft kontinuierlich über den gesamten befallenen Darmabschnitt. Demgegenüber können bei Morbus Crohn der gesamte Gastrointestinaltrakt und auch submukosales Gewebe betroffen sein. Der Befall ist diskontinuierlich, das heißt entzündete wechseln sich mit symptomfreien Darmabschnitten ab [1].
Bei etwa 50% der von CED Betroffenen verläuft die Erkrankung chronisch aktiv oder chronisch rezidivierend [2]. Eine dauerhafte Heilung ist bislang nicht möglich, so dass häufig eine lebenslange medikamentöse Therapie notwendig ist. Deren Ziel ist die Remissionsinduktion bzw. -erhaltung sowie eine mukosale Abheilung. Eingesetzt werden antiinflammatorische und immunsuppressive Arzneistoffe, insbesondere 5-Aminosalicylate (5-ASA), Glucocorticoide, Zytostatika und TNFα-Antikörper [1].
Galenische Maßnahmen
Galenische Systeme für eine gezielte und topische Wirkstofffreisetzung bzw. -applikation haben sich in der Therapie der chronisch entzündlichen Darmerkrankungen bewährt [2]. Generell erhofft man sich von einer lokalen, topischen Therapie eine Erhöhung der Wirkstoffkonzentration am Entzündungsort sowie eine verringerte Absorption und damit eine verminderte systemische Toxizität. Insbesondere bei der Colitis ulcerosa sind oberflächliche Gewebeschichten des Darms entzündet, so dass eine rein topische Behandlung bei mildem bis moderatem Verlauf häufig effektiv und ausreichend ist.
Für die beiden häufig bei chronisch entzündlichen Darmerkrankungen eingesetzten Wirkstoffe Mesalazin und Budesonid stehen orale Fertigarzneimittel zur Verfügung, die eine verzögerte und eventuell verlängerte Freisetzung gewährleisten und so eine hohe Absorption im proximalen Dünndarm verhindern (siehe Tab. 1).
Tab. 1: Fertigarzneimittel mit retardierter Freisetzung zur Behandlung von CED | ||
Wirkstoff |
Applikationsform |
Beispiele für Fertigarzneimittel |
Mesalazin |
Retardgranulat |
Claversal®
, Pentasa®
Sachet/Xtend, Salofalk®
Granu-Stix®
|
Retardtabletten |
Mezavant®
, Pentasa®
, Salofalk®
|
|
Sulfasalazin |
Retardtabletten |
Azulfidine®
, Colo-Pleon®
|
Budesonid |
Retardkapseln |
Entocort®
|
Hartkapseln mit Retardgranulat |
Budenofalk®
|
|
Beide Wirkstoffe werden nach erfolgter Resorption überwiegend in der Leber zu pharmakologisch inaktiven (Mesalazin) bzw. schwächer wirksamen Metaboliten (Budesonid) umgewandelt. Mesalazin ist somit nur topisch wirksam [3, 4]. Bei Budesonid ermöglicht die topische Applikation eine erhebliche Reduzierung der Nebenwirkungen im Vergleich zu systemisch voll wirksamen Glucocorticoiden [5].
Eine topische Behandlung endständiger Darmabschnitte ist auch durch eine rektale Wirkstoffapplikation möglich. Hierfür stehen mesalazin- oder glucocorticoidhaltige Fertigarzneimittel in Form von Klysmen, Zäpfchen und Schäumen zur Verfügung (siehe Tab. 2).
Tab. 2: Rektal zu applizierende Fertigarzneimittel zur Behandlung von CED | ||
Wirkstoff |
Applikationsform |
Beispiele für Fertigarzneimittel |
Mesalazin |
Klysmen |
Claversal®
, Pentasa®
, Salofalk®
|
Rektalschaum |
Claversal®
, Salofalk®
|
|
Suppositorien |
Claversal®
, Pentasa®
, Salofalk®
|
|
Budesonid |
Rektalschaum |
Budenofalk®
|
Klysmen |
Entocort®
|
|
Betamethason |
Klysmen |
Betnesol®
|
Hydrocortisonacetat |
Rektalschaum |
Colifoam®
|
Nanomedikamente
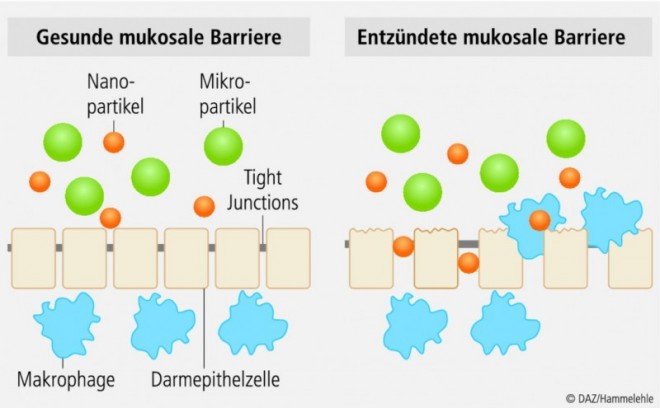
Unter Nanomedizin versteht man die Anwendung der Nanotechnologie bei der Vorhersage, Diagnose und Therapie von Krankheiten. Im Fall der CED können Nanopartikel als Träger für antientzündliche oder immunsuppressive Arzneistoffe helfen, die Effektivität der Behandlung zu steigern: Problematisch bei den konventionellen Therapien ist die Tatsache, dass nur ein Bruchteil des verabreichten Wirkstoffes den eigentlichen Wirkort im entzündeten Darmgewebe erreicht. Ein Großteil wird dagegen auch als Folge der Durchfallsymptomatik wieder ausgeschieden oder in die systemische Zirkulation aufgenommen und verursacht hier unerwünschte Nebenwirkungen. Nanomedikamente reichern sich gezielt im entzündeten Darmgewebe an und bilden somit ein Depot für den Arzneistoff am Ort der Entzündung. Der Arzneistoff kann dann lokalisiert und über einen längeren Zeitraum freigesetzt werden. Der genaue Mechanismus der Anreicherung ist noch nicht abschließend geklärt. Als mögliche Ursachen werden die verstärkte Aufnahme in eingewanderte Immunzellen, und die Einlagerung in Fehlstellen und Ulcerationen des Darmepithels diskutiert (s. Abb.)
Akkumulation im entzündeten Gewebe
Die Anreicherung im entzündeten Darmgewebe ist ein größenabhängiges Phänomen: kleinere Partikel von rund 100 nm Größe zeigten im Rattenmodell der Colitis die stärkste Anreicherung im Vergleich zu größeren Nano- oder Mikropartikeln, die kaum detektiert wurden [6]. Prof. Dr. Andreas Stallmach und Dr. Carsten Schmidt von der Universitätsklinik Jena untersuchen in Zusammenarbeit mit unserer Gruppe am Helmholtz-Institut für Pharmazeutische Forschung Saarland das Phänomen auch im Menschen genauer: mithilfe der konfokalen Laserscanning-Endoskopie bestimmen sie im Rektum von Patienten mit CED die Akkumulation fluoreszenzmarkierter, bioabbaubarer Nano- und Mikropartikel aus Polymilchsäure-co-glykolsäure (PLGA). Erste Ergebnisse lassen auch hier auf eine Partikelanreicherung in entzündeten und ulcerierten Darmabschnitten schließen.
In mehreren Tierstudien hat das passive Drug Targeting Prinzip seine Wirksamkeit bereits bewiesen. Bereits 2001 wurde der bisher nicht zur Therapie der entzündlichen Darmerkrankungen zugelassene Phosphodiesterase-4-Hemmer Rolipram getestet. Die Verkapselung in PLGA(Polylactid-co-Glycolid)-Nanopartikel und die lokalisierte Applikation des Wirkstoffs steigerte die Wirkdauer im Vergleich zur freien Arzneistofflösung und senkte gleichzeitig die zentralnervöse Nebenwirkungsrate des Arzneistoffs [7]. Anschließend wurde das Konzept erfolgreich auf etablierte CED Therapeutika wie Tacrolimus oder 5-ASA übertragen. Um die Arzneistofffreisetzung bei oraler Gabe auf das hintere Ileum und Kolon zu fokussieren, können die mit Arzneistoff beladenen Nanopartikel zusätzlich in größere Polymethacrylat Mikropartikel eingebettet werden [8]. Neben PLGA finden auch andere bioabbaubare Polymere Einsatz, wie Polycaprolacton, an das 5-ASA kovalent gebunden wurde [9]. Die Kopplung an das Polymer oder auch an die Oberfläche von Silica-Nanopartikeln verlangsamt die Freisetzung aus den Partikeln und erhöht somit den Depoteffekt [10].
Biologika in der Therapie der CED
In den letzten Jahren hat sich das Behandlungsspektrum für chronisch entzündliche Darmerkrankungen signifikant erweitert. Im Jahr 1999 wurde mit dem chimären TNFα-Antikörper Infliximab (Remicade®) erstmals ein Biologikum zur Therapie des schwergradigen, aktiven und fistulierenden Morbus Crohn zugelassen und die Zulassung in den Folgejahren auf die Erhaltungstherapie bei Morbus Crohn sowie auf Colitis ulcerosa ausgedehnt. Zudem befindet sich noch der vollständig humane Antikörper Adalimumab (Humira®) für die Therapie des schwergradig aktiven Morbus Crohn auf dem Markt. Mit Vedolizumab befindet sich ein weiterer Antikörper in der Entwicklung. Mehrere Biologika werden voraussichtlich in den kommenden Jahren folgen, darunter antientzündliche Zytokine wie das Interleukin 10.
Auch Ansätze zur Stilllegung von Schlüsselgenen der Entzündungskaskade zum Beispiel durch RNA-Interferenz oder Antisense Nukleotide werden im Zusammenhang mit chronisch entzündlichen Darmerkrankungen verfolgt. Hier stößt die pharmazeutische Forschung allerdings noch an ihre Grenzen: Nachdem in klinischen Phase III-Studien keine statistisch signifikanten Erfolge gezeigt werden konnten, wurde die weitere Entwicklung des intravenös applizierten ICAM-1 Antisense Inhibitors Alicaforsen gestoppt.
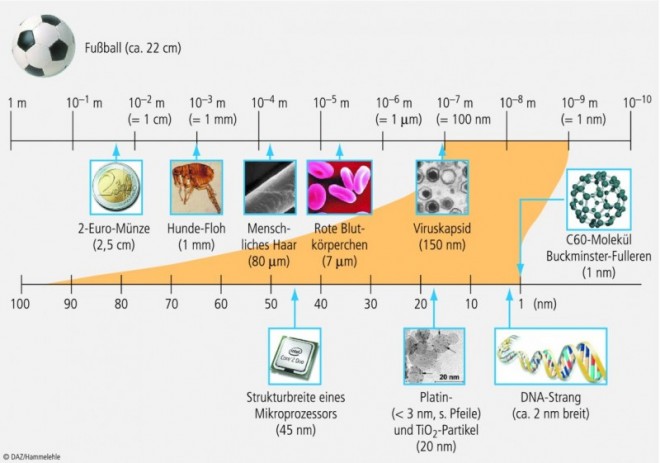
Was ist "nano"?
In Wissenschaft und Technik steht der Präfix "nano" (altgriechisch = Zwerg) für ein Milliardstel einer Einheit. Ein Nanometer (nm) ist der Millionste Teil eines Millimeters. Damit bewegen sich Nanostrukturen im Bereich von Atomen und Molekülen. Bei diesen winzigen Systemen treten neue Effekte auf und nanostrukturierte Materialien besitzen häufig andere Eigenschaften als "klassische" Materie, obwohl sie aus den gleichen chemischen Bausteinen bestehen. Beispielsweise haben Nanopartikel einen tieferen Schmelzpunkt, absorbieren Licht bei kürzerer Wellenlänge, weisen eine größere Oberfläche auf und besitzen andere Lösungseigenschaften. So kann mithilfe nanopartikulärer Formulierungen das Lösungsverhalten schwer löslicher Arzneistoffe erheblich verbessert werden. Aufgrund der kleinen Partikeldurchmesser zeigen Nanopartikel eine ausgeprägte Bioadhäsion. Daher haften pharmazeutische Nanopartikel auch ohne Polymerzusatz auf Schleimhäuten im Mund- und Nasenbereich, auf der Oberfläche des Augapfels oder auf der gastrointestinalen Mukosa. Das pharmazeutische Interesse an Nanopartikeln ist auch deshalb so groß, weil sie das Ziel "Drug-Targeting", eine systemisch verabreichte Arzneimitteltherapie zielgenau wirken zu lassen, ein Stück haben näher rücken lassen.
Zur Herstellung von Nanopartikeln gibt es verschiedene Verfahren. Das erste Patent zur Herstellung nanopartikulärer Arzneistoffzubereitungen wurde 1990 erteilt und beschreibt die Erzeugung von Nanosuspensionen in Kugel- oder Perlmühlen. In Abhängigkeit von den Materialeigenschaften und dem angestrebten Partikeldurchmesser kann der Mahlprozess zwischen einigen Stunden und mehreren Tagen dauern. Die mittels Perlmühlen hergestellten nanopartikulären Systeme werden oft als NanoCrystals® bezeichnet. Bei der Hochdruckhomogenisierung wird ein Arzneistoff in einer Tensidlösung dispergiert und mit hohen Drücken (bis zu 1500 bar) durch einen Kolben-Spalt-Homogenisator gepresst. Die dabei entstehenden Nanopartikel werden auch als DissoCubes® bezeichnet. Neben den abbauenden Verfahren in Mühle oder Homogenisator werden auch aufbauende Verfahren wie die Sprühtrocknung oder die Ausfällung aus organischen Lösungsmitteln zur Nanopartikel-Herstellung angewandt. Bei der Sprühtrocknung entstehen aber überwiegend Partikel mit einem mittleren Durchmesser von mehr als 1 µm, so dass nur der vergleichsweise geringe Feinanteil als Nanopartikel verwendet werden kann.
Nanomedizin – neue Lösungen für neue Probleme
Das Beispiel von Alicaforsen zeigt, dass auch die neuen Wirkstoffe Probleme mit der Bioverfügbarkeit am Wirkort haben, hauptsächlich ihrer kurzen biologischen Halbwertszeit bei subkutaner oder intravenöser Applikation geschuldet. Der Einschluss in Nanopartikel und der gezielte Transport zum Wirkort erlauben lokal hohe Wirkstoffkonzentrationen. Gleichzeitig erleichtert die Verpackung in Nanopartikel die Aufnahme von Gentherapeutika ins Zellinnere, den eigentlichen Wirkort. Neben der Anreicherung im Gewebe schützt die Verkapselung in Partikel die sehr empfindlichen Biologika vor dem enzymatischen oder hydrolytischen Abbau während der Passage durch den Magen-Darm-Trakt. Eine topische Applikation wird damit möglich und die Nebenwirkungsrate im Vergleich zur systemischen Applikation kann gesenkt werden: Unter der Behandlung mit TNFα-Antikörpern wie Infliximab wurde ein erhöhtes Infektionsrisiko beobachtet. Im Speziellen muss bisher vor der Behandlung auf Tuberkulose getestet werden, um das Wiederaufflammen einer latenten Infektion zu vermeiden.
Für einige Biologika wie das antientzündliche Tripeptid Lys-Pro-Val wurden Nanopartikel bereits erfolgreich für die orale Applikation eingesetzt [11]. Darunter waren mit TNFα stilllegender RNAi und mit IL 10 Plasmid-DNA auch Gentherapeutika, die, zusätzlich zur Verkapselung in Gelatinenanopartikel, in Mikrospheren eingebettet wurden [7, 12, 13]. Die Gelatinenanopartikel werden im Kolon aus den Mikropartikeln freigesetzt, reichern sich im entzündeten Gewebe an, werden in Immunzellen und Enterozyten aufgenommen und können dort ihre genregulatorische Wirkung entfalten.
Zusammenfassend haben nanopartikuläre Arzneistoffformulierungen für ein breites Spektrum an Wirkstoffen ihre verbesserte Wirksamkeit im Vergleich zu etablierten Darreichungsformen in der präklinischen Forschung bewiesen. Als nächsten Schritt müssen die neuen Nanomedikamente ihre Sicherheit und Wirksamkeit auch am Patienten zeigen. Die ersten klinischen Daten aus Jena stärken die Hoffnung auf eine erfolgreiche Übertragung der Untersuchungsergebnisse auf den Menschen. Dann kann die Nanotechnologie in Kombination mit neuen Behandlungsstrategien zur Genstilllegung und Immunregulation die Behandlung der CED weiter optimieren.
Quelle
[1] Herrlinger, K., B. Wittig, and E.F. Stange, Chronisch entzündliche Darmerkrankungen - Pathopyhsiologie und Therapie. Der Internist, 2009. 50: p. 1229-1246.
[2] Solberg, I.C., Clinical course in Crohnʼs disease: results of a Norwegian population-based ten-year follow-up study. Clinical gastroenterology and hepatology : the official clinical practice journal of the American Gastroenterological Association 2007(5): p. 1430-1438.
[3] Frieri, G., et al., Mucosal 5-aminosalicylic acid concentration inversely correlates with severity of colonic inflammation in patients with ulcerative colitis. Gut, 2000. 47: p. 410-414.
[4] Zhou, S.Y., et al., Intestinal metabolism and transport of 5-aminosalicylate. Drug metabolism and disposition: the biological fate of chemicals, 1999. 27: p. 479-485.
[5] Hanauer, S.B., New steroids for IBD: progress report. Gut, 2002. 51: p. 182-183.
[6] Lamprecht, A., U. Schafer, and C.M. Lehr, Size-dependent bioadhesion of micro- and nanoparticulate carriers to the inflamed colonic mucosa. Pharm Res, 2001. 18(6): p. 788-793.
[7] Bhavsar, M.D. and M.M. Amiji, Oral IL-10 gene delivery in a microsphere-based formulation for local transfection and therapeutic efficacy in inflammatory bowel disease. Gene Therapy, 2008. 15(17): p. 1200-1209.
[8] Lamprecht, A., et al., Nanoparticles enhance therapeutic efficiency by selectively increased local drug dose in experimental colitis in rats. Journal of Pharmacology and Experimental Therapeutics, 2005. 315(1): p. 196-202.
[9] Pertuit, D., et al., 5-amino salicylic acid bound nanoparticles for the therapy of inflammatory bowel disease. J Control Release, 2007. 123(3): p. 211-218.
[10] Moulari, B., et al., The targeting of surface modified silica nanoparticles to inflamed tissue in experimental colitis. Biomaterials, 2008. 29(34): p. 4554-4560.
[11] Laroui, H., et al., Drug-Loaded Nanoparticles Targeted to the Colon With Polysaccharide Hydrogel Reduce Colitis in a Mouse Model. Gastroenterology, 2010. 138(3): p. 843-853.e842.
[12] Kriegel, C. and M. Amiji, Oral TNF-α gene silencing using a polymeric microsphere-based delivery system for the treatment of inflammatory bowel disease. Journal of Controlled Release.
[13] Laroui, H., et al., Functional TNFα gene silencing mediated by polyethyleneimine/TNFα siRNA nanocomplexes in inflamed colon. Biomaterials, 2011. 32(4): p. 1218-1228.
Anschrift der Verfasser
Dr. Eva-Maria Collnot, Prof. Dr. Claus-Michael Lehr, Helmholtz Institut für Pharmazeutische Forschung Saarland (HIPS), Helmholtz Zentrum für Infektionsforschung (HZI), Universität des Saarlandes, Campus A4.1, 66123 Saarbrücken
Nico Alexander Mell, Biopharmazie und Pharmazeutische Technologie, Universität des Saarlandes, Campus A4.1, 66123 Saarbrücken




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.