
- DAZ.online
- DAZ / AZ
- DAZ 27/2011
- Nanomaterialien – in ...
Schwerpunkt Nano
Nanomaterialien – in aller Munde?
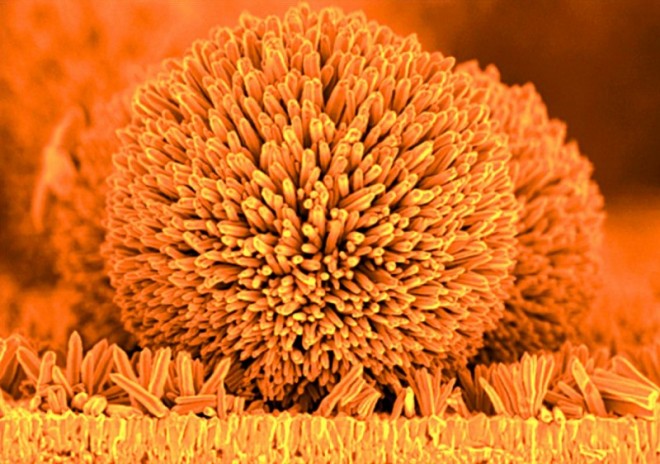
Während Experten mittlerweile von der zweiten Generation der Nanotechnologie reden, quasi einer Nanotechnologie 2.0, die gänzlich neue intelligente Produkte ermöglichen soll, sind es derzeit vor allem nanoskalige Partikel bzw. Oberflächenstrukturen, die beim Verbraucher für Nanotechnologie stehen [1]. Durch veränderte Herstellungs- und Analysemethoden ist die Produktion von Nanopartikeln (NP) einfach und schnell in großen Mengen möglich, so dass viele Produkte, die Nanopartikel enthalten, seit Jahren auf dem Markt vertreten sind. Zum Einsatz kommen unterschiedliche Materialien: Kohlenstoff, Titandioxid, Siliziumdioxid, Silber, Gold, Platin, Palladium, Zirkondioxid, Zinkoxid (s. Abb.), aber auch verschiedene Polymere und vieles mehr.
So unterschiedlich wie die Materialien sind auch ihre Anwendungsbereiche: Von Farben und Lacken über Kosmetika, Verpackungen, Textilien, Elektronik/Optik, Bautechnik, Umwelt- und Energietechnik, zivile und militärische Sicherheitstechnik bis hin zur Medizin und Pharmakologie. So sind in Sonnencremes nanoskaliges Titandioxid und/oder Zinkoxid enthalten, ohne die keine sehr hohen Lichtschutzfaktoren möglich wären. Sie schützen die Haut effektiver und schonender gegen schädliche UV-Strahlung als dies organische Substanzen tun.
Eine große Zukunft sagt man den Kohlenstoffnanoröhrchen (engl. carbon nanotubes, CNT) voraus. Ihre Eigenschaften (zehnfach höhere Zugfestigkeit im Vergleich zu Stahl; elektronisch isolierend, halbleitend oder metallisch) machen sie für viele Anwendungen attraktiv.
Weltmarkt Medizin
Neben Produkten des Alltags (Autoreifen, Kunststoffe, Oberflächenversiegelung) sind Nanomaterialien auch in medizinischen und pharmazeutischen Anwendungen vertreten [2]. Allein der US-amerikanische Markt für nanotechnologische Produkte im Gesundheitssektor soll bis 2021 auf 119 Milliarden US-Dollar anwachsen [3]. Die größten Treiber dieser Entwicklung sind dabei insbesondere die Anwendungsgebiete Wirkstofftransport (drug delivery), Biomaterialien für die Medizintechnik und Diagnostika. Bereits heute gibt es in diesem Bereich Nano-Produkte auf dem Markt (Liposomen, PEGylierte [4] Wirkstoffe oder Wirkstoff-Nanosuspensionen), ebenso sind nanostrukturierte Oberflächen auf bioaktiven Prothesen oder Stents verfügbar. Derzeit sind unterschiedlichste Drug-Delivery-Produkte erhältlich, beispielsweise zur Bekämpfung von Krebs, Pilzinfektionen, Hepatitis A und C, Diabetes, multipler Sklerose und kombinierten Immundefekten [3]. In der Pharmakologie schätzen Experten den Produktbenefit (geringere Dosierung, besserer Wirkstoffspiegel, bessere Compliance, geringere Nebenwirkungen) durch den Einsatz von Nanobiotechnologie auf 30 Prozent. In Zukunft soll durch den Einsatz gezielter Verfahren gar die perorale, nasale, pulmonale, intravenöse oder transdermale Applikation von Biopharmazeutika möglich sein [2, 3, 5, 6].
Eines der am meisten beforschten Gebiete erschließt ebenfalls durch Nanomaterialien neue Möglichkeiten: die Krebstherapie. Im Juni 2010 erhielt eine Krebstherapie auf Basis von Nano-Eisenpartikeln die Zulassung in der EU als Medizinprodukt zur Behandlung von Gehirntumoren. Diese Partikel werden direkt in den Tumor injiziert und anschließend wird ein Magnetfeld angelegt. Dabei entsteht Wärme, die die Tumorzellen abtötet. Die Selektivität wird durch die gezielte Aufnahme der magnetischen Partikel in Tumorzellen möglich [7 – 9]. Mit neuen Nanomaterialien könnte man somit einen gezielten Schlag gegen eine Krankheit führen, an der alleine in Deutschland im Jahr 2004 über 460.000 Menschen erkrankten [10].
Nanopartikuläre Kontrastmittel [11 bis 13] können zudem in Tumorgeweben angereichert werden und somit deren Erkennung und vollständige operative Entfernung verbessern.
Für die klinische Anwendung gilt es nun, vor allem das Langzeitverhalten und die toxikologischen Auswirkungen solcher neuer Materialien zu untersuchen.
Exposition und Aufnahmewege
Die bestehenden und in Zukunft zu erwartenden Anwendungen vor allem auch im medizinischen Bereich, eröffnen die Frage nach einer Exposition gegenüber diesen Materialien. Der Mensch ist sowohl am Arbeitsplatz bei der Produktion der Materialien selbst, aber auch bei der Herstellung von Verbraucherprodukten z. B. im Health-care-Bereich und selbstverständlich auch als Verbraucher diesen Produkten ausgesetzt. In diesen Fällen sind die möglichen Aufnahmewege offensichtlich: Inhalation, Verschlucken bzw. Exposition über die Haut. Weiterhin ist bei der medizinischen Nutzung auch eine Gabe direkt in die Blutbahn oder ein Gewebe (z. B. durch Injektion) denkbar. Damit sind aber bereits wichtige Voraussetzungen definiert. Die Betrachtung dieser Aufnahmewege speziell für Nanopartikel ist ein wichtiger Aspekt, die Sensitivität der betroffenen bzw. beteiligten Organe ein zweiter.
Die Haut, eine gute Schutzbarriere
Neben vielen weiteren Studien kam das große europäische Projekt Nanoderm zu dem Ergebnis, dass mineralische Nanopartikel (TiO2 und ZnO) nicht durch die Haut penetrieren können. Allerdings konnte auch mit einer sehr empfindlichen Methode gezeigt werden (radioaktiv markiertes Zink), dass Zinkionen nach Applikation mit einer Sonnenschutzcreme, die Zinkoxid enthält, im Körper gefunden werden konnten [14]. Grundsätzlich ist dies aber kein Problem, da die Haut und der Körper Zink benötigen und wir jeden Tag dieses Spurenelement aufnehmen müssen.
Der Magen-Darm-Trakt als Aufnahmepfad
Für diese mögliche Aufnahmequelle gibt es nur wenige Studien zu Nanopartikeln. Ob es daran liegt, dass nur wenig nachgewiesen werden kann und daher die Zahl der Publikationen klein ist, ist rein spekulativ, aber es gibt nur eine kleine Zahl an Hinweisen, dass synthetische Nanopartikel durch die Darmbarriere translozieren können [15 bis 18]. Rein pharmakologisch ist es aber sicher sehr interessant, inwieweit Nanopartikel die Darmbarriere einfacher überschreiten können, da dies für die Verabreichung von Medikamenten von großer Bedeutung wäre [19] (mehr Informationen zu diesen beiden Barrieren siehe auch die Beiträge auf S. 60 und auf S. 64).
Die Lunge – empfindliches Organ für Partikel
Seit der Debatte um Feinstaub und natürlich um das Rauchen, aber auch durch die Lungenerkrankungen im Bergbau oder an anderen staubbelasteten Arbeitsplätzen ist klar, dass eine Belastung der Lunge mit unterschiedlichen Partikeln zu möglicherweise schwerwiegenden gesundheitlichen Folgen führen kann [20 bis 23]. Daher wurden auch sehr viele Studien im Zusammenhang mit synthetischen Nanopartikeln und ihren Auswirkungen auf die Lunge durchgeführt [24, 25].
Verteilung im Organismus: Beispiel Plazentaschranke
Neben den Gewebsbarrieren, die oben diskutiert wurden, spielen auch biologische Barrieren in unserem Körper eine wichtige Rolle. Sind die ersten Barrieren überschritten, werden die Nanopartikel mit dem Blut im Körper verteilt und können die inneren Organe erreichen. Auch wenn dies z. B. in der Lunge über die Luft-Blut-Schranke nur sehr kleine Mengen sind [26], so werden gerade im medizinischen Bereich die inneren Barrieren sehr wichtig. Während die Blut-Hirn-Schranke im Beitrag auf S. 68 besprochen wird, soll an dieser Stelle auf eine andere sehr wichtige innere Barriere und ihre Bedeutung eingegangen werden, die Plazentaschranke.
In Tierversuchen konnte gezeigt werden, dass sowohl inhalierte wie ins Blut injizierte synthetische Nanopartikel die Plazentaschranke überwinden können und einen Effekt auf die Nachkommen zeigten. Die Auswirkungen sind abhängig von den physikalisch-chemischen Eigenschaften und der Menge der verabreichten Nanopartikel. Diese Ergebnisse können aber nicht auf den Menschen übertragen werden, da die Anatomie der Plazenta zwischen Versuchstier und Mensch sehr unterschiedlich ist [27]. Demzufolge muss die Translokationsrate von Xenobiotika oder Nanopartikeln durch die Plazenta für den Menschen neu bestimmt werden. Eine direkte Untersuchung an schwangeren Frauen ist schon allein aus ethischen Gründen nicht machbar. Daher ist man in diesem Gebiet ausschließlich auf alternative Modelle angewiesen [zum Überblick siehe 27 bis 29].
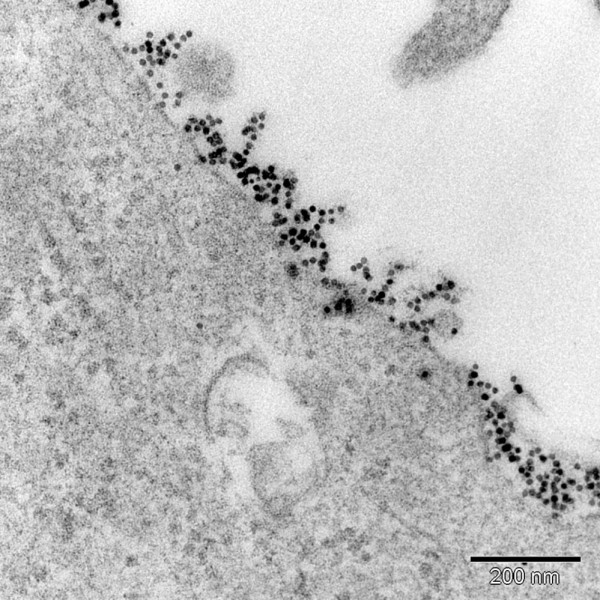
Das humane Plazentaperfusionsmodell, welches in den späten 60er Jahren von Panigel und Schneider [30, 31] entwickelt wurde, liefert klinisch und physiologisch die relevantesten Daten, da es sich um ein menschliches Ex-vivo-Organsystem handelt. So ermöglicht dieses Modell die Bestimmung der Transportrate von Nanopartikeln durch die menschliche Plazenta. Dazu werden die Gefäße der Plazenta gleich nach der Geburt des Kindes in der Apparatur an ein künstliches Kreislaufsystem angeschlossen, sodass der mütterliche wie der Kindskreislauf separat voneinander aufrechterhalten werden können. Durch Zugabe von Nanopartikeln zu einer Seite können die Übertrittsraten zur anderen Seite bestimmt werden. Eine aktuelle Studie in unserem Labor [32] konnte nachweisen, dass kleine Polystyrolpartikel (< 250 nm) durch die Gewebsbarriere hindurchpenetrieren, während größere (> 500 nm) nicht mehr hindurchgehen.
Histologische Untersuchungen der Plazenta nach dem Versuch ergaben keine sichtbaren Veränderungen des Gewebes nach der Perfusion. Ebenso waren weder die Vitalität noch die Funktionalität der Plazenta beeinträchtigt [32]. Mögliche Transportwege für Partikel könnten Diffusion, vesikulärer Transport, transmembrane Transportersysteme oder transtrophoblastische Kanäle sein. Eine andere Studie mit einem vergleichbaren Model kam zum Schluss, dass Polyethylenglykol-beschichtete Goldpartikel von 15 und 30 nm die Plazenta nicht durchdringen konnten [33]. Dies ist ein Hinweis, dass nicht nur die Größe, sondern auch die physikalisch-chemischen Eigenschaften der Nanopartikel die Transportraten entscheidend mit beeinflussen.
Wir sind überzeugt, dass das Plazentaperfusionsmodell einen wichtigen Beitrag in der Aufdeckung des Transportmechanismus liefern kann, welcher nicht nur für toxikologische Fragestellungen sehr wichtig ist. Die Beobachtung, dass Polystyrolpartikel keine akut toxische Reaktion im Plazentagewebe ausgelöst haben, eröffnet neue Perspektiven, wie durch die Nanotechnologie das Dilemma der Therapie von schwangeren Frauen, ohne den Fötus zu gefährden, in Zukunft gelöst werden könnte.
Nanosicherheit und Verbraucherschutz
Aus den oben gemachten Überlegungen wird deutlich, dass es eine intensive Diskussion zu den biologischen Wirkungen der Nanopartikel geben muss und auch schon gibt (siehe Webseiten Nanokommission; Nanodialog). In der Diskussion um die Sicherheit der Nanotechnologie wird im Allgemeinen auf die Exposition gegenüber Nanopartikeln verwiesen. Daher sind von verschiedenen Nicht-Regierungsorganisationen (NGOs) die Forderungen aufgestellt worden, Produkte, die solche synthetischen Nanopartikel enthalten, auch entsprechend zu kennzeichnen. Dies ist von der Europäischen Kommission für Kosmetika bereits aufgegriffen und umgesetzt worden. Ab dem 1. Januar 2012 müssen Kosmetika entsprechende Hinweise auf Nanopartikel enthalten, es bleibt aber offen, wie es mit weiteren Produktgruppen gehandhabt werden soll. Sollen z. B. Autoreifen, weil diese viel Industrieruß enthalten (Kohlenstoffnanoteilchen, sogenannter Carbon Black), ebenfalls gekennzeichnet werden? Die Frage der Definition, was alles unter diese Rubrik fällt, kann längst nicht beantwortet werden und wird sicher die verschiedenen Gremien der OECD, ISO und anderer Institutionen weiterhin beschäftigen.
DanksagungDie Autoren bedanken sich beim Bundesministerium für Bildung und Forschung für die finanzielle Unterstützung in den Projekten NanoCare (BMBF; FKZ 03X0021A) und DaNa (BMBF; FKZ 03X0075), H. F. Krug und P. Wick bedanken sich bei der Europäischen Union für die Unterstützung des Projektes Nanommune (FKZ 214281), sowie bei dem Förderprogramm CCMX und den Schweizer Bundesämtern für Umwelt und für Gesundheit für die Unterstützung des Projektes VIGO. |
Aktivitäten in Europa und der Welt
Neben den eben beschriebenen Aktivitäten werden weltweit Anstrengungen unternommen, ein mögliches gesundheitliches Risiko durch Nanopartikel zu erfassen. Im 6. und 7. Rahmenprogramm sind von der Europäischen Kommission viele Projekte zu diesem Thema gefördert worden und werden noch gefördert (siehe Webseite NanoSafetyCluster). Aber auch außerhalb Europas bzw. auf nationaler Ebene gibt es vergleichbare Prozesse der Evaluierung von Nanopartikeln in biologischen Systemen und der Umwelt (siehe Webseiten NNI, NanoTEC, NanoCare & NanoNature, NFP64, Aktionsplan). Wir selbst sind im Auftrag der Bundesregierung in Deutschland dabei, eine fortlaufend aktualisierte Wissensplattform zu erstellen, auf der sich jeder selbst über die verschiedenen Nanomaterialien informieren kann und wo man darüber hinaus auch Informationen zu Veranstaltungen, anderen Projekten und Neuigkeiten zum Thema finden kann. Das interdisziplinäre Projekt DaNa wird nachfolgend kurz vorgestellt.
Das Projekt DaNaDie Nanotechnologie gilt als Schlüsseltechnologie des 21. Jahrhunderts. Daher ist es wichtig, den Bedürfnissen möglicherweise Betroffener Rechnung zu tragen, aber auch dem interessierten Bürger, Journalisten oder Politiker eine Möglichkeit an die Hand zu geben, sich ausreichend über die möglichen negativen Folgen informieren zu können. Das interdisziplinäre Wissenschaftler-Team des Projekts DaNa möchte mit seiner Internetseite www.nanopartikel.info Transparenz schaffen. Aktuelle Forschungsergebnisse zu Nanomaterialien und deren Auswirkungen auf Menschen und die Umwelt werden so aufbereitet, dass sie für "Jedermann" verständlich sind. Das Projekt DaNa wird gefördert vom Bundesministerium für Bildung und Forschung und unterstützt durch das Bundesamt für Umwelt und das Bundesamt für Gesundheit der Schweiz. Projektpartner: DECHEMA e.V., Karlsruher Institut für Technologie (KIT), Eidgenössische Materialprüfungs- und Forschungsanstalt (Empa), Fraunhofer-Institut für keramische Technologien und Systeme (Fh IKTS), Helmholtz-Zentrum für Umweltforschung (UFZ), Unabhängiges Institut für Umweltfragen (UFU). Weitere Informationen lesen Sie auf: www.nanopartikel.info |
Quelle
[1] Nanotechnology Research Directions for Societal Needs in 2020, Retrospective and Outlook; Roco, Mihail C., Hersam, Mark C., Mirkin, Chad A., 1st Edition., 2011, Springer
[2] Riehemann, K., Schneider, S.W., Luger, T.A., Godin, B., Ferrari, M., Fuchs, H., 2009. Nanomedicine - challenge and perspectives. Angew. Chem. 121, 886-913.
[3] Nanotechnologie in der Medizin, Neue Perspektiven für die Life-Sciences-Industrie – Kurzfassung -, Ernst&Young, Mannheim, 2007.
[4] Veronese, F.M., Pasut, G., PEGylation, successful approach to drug delivery, Drug Discovery Today, 10, 21, 1451-1458
[5] Mozafari, M. Reza (Hrsg.): Nanocarrier Technologies. Frontiers of Nanotherapy. Springer. 2006.
[6] M. Simon et al. (2004) Bioconjugate Chem., 15(4), 841-849.
[7] Jordan, A.; Nanotechnologie – ein neues Konzept für Diagnostik und Therapie maligner Tumoren, Der Onkologe, 1073-1081, 7, 10, 2001
[8] Maier-Hauff K, Ulrich F, Nestler D, Niehoff H, Wust P, Thiesen B, Orawa H, Budach V, Jordan A. (2010) Efficacy and safety of intratumoral thermotherapy using magnetic iron-oxide nanoparticles combined with external beam radiotherapy on patients with recurrent glioblastoma multiforme. J. Neurooncol., Published online September 16, 2010 DOI 10.1007/s11060-010-0389-0.
[9] Jordan A, Maier-Hauff K, Wust P, Rau B, Johannsen M, Thermotherapie mit magnetischen Nanopartikeln, Der Onkologe 13: 894-902, 2007
[10] Krebs in Deutschland 2005/2006. Häufigkeiten und Trends. 7. Ausgabe. Robert Koch-Institut (Hrsg) und die Gesellschaft der epidemiologischen Krebsregister in Deutschland e. V. (Hrsg). Berlin, 2010
[11] Sunil Singhal, Shuming Nie and May D. Wang (2010) Nanotechnology Applications in Surgical Oncology. Annu. Rev. Med., 61, 359–373.
[12] Manus, L.M., Mastarone, D.J., Waters, E.A., Zhang, X.-Q., Schultz-Sikma, E.A., MacRenaris, K.W., Ho; D., Meade, T.J., Gd(III)-Nanodiamond Conjugates for MRI Contrast Enhancement. Nano Letters 2010 10 (2), 484-489
[13] Kobayashi, H., Brechbiel, M.W., Nano-sized MRI contrast agents with dendrimer cores, Advanced Drug Delivery Reviews, 57, 15, 2271-2286
[14] Gulson, B., McCall, M., Korsch, M., Gomez, L., Casey, P., Oytam, Y., Taylor, A., McCulloch, M., Trotter, J., Kinsley, L., and Greenoak, G. (2010). Small amounts of zinc from zinc oxide particles in sunscreens applied outdoors are absorbed through human skin. Toxicol Sci 118, 140-149
[15] Hillyer, J. F. and Albrecht, R. M. (2001). Gastrointestinal persorption and tissue distribution of differently sized colloidal gold nanoparticles. J.Pharm.Sci. 90, 1927-1936.
[16] Lomer, M. C., Thompson, R. P., and Powell, J. J. (2002). Fine and ultrafine particles of the diet: influence on the mucosal immune response and association with Crohn's disease. Proc.Nutr.Soc. 61, 123-130
[17] Powell, J. J., Faria, N., Thomas-McKay, E., and Pele, L. C. (2010). Origin and fate of dietary nanoparticles and microparticles in the gastrointestinal tract. J Autoimmun. 34, J226-J233
[18] Wang, J., Zhou, G., Chen, C., Yu, H., Wang, T., Ma, Y., Jia, G., Gao, Y., Li, B., Sun, J., Li, Y., Jiao, F., Zhao, Y., and Chai, Z. (2007). Acute toxicity and biodistribution of different sized titanium dioxide particles in mice after oral administration. Toxicol.Lett. 168, 176-185
[19] Lamprecht, A., Ubrich, N., Yamamoto, H., Schafer, U., Takeuchi, H., Maincent, P., Kawashima, Y., and Lehr, C. M. (2001). Biodegradable nanoparticles for targeted drug delivery in treatment of inflammatory bowel disease. J.Pharmacol.Exp.Ther. 299, 775-781
[20] Borm, P. J. (2002). Particle toxicology: from coal mining to nanotechnology. Inhal.Toxicol. 14, 311-324
[21] Cohen, A. J. and Pope, C. A., III (1995). Lung cancer and air pollution. Environ.Health Perspect. 103 Suppl 8, 219-224.
[22] Oberdörster, G. (2000). Toxicology of ultrafine particles: in vivo studies. Philos.Trans.R.Soc.Lond.Ser.A-Math.Phys.Eng.Sci. 358, 2719-2739
[23] Oberdörster, G. (2001). Pulmonary effects of inhaled ultrafine particles. Int.Arch.Occup.Environ.Health 74, 1-8
[24] Fleischer, T. and Krug, H. F. (2009). Risikopotenzial von Nanomaterialien. Arzneimittel-, Therapie-Kritik & Medizin und Umwelt 41, 185-194
[25] Krug, H. F. (2008). Nanotechnologie - Zwerge erobern den Alltag. Chemie Ingenieur Technik 80, 1653-1660
[26] Kreyling, W.G., Semmler-Behnke, M., Seitz, J., Scymczak, W., Wenk, A., Mayer, P., Takenaka, S., Oberdorster, G., 2009. Size dependence of the translocation of inhaled iridium and carbon nanoparticle aggregates from the lung of rats to the blood and secondary target organs. Inhal Toxicol 21 Suppl 1, 55-60
[27] Enders, A.C., Blankenship, T.N., 1999. Comparative placental structure. Adv Drug Deliv Rev 38, 3-15
[28] Prouillac, C., Lecoeur, S., 2010. The role of the placenta in fetal exposure to xenobiotics: importance of membrane transporters and human models for transfer studies. Drug Metab Dispos 38, 1623-1635
[29] Saunders, M., 2009. Transplacental transport of nanomaterials. Wiley Interdiscip Rev Nanomed Nanobiotechnol 1, 671-684
[30] Panigel, M., Pascaud, M., Brun, J.L., 1967. [Radioangiographic study of circulation in the villi and intervillous space of isolated human placental cotyledon kept viable by perfusion]. J Physiol (Paris) 59, 277
[31] Schneider, H., Panigel, M., Dancis, J., 1972. Transfer across the perfused human placenta of antipyrine, sodium and leucine. Am J Obstet Gynecol 114, 822-828
[32] Wick, P., Malek, A., Manser, P., Meili, D., Maeder-Althaus, X., Diener, L., Diener, P.A., Zisch, A., Krug, H.F., von Mandach, U., 2010. Barrier capacity of human placenta for nanosized materials. Environ Health Perspect 118, 432-436
[33] Myllynen, P.K., Loughran, M.J., Howard, C.V., Sormunen, R., Walsh, A.A., Vahakangas, K.H., 2008. Kinetics of gold nanoparticles in the human placenta. Reprod Toxicol 26, 130-137
[34] Chu, M., Wu, Q., Yang, H., Yuan, R., Hou, S., Yang, Y., Zou, Y., Xu, S., Xu, K., Ji, A., Sheng, L., 2010. Transfer of quantum dots from pregnant mice to pups across the placental barrier. Small 6, 670-678.
[35] Yoshida, S., Hiyoshi, K., Oshio, S., Takano, H., Takeda, K., Ichinose, T., 2010. Effects of fetal exposure to carbon nanoparticles on reproductive function in male offspring. Fertil Steril 93, 1695-1699.
[36] Hougaard, K., Jackson, P., Jensen, K., Sloth, J., Loschner, K., Larsen, E., Birkedal, R., Vibenholt, A., Boisen, A.-M., Wallin, H., Vogel, U., 2010. Effects of prenatal exposure to surface-coated nanosized titanium dioxide (UV-Titan). A study in mice. Particle and Fibre Toxicology 7, 16.
Verfasser
Harald F. Krug und Peter Wick, Eidgenössische Materialprüfungs- und Forschungsanstalt Empa, St. Gallen, Schweiz
Björn Mathes, Dechema e.V., Frankfurt
Katja Nau, Karlsruher Institut für Technologie (KIT), Karlsruhe
Korrespondenzanschrift:
Prof. Dr. Harald F. Krug, Swiss Federal Laboratories for Materials Science and Technology, Head of Department Materials Meet Life, Lerchenfeldstraße 5, CH-9014 St. Gallen





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.