
- DAZ.online
- DAZ / AZ
- DAZ 27/2011
- Mit Nanopartikeln in die ...
Schwerpunkt Nano
Mit Nanopartikeln in die Haut? Mehr als nur Kosmetik!
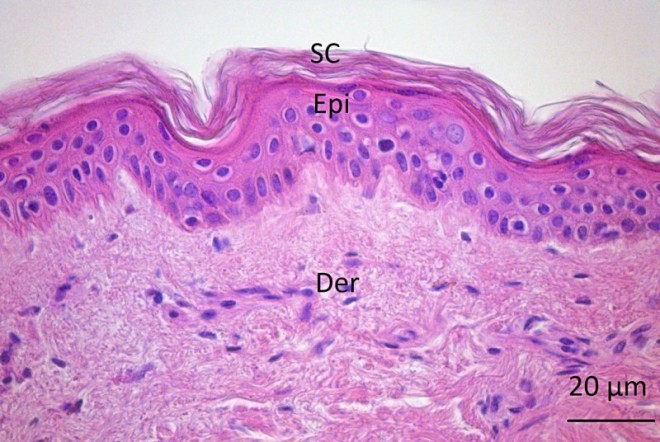
Die Haut steht über eine Fläche von etwa 2 m² im ständigen Kontakt mit der Umwelt. Neben einer bloßen mechanischen Barrierefunktion ist sie an der Regelung einer Reihe physiologischer Prozesse beteiligt wie der Wasserhomöostase oder der Körpertemperatur. In den lebenden Hautschichten sowie rund um die Haarfollikelöffnungen sorgt außerdem eine Vielzahl immunkompetenter Zellen dafür, dass im Fall einer Hautverletzung Krankheitserreger sofort effizient abgewehrt werden. Weiterhin befinden sich insbesondere im Bereich der Basalmembran an der Grenze zwischen Oberhaut (Epidermis) und Lederhaut (Dermis) spezialisierte Zellen, wie die Melanozyten und die Merkelzellen. Letztere spielen eine Rolle in der Schmerzempfindung. Das Pigment Melanin ist verantwortlich für die Färbung von Haut, Augen und Haaren. Es absorbiert UV-Strahlung, wodurch seine eigene Bildung angeregt wird und die Haut gebräunt erscheint. Bis zu einem gewissen Grad kann dadurch die Bildung von gefährlichen freien Radikalen verhindert werden, die die Haut vorzeitig altern lassen und Hautkrebs auslösen können.
In der Basalmembran bilden Stammzellen ständig neue Keratinozyten, die durch die Epidermis zur Hautoberfläche wandern. Währenddessen differenzieren sie sich aus bis sie schließlich absterben, verhornen und von der Oberfläche abschilfern. Der Erneuerungszyklus der Epidermis beträgt etwa 28 Tage und folgt damit dem gleichen Rhythmus wie andere physiologische Prozesse wie zum Beispiel die weibliche Menstruation.
Eine gesunde Haut bildet eine effektive Barriere
Die Hornhaut hat je nach Körperregion eine Dicke von durchschnittlich nur 10 bis 20 µm, stellt aber nichtsdestotrotz die wichtigste mechanische Barriere sowohl gegen das Eindringen von Mikroorganismen oder anderen Stoffen aus der Umwelt wie auch gegen den Verlust von Wasser dar. Dies wird ermöglicht durch die besonders effektive dichte Anordnung der verhornten, abgeplatteten Zellen (Korneozyten), die vollständig von Lipidschichten umgeben sind, sowie durch die einzigartige Zusammensetzung dieser Lipidschichten. Besondere, langkettige Lipide, die Ceramide, sorgen für eine hohe Kristallinität und Lipophilie sowie eine geringe Wasserbindungskapazität. Weiterhin fehlen Phospholipide, die zusammen mit Cholesterol die Hauptbestandteile von Lipiddoppelschichten von Membranen im Körper darstellen, völlig.
Eine wichtige Rolle für die intakte Barrierefunktion spielt außerdem die Hydratation. Der natürliche Wassergehalt der Haut beträgt etwa 30% (bezogen auf das Trockengewicht) und sorgt für Geschmeidigkeit. Als natürliche Wasserspeicher dienen die strukturgebenden Proteine der Korneozyten (Keratine) sowie natürliche Feuchthaltefaktoren, wie hauteigenes Glycerol, Milchsäure oder Harnstoff. Eine erniedrigte Hautfeuchtigkeit kann witterungs-, alters- oder krankheitsbedingt auftreten. Ein Großteil der Barrierefunktion bleibt erstaunlicherweise erhalten bis zu einem Wassergehalt von nur 10%. Auch eine starke Quellung der Haut hat Einfluss auf die Barrierefunktion. Die Wirkung kann zusätzlich durch oberflächenaktive Substanzen weiter verstärkt werden. Besonders schädlich haben sich Tenside mit einer Kettenlänge von zwölf C-Atomen erwiesen (z .B. Natriumlaurylsulfat, SDS). Auch der pH-Wert spielt dabei eine Rolle. Dies wird in vielen Hautpflegeprodukten wie auch pharmazeutisch verwendeten Dermatika umgesetzt, indem diese auf einen hautphysiologischen pH-Wert von 5,5 eingestellt werden und aggressive Tenside vermeiden oder nur in geringen Konzentrationen verwenden.
Geringes Spektrum dermal applizierter Substanzen
Die meisten Anwendungen beschränken sich auf eine Wirksamkeit auf der Hautoberfläche oder in den obersten Hautschichten. Hierzu zählen beispielsweise Repellenzien, Sonnenschutzmittel oder Antibiotika. Weitere häufige Anwendungen finden Substanzen wie Corticoide oder nichtsteroidale Antirheumatika, die in den tieferen Hautschichten oder in lokal angrenzenden Geweben, wie Muskeln oder Gelenken, wirken sollen. Nur eine sehr begrenzte Anzahl an Substanzen wird tatsächlich transdermal verabreicht (siehe Tabelle).
Wirkstoffe in transdermalen Pflastern. | ||
Indikationsgebiet |
Wirkstoffe |
Beispiele für Fertigarzneimittel |
opioide Analgetika |
Fentanyl, Buprenorphin |
Durogesic®
SMAT (Janssen-Cilag) Norspan® (Grünenthal) |
Mittel zur Suchtentwöhnung |
Nicotin |
Nicorette®
(McNeill, CH) |
Antiemetika |
Skopolamin |
Scopoderm TTS®
(Novartis Pharma) |
Hormone |
Estradiol,
Ethinylestradiol und Norelgestromin,
Estradiol und Norethisteronacetat,
Estradiolvalerat und Levonorgestrel,
Testosteron
|
Estradot®
(Novartis Pharma)
Evra®
(Janssen-Cilag)
Estalis®
(Novartis Pharma)
Cyclo-Progynova®
(Bayer Vital)
Intrinsa®
(Warner Chilcott)
|
Koronarmittel |
Gylceroltrinitrat |
Minitrans®
(Meda Pharma) |
Für eine Reihe weiterer Wirkstoffe befinden sich Systeme in der Entwicklung bzw. klinischen Prüfung, darunter Triptane zur Migränebehandlung, Rotigotin zur Parkinson-Therapie sowie einige Peptide (z. B. Insulin) [1 – 3]. Der Vorteil besteht in einer Umgehung des Magen-Darm-Traktes und damit eines möglichen First-pass-Effektes durch die Leber sowie der Erreichung konstanter Plasmaspiegel ähnlich wie bei einer Infusion. Allerdings beschränkt sich die Anwendung auf hochwirksame und dementsprechend niedrig dosierbare Wirkstoffe, die außerdem klein und mäßig lipophil sein müssen. Die Dosierung erfolgt in transdermalen Pflastern über die Applikationsfläche wobei die Invasionsrate über die Pflastermatrix oder eine freisetzungssteuernde Membran reguliert wird. Bis vor Kurzem waren außerdem Systeme verfügbar, bei denen die Freisetzungsrate iontophoretisch gesteuert wurde. So enthielt Ionsys® (Janssen-Cilag) Fentanyl zur nicht-invasiven patientenkontrollierten Schmerztherapie, wurde aber aufgrund technischer Probleme wieder vom Markt genommen.
Nano-Formulierungen machen es möglich
Im Gegensatz zu kleinen Molekülen, die über die Lipidschichten sowie durch die Hornzellen in die Haut eindringen, werden für Nano-Formulierungen andere Invasionswege diskutiert. Solide Nano- wie auch Mikropartikel lagern sich vor allem in kleinsten Hautfältchen und den Haarfollikelöffnungen ab. Sie dringen größenabhängig tief in die Haarfollikel ein und können dort so lange verbleiben bis sie durch Talgproduktion und Haarwachstum wieder entfernt werden [4]. Dadurch ergeben sich mehrere entscheidende Vorteile. Die Follikel sind nur unvollständig mit Hornhaut ausgekleidet. Besonders in den tiefen Bereichen ist es daher einfacher für aus den Partikeln freigesetzte Wirkstoffe in die Haut einzudringen (ein Vorliegen im Haarfollikel wird im Allgemeinen noch nicht als ein Eindringen in die Haut betrachtet). Durch die langsame Entleerung der Follikel bildet sich außerdem ein Wirkstoffdepot, das für länger anhaltende Wirkstoffspiegel in der Haut sorgen kann. Lange wurde der follikuläre Transport aufgrund des geringen Flächenanteils der Haare vernachlässigt. Neuere Studien haben aber gezeigt, dass die follikuläre Kapazität in der Größenordnung der Lipidkanäle liegt [5].
Weitere Möglichkeiten ergeben sich durch die Verwendung ultraflexibler Nano-Formulierungen. Dies sind insbesondere Liposomen, also Partikel, die aus Lipiddoppelschichten aufgebaut sind. Liposomen sind den Biomembranen nachempfunden und bestehen dementsprechend aus Phospholipiden und Cholesterol. Sie sind sowohl geeignet für lipophile Wirkstoffe, die in der lipophilen Liposomenwand im Bereich der Phospholipid-Seitenketten eingelagert werden, wie auch hydrophile Wirkstoffe, die sich im wässrigen Kern der Liposomen oder im Bereich der hydrophilen Kopfgruppen der Phospholipide aufhalten. Während Cholesterol die Lipiddoppelschichten stabilisiert, können Ethanol und oberflächenaktive Substanzen wie Gallensalze zugesetzt werden um hochflexible Liposomen herzustellen [6]. Dadurch entstehen ultra-verformbare Liposomen, die unbeschadet durch Poren (beispielsweise eines Filters aber auch die Lipidkanäle der Hornhaut) hindurch gelangen können, die um ein Vielfaches kleiner sind als ihr Durchmesser. So können eingeschlossene labile Wirkstoffe effektiv vor Abbau oder Wirkverlust geschützt werden.
Nano-Formulierungen in der Entwicklung
Die Entwicklung von NanoFormulierungen verspricht das Spektrum an transdermal verabreichbaren Wirkstoffen deutlich auszuweiten. Es kommen sehr unterschiedliche Systeme zum Einsatz. Am weitesten verbreitet sind Mikro- oder Nanoemulsionen sowie verschiedenste lipidbasierte Systeme (ultraflexible Liposomen, feste Lipidnanopartikel (solid lipid nanoparticles, SLNs), Nanostrukturierte Lipidpartikel). Ihre Einsatzgebiete können ebenso vielfältig sein wie die Partikel selbst. Ein großes Einsatzgebiet sind labile Moleküle wie Nukleinsäure-basierte Wirkstoffe, Proteine und Peptide, die durch die Verkapselung vor Abbau geschützt werden sollen. Des Weiteren soll die Aufnahme von Molekülen, die aufgrund ihrer Größe und Ladung schlecht hautgängigen sind, verbessert werden. Besonders interessant sind Systeme, die einen gezielten Transport zu bestimmten in der Haut liegenden Zielstrukturen ermöglichen. Dadurch lassen sich am Wirkort höhere Konzentrationen des Wirkstoffs erreichen, was es ermöglicht die Dosierung herabzusetzen. Gleichzeitig verringert sich die Gefahr von Nebenwirkungen.
Seit geraumer Zeit gibt es Bestrebungen, das immunologische Potenzial der Haut für Impfungen zu nutzen. Die meisten Impfungen werden derzeit immer noch intramuskulär appliziert, obwohl der Muskel im Gegensatz zur Haut nicht besonders immunologisch aktiv ist. Vor allem die für die Auslösung der Immunantwort notwendigen antigenpräsentierenden Zellen (z. B. dendritische Zellen, Makrophagen) liegen in der Epidermis um die Haarfollikel sowie in der Dermis in großer Zahl vor. Sogar die Keratinozyten selbst sind an der unspezifischen Immunantwort beteiligt und können als Antwort auf die Invasion von Antigenen proinflammatorische Zytokine ausschütten.
Die große Herausforderung ist auch hier die dichte Hornhautbarriere. Mit einer Reihe von chemischen, mechanischen oder elektrischen Methoden soll diese überwunden werden. Nah am Markt bzw. schon erhältlich sind Systeme, die den Impfstoff mittels besonders kurzer Nadeln nahezu schmerzfrei in die Haut bringen. Mit Intanza® (Sanofi-Pasteur) wurde 2009 der erste saisonale Grippeimpfstoff zur intradermalen Injektion zugelassen für den Einsatz bei Erwachsen mit einem Alter von mindestens 60 Jahren; insbesondere für Personen mit einem erhöhten Risiko für grippebedingte Komplikationen [7]. Diese Fertigspritze verwendet ein Mikroinjektionssystem (BD Soluvia™, Beckton Dickinson).
Wie sicher sind Nano-Formulierungen?
In einer vom Bundesministerium für Risikobewertung (BfR) 2007 erhobenen Studie versprechen sich 66% der Befragten von Nanotechnologie eher Nutzen als Risiken [8]. Diese Zahl zeigt aber auch, dass die Verunsicherung in der Bevölkerung hoch ist. Gerade im Bereich der Dermatika verwendet sehr wahrscheinlich eine breite Bevölkerung unbewusst seit Langem Nano-Formulierungen. Für die Anwendungsbereiche Lebensmittel und Kosmetik strebt das Europaparlament eine Erneuerung der seit 1. Juni 2007 gültigen Chemikalienverordnung REACH (Registration, Evaluation, Authorisation of Chemicals) an. Vor allem die Kennzeichnungspflicht gegenüber den Verbrauchern soll durch die Überarbeitung der Gesetze erreicht werden.
Nano- und Mikroemulsionen bestehen aus den gleichen Bestandteilen wie traditionelle Emulsionen (Lipide, Wasser, Tenside), wobei hier jedoch die Tröpfchengröße der inneren Phase im Bereich von nur 50 bis 100 nm liegt. Dadurch bedingt zeigen sie eine gute Fließfähigkeit, sie sind transparent und hinterlassen ein angenehmes Gefühl auf der Haut. Im Kontakt mit der Haut können auch Nano- und Mikroemulsionen wie traditionelle Emulsionen in ihre öligen und wässrigen Bestandteile aufbrechen. Es ist daher nicht anzunehmen, dass zusätzliche Risiken aufgrund der kleineren Tröpfchengröße auftreten. Das Gleiche gilt ebenso für Liposomen und andere lipidbasierte Systeme. Mineralische Nanopartikel aus Titandioxid oder Zinkoxid werden in Sonnenschutzmitteln eingesetzt. TiO2 streut UV-Licht besonders effektiv in einem Größenbereich von 60 bis 120 nm, bei ZnO liegt die optimale Größe bei 20 bis 30 nm. Da die Partikel in diesem optimierten Größenbereich nicht das sichtbare Licht streuen, bilden solche Sonnenschutzmittel keine unangenehmen weißen Filme auf der Haut [9].
In der Vergangenheit gab es Berichte, dass Nanopartikel tief in der Haut gefunden wurden. Das hat die Diskussion um die Sicherheit von Nanoformulierungen in Dermatika angeheizt. Im Nachhinein hat sich jedoch herausgestellt, dass vielfach das gewählte Hautmodell nicht geeignet war um die Fragestellung zu untersuchen. So wurden eine Reihe dieser Untersuchungen an der Haut von neugeborenen Schweinen durchgeführt, bei denen die Hautbarriere noch nicht vollständig ausgebildet war. Ebenso ungeeignet ist die Haut von Nagetieren, da sie wesentlich durchlässiger ist als menschliche Haut [9]. Derzeit lassen die Ergebnisse darauf schließen, dass ein Eindringen über die obersten Schichten der Hornhaut bei allgemein intakter Hautbarriere nicht zu erwarten ist. Es erscheint jedoch möglich, dass bei einer Vorschädigung wie durch Hautverletzungen oder ausgedehnten Sonnenbrand Partikel in die Haut eindringen können. Demgegenüber ist es unwahrscheinlich, dass ausgedehntes Schwimmen und entsprechend starke Quellung der Haut ausreichend ist um die Hautbarriere derart herabzusetzen.
Zusammenfassend lässt sich feststellen, dass unsere exzellente Hautbarriere sowie die Verwendung von sicheren Materialien keine Veranlassung zur Sorge vor einer Gefährdung durch Nanoformulierungen in Dermatika bietet.
Quelle
[1] Oertel WH, Benes H, Garcia-Borreguero D, Geisler P, Hogl B, Trenkwalder C, Tacken I, Schollmayer E, Kohnen R, Stiasny-Kolster K 2008. One year open-label safety and efficacy trial with rotigotine transdermal patch in moderate to severe idiopathic restless legs syndrome. Sleep Med 9(8):865-873.
[2] Pierce MW 2010. Transdermal delivery of sumatriptan for the treatment of acute migraine. Neurotherapeutics 7(2):159-163.
[3] King MJ, Badea I, Solomon J, Kumar P, Gaspar KJ, Foldvari M 2002. Transdermal delivery of insulin from a novel biphasic lipid system in diabetic rats. Diabetes Technol Ther 4(4):479-488.
[4] Patzelt A, Richter H, Knorr F, Schafer U, Lehr CM, Dahne L, Sterry W, Lademann J 2010. Selective follicular targeting by modification of the particle sizes. J Control Release.
[5] Otberg N, Richter H, Schaefer H, Blume-Peytavi U, Sterry W, Lademann J 2004. Variations of hair follicle size and distribution in different body sites. J Invest Dermatol 122(1):14-19.
[6] Geusens B, Van Gele M, Braat S, De Smedt SC, Stuart MCA, Prow TW, Sanchez W, Roberts MS, Sanders NN, Lambert J 2010. Flexible nanosomes (SECosomes) enable efficient siRNA delivery in cultured primary skin cells and in the viable epidermis of ex vivo human skin. Advanced Functional Materials 20(23):4077-4090.
[7] Atmar RL, Patel SM, Keitel WA 2010. Intanza®: a new intradermal vaccine for seasonal influenza. Expert Rev Vaccines 9(12):1399-1409.
[8] Lukowitz I. 2007. Verbraucher stehen der Entwicklung der Nanotechnologie überwiegend positiv gegenüber. ed., Berlin: Bundesinstitut für Risikobewertung (BfR)
[9] Nohynek GJ, Lademann J, Ribaud C, Roberts MS 2007. Grey Goo on the skin? Nanotechnology, cosmetic and sunscreen safety. Critical Reviews in Toxicology 37(3):251-277.
Anschrift der Verfasser
Dr. Steffi Hansen und Prof. Dr. Claus-Michael Lehr, Helmholtz Institut für Pharmazeutische Forschung Saarland (HIPS), Helmholtz Zentrum für Infektionsforschung (HZI), Universität des Saarlandes, Campus A4 1, 66123 Saarbrücken




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.