
- DAZ.online
- DAZ / AZ
- DAZ 27/2011
- Mit Nanopartikeln die ...
Schwerpunkt Nano
Mit Nanopartikeln die Blut-Hirn-Schranke überwinden
Die Therapie zentralnervöser Erkrankungen stellt trotz der starken Blutversorgung des Gehirns eine große Herausforderung dar. Eine effektive medikamentöse Behandlung von Erkrankungen wie der Alzheimer-Demenz, Gehirntumoren, des Parkinson-Syndroms oder von Meningitiden und Enzephalitiden ist vielfach nur unzureichend möglich. Auch bei intravenöser Gabe sind viele potenzielle Arzneistoffe nicht in der Lage, sich in therapeutischer Konzentration im Gehirn anzureichern. Verantwortlich für diesen Umstand sind physiologische Barrieren, die das zentrale Nervensystem vor dem Zutritt von Fremdstoffen schützen. Zu diesen Barrieren zählen die Blut-Hirn- und die Blut-Liquor-Schranke (BLS).
In zahlreichen Organen wie Leber oder Pankreas ist eine Verteilung von Arzneistoffen zwischen dem Plasmaraum und dem interstitiellen Bereich aufgrund eines fenestrierten Kapillaraufbaus in hohem Maße gegeben. In anderen Bereichen wie der Muskulatur erfolgt dieser Austausch eingeschränkt. Bei der Gefäßversorgung des Gehirns allerdings handelt es sich um ein Kapillarnetzwerk, das aufgrund seines strukturellen Aufbaus den Stoffaustausch zwischen Blut und umliegenden Gewebe weitgehend verhindert. Ein spezialisiertes System von Endothelzellen bildet eine lückenlose Auskleidung von Blutkapillaren. Diese Endothelzellen übernehmen einerseits eine Barrierefunktion für zahlreiche Fremdstoffe, ermöglichen aber andererseits auch eine gezielte Nährstoffversorgung des Gehirns. Entsprechend handelt es sich bei diesem System um eine semipermeable Barriere, die eine selektive Passage von Stoffen ermöglicht.
Physiologie der Blut-Hirn-Schranke
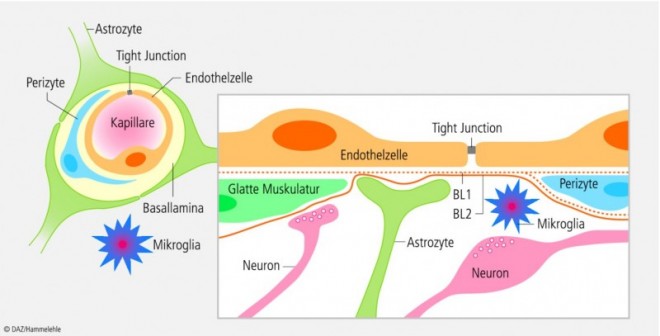
Physiologisch weist die Blut-Hirn-Schranke einen dreischichtigen Aufbau auf, mit einer inneren Endothelzellschicht, welche die Wand der Blutkapillaren ausbildet (Abb. 1). Die Endothelzellen weisen an ihren Berührungspunkten dichte Verbindungen, die sogenannten tight junctions (TJ), auf, welche gleichfalls einen parazellulären Transport von Stoffen aus dem Kapillarlumen in das umgebende Gewebe verhindern. Diese tight junctions stellen weiterhin die strukturelle Basis für den hohen transendothelialen Widerstand (TEER) an der Blut-Hirn-Schranke dar. Der dichte Aufbau führt zu Widerständen in der Größenordnung von 1500 Ωcm2 [1], während Endothelien in anderen Gewebebereichen Widerstände von unter 10 Ωcm2 zeigen [2]. Auf diese Endothelzellschichten der Blut-Hirn-Schranke aufgelagert befindet sich eine Basalmembran, die wiederum von Perizyten und Fortsätzen von Astrozyten bedeckt ist. Einen Überblick über die Forschung an der Blut-Hirn-Schranke bieten verschiedene Übersichtsarbeiten [3 – 5].
Permeabilität unter pathologischen Bedingungen
Unter physiologischen Bedingungen stellt die Blut-Hirn-Schranke eine dichte Barriere für eine Vielzahl von Fremdstoffen dar. Unter pathologischen Bedingungen hingegen können aus dem Gewebe Mediatoren wie Bradykinin, Histamin, Tumornekrosefaktor alpha (TNFα) oder weitere freigesetzt werden, welche die Permeabilität der Blut-Hirn-Schranke signifikant erhöhen. Zu diesen Erkrankungen mit erhöhter BHS-Permeabilität zählen Ischämien, Gehirntumoren, septische Enzephalopathien und weitere entzündliche Prozesse im Rahmen von HIV-Infektionen, multipler Sklerose oder der Alzheimer Demenz [3].
Paul Ehrlich und die Blut-Hirn-Schranke
Erste Untersuchungen zu der Barrierefunktion der Blut-Hirn-Schranke wurden bereits vor über 125 Jahren von Paul Ehrlich beschrieben [6]. Bei Untersuchungen an der Ratte fand er heraus, dass die Injektion von wasserlöslichen Farbstoffen wie Methylenblau zu einer Anfärbung der inneren Organe, aber nicht des Gehirns sowie des Rückenmarks führt. Edwin Goldmann, ein Schüler Paul Ehrlichs, führte später Kontrollexperimente durch, bei denen der Farbstoff in das Rückenmark der Tiere injiziert wurde und hierbei nur eine Anfärbung des zentralen Nervensystems beobachtet wurde [7]. Beide Experimente zusammen belegten die Existenz einer Barrierefunktion zwischen Zentralnervensystem und peripherer Zirkulation. Die Bezeichnung "Blut-Hirn-Schranke" wurde erstmals im Jahre 1900 von Max Lewandowsky eingeführt, der sich mit der Permeation von Kaliumferrocyanid an Gehirnkapillaren beschäftigte [8].
Drug Targeting an der Blut-Hirn-Schranke
Es ist daher ein lang gehegter Wunsch der Pharmaforschung, Transportsysteme zu entwickeln, die den Arzneistoff durch sogenanntes "Drug Targeting" gezielt zum Ort der Erkrankung bringen. Dabei sollen diese Systeme einerseits die Körperverteilung der an sie gebundenen Arzneistoffe beeinflussen aber auch andererseits dazu beitragen, Arzneistoffe über biologische Barrieren wie die Blut-Hirn-Schranke zu transportieren. Wiederum war es Paul Ehrlich, der bereits vor annähernd 100 Jahren den Begriff der "Zauberkugeln" prägte, inspiriert von einem Besuch der Oper "Der Freischütz". Gemeint waren damit noch zu findende Wirkstoffe, die eine selektive Erkennung und Zerstörung von Tumorzellen ermöglichen:
"(Der Stoff) würde in diesem Sinne genau den Immunprodukten des Organismus entsprechen, die ihrerseits nach Art von Zauberkugeln ihren Feind, die Parasiten, isoliert treffen. (...) Die Tumorzellen sind mithin, im Gegensatz zu dem Parasiten, nichts dem Körper Fremdartiges, sondern es handelt sich gewissermaßen um feindliche Brüder, und es ist deshalb a priori viel schwerer, spezifische Heilstoffe aufzufinden, die nur kranke Zellen treffen, ohne die gesunden zu schädigen (...)" [9].
Seit diesen ersten Überlegungen Ehrlichs wurden zahlreiche Anstrengungen unternommen, Trägersysteme zu entwickeln, die eine gezielte Anreicherung des an sie gebundenen Arzneistoffs in den gewünschten Zielstrukturen des Körpers ermöglichen.
Nanostrukturen transportieren Wirkstoffe
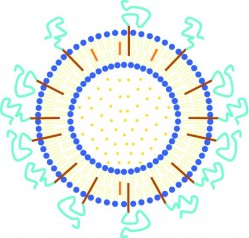
Ein vielversprechender Ansatz, einen verstärkten Transport von Arzneistoffen über biologische Barrieren wie die Blut-Hirn-Schranke zu erreichen, ist hierbei die Arzneistoffbindung an nanostrukturierte Trägersysteme. Zu diesen Trägersystemen zählen neben weiteren insbesondere kugelförmige Liposomen und Nanopartikel (Abb. 2). Aufgrund ihrer geringen Größe können wässrige Dispersionen dieser Strukturen parenteral appliziert werden. Eine hinreichend lange Zirkulationszeit im Zentralkompartiment Blut vorausgesetzt, kann mittels Nanoträgern eine gezielte Anreicherung des an sie gebundenen Wirkstoffs in Organen, Geweben oder erkrankten Körperstellen und damit ein "Drug Targeting" erreicht werden. Verändert man die Oberfläche der Nanostrukturen in geeigneter Weise, können sie biologische Barrieren überwinden und Arzneistoffe über diese Barrieren transportieren.
Transportsysteme an der Blut-Hirn-Schranke
Um den physiologischen Nährstoffbedarf des Gehirns zu decken, sind an der Blut-Hirn-Schranke Systeme vorhanden, die einen Stofftransport aus dem Blut in das Gehirn ermöglichen. Zu den transportierten Stoffen zählen Glucose, unterschiedliche Aminosäuren, Nucleoside aber auch hochmolekulare Substanzen wie Insulin, Antikörper, Transferrin oder modifizierte Lipoproteine wie LDL [5]. Einige dieser Transportsysteme können über Nanostrukturen adressiert und somit für die Überwindung der Blut-Hirn-Schranke genutzt werden. Andererseits weist die Blut-Hirn-Schranke in einem großen Maße Efflux-Transportsysteme wie P-Glykoproteine (P-gp) und Multi-Drug-Resistance (MDR)-Proteine sowie metabolische Enzyme auf, die darauf ausgelegt sind, den Transport von Fremdstoffen über die Blut-Hirn-Schranke zu verhindern.
Nanopartikel überwinden die Blut-Hirn-Schranke
Am Ende der 80er Jahre und zu Beginn der 90er Jahre des 20. Jahrhunderts wurden vielfältige Untersuchungen zur Verteilung von intravenös applizierten Nanopartikeln am Versuchstier durchgeführt [10 – 12]. Weiterhin wurde die Interaktion zwischen den Nanomaterialien und Zellsystemen bewertet. Hierbei wurde beobachtet, dass Nanopartikel, die mit dem Tensid Polysorbat 80 (Tween 80) beschichtet waren, im signifikanten Ausmaß von Kapillarendothelzellen aufgenommen werden [13]. Auf Basis dieser Beobachtung wurden nachfolgend erfolgreich zahlreiche Untersuchungen mit Arzneistoff-beladenen und mit Polysorbat beschichteten Nanopartikeln unter in-vivo-Bedingungen durchgeführt, die einen Transport des gebundenen Arzneistoffs über die Blut-Hirn-Schranke belegen [14 – 16]. Weitergehende Untersuchungen beschäftigten sich mit der mechanistischen Abklärung des beobachteten Transports über die Blut-Hirn-Schranke. Da beobachtet wurde, dass bei der Inkubation mit Blutplasma bevorzugt Apolipoproteine an die Oberfläche der beschichteten Nanopartikel angelagert wurden [17], wurde eine Interaktion dieses Proteins mit Transportsystemen an der Blut-Hirn-Schranke angenommen. Diese Annahme konnte durch spätere Versuche mit Nanopartikeln belegt werden, an deren Oberfläche kovalent Apolipoproteine gebunden waren [18, 19].
Transport von Makromolekülen an der BHS
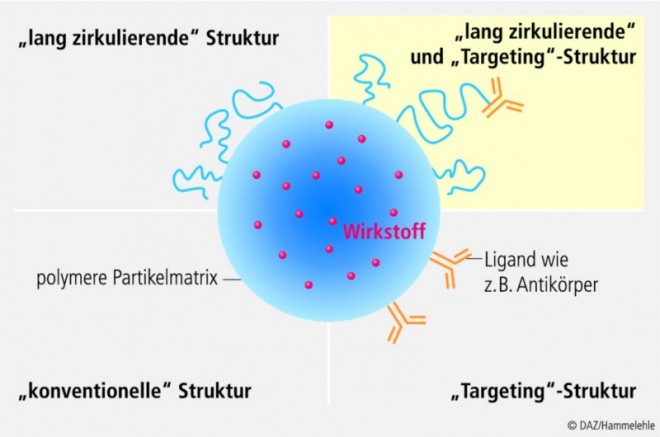
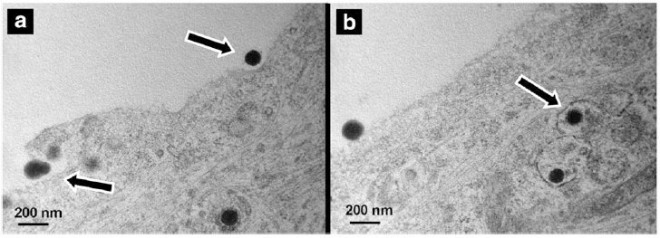
Ein Transport von großen Strukturen wie Makromolekülen über die Blut-Hirn-Schranke ist seit längerer Zeit bekannt [5]. Über den Prozess der Transzytose werden diese Moleküle in intakter Form in das Gehirn transportiert. An der Blut-Hirn-Schranke sind Transportsysteme für Transferrin, Apolipoprotein E, Lipoproteine, Immunglobuline, Insulin und weitere Substanzen identifiziert [5, 20]. Für die Entwicklung von nanostrukturierten Arzneistoffträgern ist es vielfach die Idee, Liganden dieser Transportsysteme auf die Oberfläche der Nanopartikel zu binden, um eine Passage der mit Arzneistoffen beladenen Partikel über die Blut-Hirn-Schranke zu ermöglichen (Abb. 3). Entsprechend finden sich in der Literatur zahlreiche Beispiele an kolloidalen Arzneistoffträgern wie Liposomen und Nanopartikeln, die diese Liganden gebunden aufweisen [18, 21 – 24]. Diese gezielt oberflächenmodifizierten Trägersysteme zeigten sich in der Lage, Arzneistoffe über den Mechanismus einer Rezeptor-vermittelten Transzytose effektiv über die Blut-Hirn-Schranke zu transportieren (Abb. 4).
Ein umfassender Überblick über die Entwicklung nanopartikulärer Trägersysteme zur Überwindung der Blut-Hirn-Schranke kann zahlreichen Übersichtsarbeiten entnommen werden [25 – 30].
Aufbau eines effektiven Partikelsystems
Nach aktuellem Kenntnisstand bestehen grundlegende Anforderungen an ein effektives Nanopartikelsystem zum Transport von Arzneistoffen über die Blut-Hirn-Schranke: Eine Partikelgröße im Bereich von etwa 100 nm in Kombination mit einer hydrophilen Oberfläche ermöglicht eine lange Plasmazirkulationszeit nach intravenöser Applikation [25]. Hydrophile Oberflächen können durch eine chemische Modifikation mit Polyethylenglykolen (PEG) erreicht werden [31]. Die Anbindung von Targeting-Liganden wie Peptide, Antikörper, Antikörper-Fragmente oder weitere Proteine gestattet eine Erkennung von Transportsystemen an der Blut-Hirn-Schranke und ermöglicht einen Übergang vom Blutstrom in das parenchymale Gewebe.
Ausblick
In den vergangenen Jahren wurden große Fortschritte bei der Entwicklung von kolloidalen Arzneistoffträgern zur Überwindung der Blut-Hirn-Schranke erzielt. Zahlreiche Zubereitungen zeigten sich in präklinischen Versuchen erfolgversprechend für eine nicht-invasive Therapie zentralnervöser Erkrankungen. Da erste kolloidale Zubereitungen wie Caelyx® (Doxorubicin-Hydrochlorid in einer polyethylenglykolisierten, liposomalen Formulierung) oder Abraxane® (Paclitaxel an Humanserumalbumin-Nanopartikel gebunden) sehr erfolgreich Zugang zur klinischen Anwendung gefunden haben, ist es zu erwarten, dass weitere nanotechnologische Präparate folgen werden. Neue Therapien zentralnervöser Erkrankungen rücken in greifbare Nähe.
Quelle
[1] Butt, A.M., H.C. Jones, and N.J. Abbott, Electrical resistance across the blood-brain barrier in anaesthetized rats: a developmental study. J. Physiol., 1990. 429: p. 47-62.
[2] Alam, M.I., et al., Strategy for effective brain drug delivery. Eur. J. Pharm. Sci., 2010. 40(5): p. 385-403.
[3] Ballabh, P., A. Braun, and M. Nedergaard, The blood-brain barrier: an overview: structure, regulation, and clinical implications. Neurobiol. Dis., 2004. 16(1): p. 1-13.
[4] Hawkins, B.T. and T.P. Davis, The blood-brain barrier/neurovascular unit in health and disease. Pharmacol. Rev., 2005. 57(2): p. 173-185.
[5] Abbott, N.J., et al., Structure and function of the blood-brain barrier. Neurobiol. Dis., 2010. 37(1): p. 13-25.
[6] Ehrlich, P., Das Sauerstoff-Bedürfniss des Organismus: eine farbanalytische Studie. Berlin: Hirschwald, 1885. 8: p. 1-167.
[7] Goldmann, E., Vitalfärbung am Zentralnervensystem. Beitrag zur Physio-Pathologie des Plexus chorioideus und der Hirnhäute. Abh. Königl. Preuss. Akad. Wiss. Berlin, 1913. 1: p. 1-61.
[8] Lewandowsky, M., Zur Lehre der Cerebrospinalflüssigkeit. Z. Klin. Med., 1900. 40: p. 480-494.
[9] Ehrlich, P., Chemotherapie. Soziale Kultur und Volkswohlfahrt während der ersten 25 Regierungsjahre Kaiser Wilhelm II, 1913: p. 345-356.
[10]Tröster, S.D., U. Müller, and J. Kreuter, Modification of the body distribution of poly(methyl methacrylate) nanoparticles in rats by coating with surfactants. Int. J. Pharm., 1990. 61: p. 85-100.
[11] Borchard, G. and J. Kreuter, The role of serum complement on the organ distribution of intravenously administered poly (methyl methacrylate) nanoparticles: effects of pre-coating with plasma and with serum complement. Pharm. Res., 1996. 13(7): p. 1055-1058.
[12] Borchard, G. and J. Kreuter, Interaction of serum components with poly(methylmethacrylate) nanoparticles and the resulting body distribution after intravenous injection in rats. J. Drug Target., 1993. 1(1): p. 15-19.
[13] Borchard, G., et al., Uptake of surfactant-coated poly(methyl methacrylate)-nanoparticles by bovine brain microvessel endothelial cell monolayer. Int. J. Pharm., 1994. 110: p. 29-35.
[14] Alyautdin, R., et al., Analgesic activity of the hexapeptide dalargin adsorbed on the surface of polysorbate 80-coated poly(butylcyanoacrylate) nanoparticles. Eur. J. Pharm. Biopharm., 1995. 41(1): p. 44-48.
[15]Kreuter, J., et al., Passage of peptides through the blood-brain barrier with colloidal polymer particles (nanoparticles). Brain Res., 1995. 674: p. 171-174.
[16] Alyautdin, R.N., et al., Delivery of loperamide across the blood-brain barrier with polysorbate 80-coated polybutylcyanoacrylate nanoparticles. Pharm. Res., 1997. 14(3): p. 325-328.
[17] Lück, M., et al., Identification of plasma proteins facilitated by enrichment on particulate surfaces: analysis by two-dimensional electrophoresis and N-terminal microsequencing. Electrophoresis, 1997. 18(15): p. 2961-2967.
[18] Michaelis, K., et al., Covalent linkage of apolipoprotein e to albumin nanoparticles strongly enhances drug transport into the brain. J. Pharmacol. Exp. Ther., 2006. 317(3): p. 1246-1253.
[19] Kreuter, J., et al., Covalent attachment of apolipoprotein A-I and apolipoprotein B-100 to albumin nanoparticles enables drug transport into the brain. J. Control. Release, 2007. 118(1): p. 54-58.
[20] Herz, J. and P. Marschang, Coaxing the LDL receptor family into the fold. Cell, 2003. 112(3): p. 289-292.
[21] Huwyler, J., D. Wu, and W.M. Pardridge, Brain drug delivery of small molecules using immunoliposomes. Proc. Natl. Acad. Sci. USA, 1996. 93(24): p. 14164-14169.[22] Shi, N. and W.M. Pardridge, Noninvasive gene targeting to the brain. Proc. Natl. Acad. Sci. USA, 2000. 97(13): p. 7567-7572.
[23] Zensi, A., et al., Human serum albumin nanoparticles modified with apolipoprotein A-I cross the blood-brain barrier and enter the rodent brain. J .Drug Target., 2010. 18(10): p. 842-848.
[24] Zensi, A., et al., Albumin nanoparticles targeted with Apo E enter the CNS by transcytosis and are delivered to neurones. J. Control. Release, 2009. 137(1): p. 78-86.
[25] Craparo, E.F., et al., Nanoparticulate Systems for Drug Delivery and Targeting to the Central Nervous System. CNS Neurosci. Ther., 2010.[26] Agarwal, A., et al., Nanoparticles as novel carrier for brain delivery: a review. Current Pharm. Des., 2009. 15(8): p. 917-925.
[27] Kreuter, J., Nanoparticles--a historical perspective. Int. J. Pharm., 2007. 331(1): p. 1-10.
[28] Olivier, J.C., Drug transport to brain with targeted nanoparticles. NeuroRx, 2005. 2(1): p. 108-119.
[29] Kreuter, J., Transport of drugs across the blood-brain barrier by nanoparticles. Curr. Med. Chem., 2002. 2: p. 241-249.
[30] Kreuter, J. and S. Gelperina, Use of nanoparticles for cerebral cancer. Tumori, 2008. 94(2): p. 271-277.
[31] Torchilin, V.P., Multifunctional nanocarriers. Adv. Drug Del. Rev., 2006. 58(14): p. 1532-1555.
Anschrift des Verfassers
Prof. Dr. Klaus Langer, Institut für Pharmazeutische Technologie und Biopharmazie
Westfälische Wilhelms-Universität Münster, Corrensstr. 1, 48149 Münster























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.