
- DAZ.online
- News
- Pharmazie
- Compassionate Use: Mehr ...
EMA erweitert Einsatz von Remdesivir
Compassionate Use: Mehr Coronapatienten erhalten Remdesivir
Stuttgart - 12.05.2020, 11:30 Uhr
Remdesivir wird in der EU bislang nur im Rahmen von Härtefallprogrammen (Compassionate Use) eingesetzt, und zwar nur bei COVID-19-Patienten, die eine invasive maschinelle Beatmung benötigen. (m / Foto: imago images / PPE)
Studien: Remdesivir verkürzt Behandlungsdauer
Die EMA stützt ihre Empfehlungen eigenen Angaben zufolge auf zwei Studien. Eine Zwischenauswertung von Daten aus den Vereinigten Staaten (NIAID-ACTT-Studi) ergab, dass Remdesivir COVID-19-Erkrankten hilft und sie schneller gesund werden. Patienten, die Remdesivir erhielten, hatten eine um 31 Prozent kürzere Genesungszeit als Patienten unter Placebo: Remdesivir-Patienten waren nach elf Tagen, Placebo-Patienten nach 15 Tagen gesund. Auch gibt es Hinweise, dass Remdesivir die Sterblichkeit verringern könnte, in der Remdesivir-Gruppe starben statistisch betrachtet acht von 100 Patienten (Sterberate 8 Prozent), in der Placebogruppe starben 11,6 von 100 Patienten (Sterberate 11,6 Prozent). Die aktualisierten Empfehlungen zur kürzeren Therapiedauer leitet die EMA aus einer weiteren Untersuchung ab (Study to Evaluate the Safety and Antiviral Activity of Remdesivir in Participants With Severe Coronavirus Disease (COVID-19), in der Patienten mit beiden Behandlungsdauern eingeschlossen sind.
Rolling-Review in der EU
Obwohl Remdesivir in der Europäischen Union bislang noch nicht zugelassen sei, würden die aktualisierten Empfehlungen einigen schwer an COVID-19 erkrankten Patienten helfen, Zugang zu dem Arzneimittel zu bekommen solange die EMA noch Nutzen und Risiken des RNA-Polymerasehemmers prüfe, erklärt das CHMP.
Am 30. April hatte der Ausschuss für Humanarzneimittel (CHMP) der EMA einen „Rolling Review“, eine fortlaufende Überprüfung, von Remdesivir zur Behandlung von COVID-19 eingeleitet. Dieses Rolling-Review-Verfahren ermöglicht es der EMA, ein vielversprechendes Arzneimittel während eines Notfalls, wie beispielsweise der laufenden Pandemie, rasch zu bewerten. Wie lange die Arzneimittelbehörde benötigt, um eine Entscheidung zu Remdesivir zu treffen, ist nicht bekannt.
Zur Erinnerung: Wie wirkt Remdesivir?
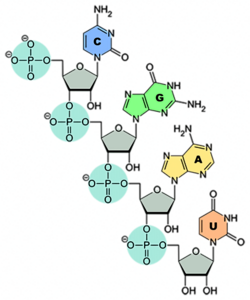
Remdesivir zählt zu den Virostatika. Der Arzneistoff hemmt die Vermehrung bestimmter Viren – unter anderem Ebola- und Coronaviren –, indem Remdesivir das für die Vermehrung erforderliche Enzym, die virale RNA-Polymerase, blockiert. In SARS-CoV-2 liegt die Erbinformation – anders als beim Menschen – in Form von Ribonukleinsäure (RNA) vor. Bei der RNA handelt es sich um eine lange Zucker-Phosphat-Kette, an die einzelne Nukleinbasen – nämlich Adenin, Cytosin, Guanin und Uracil – angeknüpft sind (siehe Abb.). Als Zuckerbaustein nutzt die RNA Ribose, daher auch der Name Ribonukleinsäure.
Will sich ein Virus vermehren, muss es zunächst seine Erbinformation für die Nachfolgegeneration verdoppeln, dabei hilft die viruseigene RNA-Polymerase. Sie nutzt die vorhandene RNA als Vorlage und knüpft eine neue Kette, wieder bestehend aus Zucker-Phosphat und daran angehängt Adenin, Cytosin, Guanin oder Uracil. Remdesivir ähnelt der Nukleinbase Adenin und wird so als „falscher“ Baustein in die neue RNA des „Virus-Nachkommens“ eingebaut. Die Folge: Die RNA- und folglich die Virus-Vermehrung ist gestört.
Remdesivir: in USA und Japan zugelassen
Die Vereinigten Staaten waren bei der Remdesivir-Zulassung die Schnellsten: Bereits am 1. Mai 2020 erteilte die US-amerikanische Arzneimittelbehörde FDA Remdesivir eine Ausnahmegenehmigung (Emergency Use Authorization, EUA), was allerdings keiner „normalen“ Zulassung entspricht, zum Einsatz des ursprünglich bei Ebola erforschten Virostatikums bei Corona. Die USA waren somit die erste Nation mit einem zugelassenen Präparat gegen COVID-19. Wenige Tage später, am 7.Mai, folgte Japan mit der Zulassung von Remdesivir. Japan traf die Entscheidung nur drei Tage, nachdem der US-amerikanische Arzneimittelhersteller Gilead eine beschleunigte Zulassung für die Behandlung von COVID-19-Erkrankten beantragt hatte.




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.