
- DAZ.online
- News
- Apotheke
- Wieder Probleme beim ...
Neue Handlungsanweisungen angekündigt
Wieder Probleme beim Adrenalin-Pen Emerade
Stuttgart - 01.10.2019, 17:00 Uhr
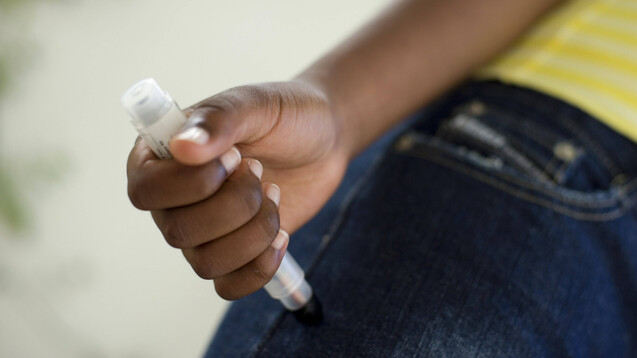
Im Notfall muss die Anwendung eines Adrenalin-Pens schnell gehen und zuverlässig funktionieren. Doch gerade der letzte Punkt ist leider nicht immer gegeben. Schon länger gilt die Empfehlung, immer zwei Adrenalin-Pens mit sich zu führen. ( r / Foto: imago images / Science Photo Library)
Bei dem Notfallmedikament Emerade kommt es in sehr seltenen Fällen zu einer Blockade beim Entleeren des Pens. Das teilte die Arzneimittelkommission der Deutschen Apotheker (AMK) im Juni 2018 mittels AMK-PHAGRO-Schnellinformation mit. Seitdem müssen Allergiker zwingend zwei Adrenalin-Pens mit sich führen. Maßnahmen zur Behebung der damaligen Mängel seien nun umgesetzt, das geht aus einer aktuellen AMK-Meldung hervor. Doch es scheint weiterhin Probleme zu geben.
Adrenalin-Pens bescheren den Apotheken immer wieder Probleme. Vor allem der Sommer 2018 war von Engpässen geprägt. Zudem war im Juni 2018 in einem Rote-Hand-Brief bezüglich des Emerade®-Fertigpens darauf hingewiesen worden, dass aufgrund der nicht auszuschließenden Möglichkeit einer Blockade beim Auslösen das Mitführen von zwei Emerade®-Fertigpens ab sofort „zwingend erforderlich“ sei. Im April 2017 hatte auch Meda/Pfizer einzelne Chargen seiner Fastjekt®-Adrenalin-Injektoren zurückgerufen. Es hatte Auffälligkeiten bei der Aktivierung gegeben – allerdings nicht in Deutschland, hieß es damals. Bereits 2012 war der (laut Lauer-Taxe) nicht mehr im Handel befindliche Anapen® zurückgerufen worden.
Nun gibt es bei Emerade eine „neu aufgetretene Problematik im Zusammenhang mit der Aktivierung von Emerade® 150/300/500 Mikrogramm Injektionslösung in einem Fertigpen“. Das geht aus einer aktuellen AMK-Meldung des Mitvertreibers von Emerade® hervor, der Dr. Gerhard Mann Chem.-pharm. Fabrik GmbH. In Kürze soll ein aktualisierter Rote-Hand-Brief mit neuen Handlungsanweisungen veröffentlicht werden.
Mehr zum Thema

AMK-PHAGRO-Schnellinformation
Wegen möglicher Blockade: Immer zwei Emerade-Pens mitführen
Erneuter Engpass bei Adrenalin-Pens
Fastjekt: Apotheken müssen mit weiteren Engpässen rechnen
ALK: Produktionsvolumen bleibt 2019 erhöht
Adrenalin-Pens: Jext-Hersteller könnte nur temporäre Lieferengpässe auffangen
Zunächst handelt es sich aber bei der Veröffentlichung über die Arzneimittelkommission der Deutschen Apotheker (AMK) vor allem um einen umfassenden Chargenrückruf: Maßnahmen zur Mangelbehebung – bezüglich der im Rote-Hand-Brief vom 25. Juni 2018 beschriebenen, nicht auszuschließenden Möglichkeit des Auftretens einer Blockade bei Verwendung von Emerade® 150/300/500 Mikrogramm – seien nun umgesetzt worden.
„Aus diesem Grund ruft die Firma alle vor dieser Umsetzung produzierten genannten Chargen von Emerade® (Epinephrin) 150 Mikrogramm, 1 und 2 Stück, Injektionslösung in einem Fertigpen (PZN 10544267 und 10552611), Emerade® 300 Mikrogramm, 1 und 2 Stück, Injektionslösung in einem Fertigpen (PZN 10544304 und 10552634), und Emerade® 500 Mikrogramm, 1 und 2 Stück, Injektionslösung in einem Fertigpen (PZN 10544333 und 10552640), aus dem Markt zurück.“ Weitere Chargen seien von diesem Rückruf nicht betroffen.
Die AMK werde darüber informieren, sobald der aktualisierte Rote-Hand-Brief zur neu aufgetretenen Problematik im Zusammenhang mit der Aktivierung veröffentlicht wurde.





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.