
- DAZ.online
- DAZ / AZ
- DAZ 28/2021
- mRNA-Impfstoff ist nicht ...
Pandemie Spezial
mRNA-Impfstoff ist nicht gleich mRNA-Impfstoff
Warum die Curevac-Vakzine enttäuscht hat
So sehr Curevac sich bemüht, in seiner Presse-Erklärung positiv zu klingen, so enttäuschend bleibt doch das, was das Tübinger Unternehmen in seiner finalen Analyse zu der Phase-IIb/III-Studie seines Impfstoffkandidaten CVnCoV am 30. Juni 2021 verkündete. „Einzigartige zulassungsrelevante Studie in zehn Ländern und in sich schnell verändernder Varianten-Umgebung“ heißt es zwar – aber die Schutzwirkung bleibt mit 48% weniger Infektionen (in der Gruppe der Geimpften gegenüber den Nichtgeimpften) weit hinter der Wirksamkeit der anderen mRNA-Vakzinen von Biontech/Pfizer und Moderna zurück. Zwar betont Cuevac in diesem Statement, dass man gegen 15 Virusvarianten habe antreten müssen. Doch selbst Studienleiter Peter Kremsner, Direktor des Instituts für Tropenmedizin an der Uni Tübingen, sagte zuletzt in der DAZ 2021, Nr. 26, S. 26, dass die mutierten Erreger nicht der Grund für die schwächere Wirksamkeit seien: „Die Varianten sind nicht Schuld.“
Technologie ist entscheidend
Die Öffentlichkeit war überrascht, denn schließlich basiert der Curevac-Impfstoff wie diejenigen von Biontech und Moderna auf mRNA, die für das Spike-Protein von SARS-CoV-2 kodiert – und Curevac hat als erstes Unternehmen weltweit die therapeutische mRNA-Technologie erprobt und somit die längste Erfahrung auf dem Gebiet. „Dieser Misserfolg zeigt vor allem, welch gute Arbeit Biontech und Moderna gemacht haben“, sagt Steve Pascolo, Immunologe am Unispital Zürich und Pionier der RNA-Vakzin-Forschung. „Es reicht eben nicht, jemandem eine mRNA zu spritzen, um eine funktionierende Impfung zu bekommen – es steckt sehr viel Technologie dahinter.“ Pascolo war im Jahr 2000 einer der drei Gründer von Curevac, fungierte bis zu seinem Ausscheiden 2006 als wissenschaftlicher Leiter und verantwortete die ersten klinischen Studien mit mRNA-Impfstoffen. „Man muss sehr viele Entscheidungen treffen beim Design eines Impfstoffs – und Biontech und Moderna haben das besser gemacht als Curevac“, sagt Pascolo, der heute keine Verbindung zu Curevac hat, stattdessen auf akademischer Ebene aber gelegentlich mit Biontech kooperiert.
Viele Gemeinsamkeiten, wichtige Unterschiede
Es gibt viele Gemeinsamkeiten, aber auch wichtige Unterschiede zwischen den mRNA-Impfstoffen. So entschieden sich etwa alle drei mRNA-Vakzin-Entwickler dafür, die volle kodierende Sequenz für das Spike-Protein zu benutzen, samt Transmembran-Domäne und Signalpeptid für den Transport des Spikeproteins ins endoplasmatische Retikulum. „Im endoplasmatischen Retikulum der Zellen, in die die mRNA aufgenommen wird, ist deshalb der größte Anteil an Spike-Protein zu finden“, sagt Pascolo. Curevac entschied sich wie Biontech und Moderna früh dafür, eine Abwandlung von der Wildtyp-Sequenz zu machen. Durch den Einbau zweier Codons für die Aminosäure Prolin wird das durch die Impfung induzierte Spike-Protein in der Konformation gehalten, die es vor dem Andocken an ein Zielprotein hat [1]. Das ist die Form, die Antikörper erkennen müssen, um eine Bindung zum ACE-Rezeptor zu verhindern. Alle mRNA-Vakzine werden wohl auch von dendritischen Zellen aufgenommen, den Schaltstellen des Immunsystems, die unter anderem für Aktivierung von T-Helferzellen notwendig sind, ohne die keine effektive Antikörperantwort zustande kommt. „Dendritische Zellen nehmen wie Staubsauger sämtliche Partikel auf – also auch die Liposome, in die die mRNA verpackt ist“, sagt Steve Pascolo.
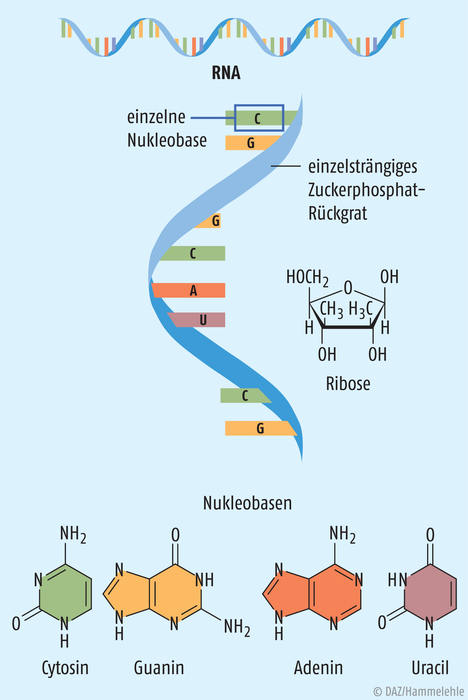
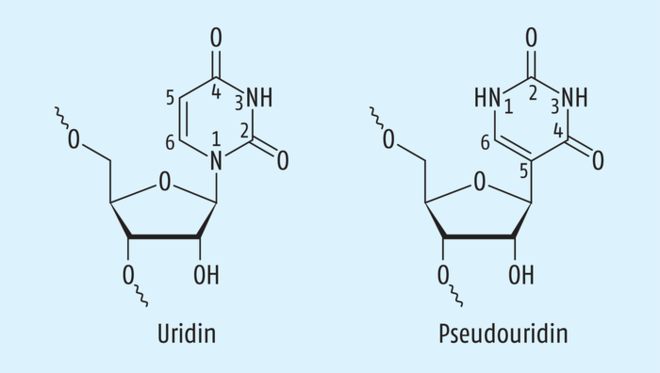
Es bleibt ein wesentlicher Unterschied zwischen Curevac und den bereits zugelassenen mRNA-Impfstoffen. RNA besteht – zumindest im Schulbuch – aus den Bausteinen Guanosin, Cytidin, Adenosin und Uridin (Abb. 1) – und genau daraus setzt sich der Curevac-Impfstoff zusammen. In der Natur dagegen treten um die 130 Modifikationen jener RNA-Bausteine auf. Die häufigste ist der Austausch von Uridin gegen Pseudouridin, also gegen das Isomer von Uridin (Abb. 2). „Eine natürliche RNA von Säugetieren enthält meist wenige Pseudouridin- und viele Uridin-Moleküle“, erklärt Steve Pascolo. Genau Pseudouridin benutzen Moderna und Biontech/Pfizer in ihrem Impfstoff ausschließlich statt Uridin. Dieser Unterschied wird in der Öffentlichkeit nun als Grund für die geringe Wirksamkeit des Curevac-Impfstoffs genannt [10] – doch stimmt das? Er ist jedenfalls kein unbedeutendes Detail, sondern immunologisch bemerkenswert.
Auch mRNA immunologisch aktiv
Hintergrund: Die Funktionsweise einer verimpften mRNA beruht zwar wesentlich darauf, dass diese in ein Protein übersetzt wird, was wiederum eine Antikörper-Antwort hervorruft. Allerdings löst vorher bereits die mRNA alleine eine unspezifische Immunreaktion aus – ein Abwehrmechanismus des Körpers, denn fremde mRNA kommt vor allem bei Virusinfektionen vor. Fremde mRNA wird von Rezeptoren des Körpers, etwa von sogenannten Toll-like Rezeptoren (TLR), erkannt, weil sie Muster hat, die bei körpereigener mRNA nicht vorkommen. mRNA von Pathogenen bildet etwa dreidimensionale Strukturen aus, die im Körper nicht auftauchen [2], es treten Abfolgen von Erbsubstanz-Bausteinen auf, die es in Säugetieren nicht gibt [3] oder es fehlt die „Kappe“ (cap), die den Anfang von unserer mRNA markiert [4]. Sowohl innerhalb als auch auf den Zellen gibt es solche Rezeptoren – und wenn sie Alarm schlagen, wird die angeborene Immunantwort angeworfen [5]. Das bedeutet, die betroffenen Zellen schütten Botenstoffe, vor allem Typ-I-Interferone aus, die eine Virusvermehrung unterdrücken.
Grundsätzlich hat das einen negativen und einen positiven Effekt für die Wirkung von mRNA-Impfstoffen. Der positive: Es entsteht eine lokale Entzündung an der Einstichstelle, durch die Immunzellen angelockt werden – so auch die B-Zellen, die Antikörper produzieren können. „Sie nehmen Viren auf und in ihrem Inneren binden verschiedene Toll-like-Rezeptoren (TLR) die fremde mRNA – und dies führt dann über eine Signalkaskade zu einer besseren Aktivierung der B-Zelle“, sagt Ralf Küppers, Professor für Immunologie an der Universität Duisburg-Essen. Dies ist der Adjuvans-Effekt der mRNA-Impfung, andere Totimpfstoffe benötigen dafür einen Wirkverstärker. Doch es gibt auch Nachteile durch die starke Anregung des Immunsystems: Erstens eine starke kurzfristige Impfreaktion, etwa Schmerzen an der Einstichstelle, Fieber und Krankheitsgefühl. Und auch auf molekularer Ebene sind einige Konsequenzen auf den ersten Blick negativ für die mRNA-Impfung: Durch Typ-1-Interferone werden viele Gene angeschaltet, die eine Übersetzung einer mRNA in ein Protein verhindern und ihren Abbau beschleunigen - im Fall einer Virusinfektion einer Zelle wird so dessen Vermehrung unterdrückt. Für die mRNA-Impfung bedeutet das auch: die Bildung des Spike-Proteins könnte gedrosselt, die Impfwirkung verschlechtert werden.
Doch letztlich imitiert die mRNA-Impfung auch hier eine natürliche Situation, es liegt viel fremde RNA vor, genau wie wenn ein Virus sich in den Zellen schnell vermehrt. Im Fall der Infektion muss die adaptive Immunantwort, sprich die Antikörperproduktion, anspringen, damit der Erreger wirkungsvoll bekämpft werden kann. „Das Immunsystem ist schlau“, sagt Steve Pascolo. „Es hat Zellen entwickelt, die nicht empfindlich auf Typ-I-Interferone reagieren, so dass sie auch im Falle einer Infektion weiterhin Proteine produzieren und das adaptive Immunsystem stimulieren.“ Dies wurde etwa für bestimmte Fresszellen nachgewiesen [6].
Pseudouridin reduziert Immunreaktionen
Seit 2005 ist allerdings bekannt, dass injizierte mRNA, die Pseudouridin enthält, die Immunabwehr kaum noch stimuliert [7]. Für den Körper erscheint es sinnvoll, dass mRNA, die durch Pseudouridin so aussieht wie die eigene, keine Immunreaktion auslöst. Dass dies allerdings ausgerechnet einem Impfstoff zugute kommen soll, wirkt unlogisch – schließlich soll ein Vakzin genau das Gegenteil bewirken, eine möglichst starke Immunantwort. Tatsächlich benutzte das Unternehmen Moderna modifizierte mRNA zunächst nicht, um Impfstoffe zu entwickeln, sondern wollte etwa den Bauplan für körpereigene Proteine in menschliche Zellen einschleusen. Eine Immunreaktion gegen die mRNA wäre für diese Anwendung nicht von Vorteil gewesen. Erst mit den Jahren änderte sich das Programm von Moderna hin zu Impfstoffen. „Bei den RNA-Impfstoffen, die Pseudouridin-mRNA enthalten, kommt die notwendige Entzündung wohl vor allem von der Lipidverpackung und wahrscheinlich auch von der Schädigung im Muskel, die durch die Injektion entsteht“, vermutet Pascolo.
Eine Frage der Technologie oder der Menge?
Könnte die unterschiedliche Technologie dazu geführt haben, dass der Curevac-Impfstoff nun eine schlechtere Wirksamkeit hat als die bereits zugelassenen Präparate von Biontech und Moderna? Pascolo schätzt eher die Dosierung der Curevac-Impfung kritisch ein. „Bei Curevac hat man die Dosis etwas zu niedrig angesetzt“, sagt Pascolo. Der Mengen-Unterschied der verwendeten RNA ist tatsächlich eklatant. Eine Dosis Curevac-Impfstoff enthält nur 12 µg, der von Moderna mit 100 µg fast das Zehnfache, Biontech/Pfizer verwenden immerhin 30 µg. Die Immunreaktion auf die Impfstoffe unterscheidet sich denn auch deutlich: Während nach Impfung mit Moderna und Biontech/Pfizer durchschnittlich je nach Alter etwa zwei- bis fünfmal so viele Antikörper gebildet wurden, wie nach einer SARS-CoV-2-Infektion, entsprechen die Antikörperantworten nach Injektion des Curevac-Impfstoffs etwa denen nach einer natürlichen Infektion. Studienleiter Peter Kremsner bestätigte der Deutschen Apotheker Zeitung : „Wir konnten nicht höher als 12 μg dosieren – da waren wir, was die Sicherheit und Verträglichkeit des Impfstoffes angeht, am Anschlag. Doch sehr wahrscheinlich war diese mRNA-Menge dann letztlich zu wenig immunogen.“ In den Phase-I-getesteten höheren Dosierungen von 16 und 20 µg seien bei 100% der Probanden unerwünschte Nebenwirkungen aufgetreten. Die Impfstoffe, die dagegen Pseudouridin verwendeten, konnten wohl in höherer Dosis verabreicht werden, weil der Teil der Immunantwort, der zu Nebenwirkungen führt, gedämpft wurde.
Unmodifizierte mRNA noch nicht gescheitert
Ist die unmodifizierte mRNA damit in der Impfstoff-Entwicklung gescheitert? Das ist keineswegs klar, denn eigentlich hat sie schon lange bewiesen, dass sie im Prinzip funktioniert. „Alle Anti-Krebs-mRNA-Impfstoffe von Biontech basieren auf nicht modifizierter RNA“, sagt Steve Pascolo. „Seit den 1990ern wissen wir, dass nicht-modifizierte mRNA als Impfstoff funktioniert.“ Damals arbeiteten Pascolo und Kollegen mit Zellen und Mäusen. Aber schon lange gibt es auch Studien, die die Wirksamkeit beim Menschen belegen: So zeigt eine Gruppe von Forschern um Biontech-Chef Uğur Şahin 2016 im Fachmagazin Nature, dass unmodifizierte RNA bei Menschen eine robuste Immunantwort gegen ein Zielprotein auslöst [8] – allerdings fand diese Studie bei Krebspatienten statt. In der Tumorimmuntherapie ist die Interferon-Antwort besonders wichtig, weil sie für die Aktivierung von cytotoxischen T-Zellen entscheidend ist, die Krebszellen abtöten, auch im Gewebe. „Nicht-modifizierte mRNA ergibt höhere Interferon-Ausschüttung und damit bessere T-Zellantworten“, sagt Pascolo. Andererseits verursacht genau die Interferon-Typ-I-Ausschüttung starke Nebenwirkungen wie Krankheitsgefühl. Das erklärt wohl die hohe Rate an Nebenwirkungen in der Phase-I-Studie von Curevac bei der Gabe von 16 und 20 µg mRNA.
Impfstoff der 2. Generation in der Pipeline
Das Unternehmen glaubt trotz des Rückschlags weiter an einen Impfstoff aus unmodifizierter mRNA. Gemeinsam mit GlaxoSmithKline (GSK) entwickelt Curevac einen Impfstoff der zweiten Generation gegen SARS-CoV-2 – ebenfalls aus unmodifizierter mRNA. „CVnCoV basiert auf einem neuen mRNA-Rückgrat, das im Hinblick auf verbesserte intrazelluläre Stabilität und Translation der mRNA für eine erhöhte und verlängerte Proteinexpression optimiert wurde“, schreibt das Unternehmen in einer Presseerklärung aus dem Mai. Denn es geht bei der mRNA-Technologie längst nicht nur um modifiziert oder nicht-modifiziert.
So gibt es auf dem mRNA-Strang, vor und hinter dem für das Spike-Protein kodierenden Abschnitt, auch nicht translatierte Regionen (untranslated regions, UTR). Die sogenannte 5´-UTR entscheidet mit darüber, wie gut das Ribosom bindet. Das andere Ende der mRNA, die 3´-UTR ist dagegen sehr wichtig für die Stabilität einer mRNA. In einem Preprint zu ihrem Impfstoff der zweiten Generation schreiben die Curevac-Wissenschaftler, dass sie genau hier Veränderungen vorgenommen haben [9]: „Wir zeigen hier, dass die optimierte mRNA im Impfstoff CVnCoV in der Tat höhere Level von Protein Expression in Zellkultur bewirkt.“ In Ratten habe es eine robuste Immunantwort gegeben.
Vorteile der unmodifizierten mRNA
Komplett abschreiben muss man die Curevac-Entwicklungsarbeit deshalb noch nicht. Denn in einer Hinsicht war das Unternehmen schon weiter als die Konkurrenten: Der Tübinger Impfstoffkandidat ist das erste RNA-Präparat, das im Kühlschrank gelagert werden kann – drei Monate bei 5 °C. Das überrascht, denn die verbreitete Ansicht ist, dass die RNA so instabil ist, dass sie eben nur bei sehr kalter Temperatur intakt bleibt. „Entgegen der allgemeinen Annahme ist reine RNA sehr stabil“, sagt Steve Pascolo. „Kein anderes biologisches Produkt ist so robust.“ Man kann sie auf 90 °C erhitzen, wieder einfrieren und Gefriertrocknen, ohne dass sie Schaden nimmt. Voraussetzung ist, dass das Milieu neutral bis leicht sauer ist und dass keine Enzyme vorhanden sind, die RNA abbauen. Diese sogenannten RNasen sind sehr stabil und weit verbreitet, sogar im Trinkwasser sind sie enthalten. „Wer mit RNA im Labor arbeitet, muss deshalb Speziallösungen verwenden“, sagt Pascolo. „Aber in der pharmazeutischen Industrie gibt es natürlich sowieso keine Verunreinigungen, deshalb ist das bei den Impfstoffen keine Gefahr.“ Die Anfälligkeit der anderen RNA-Impfstoffe bei Temperaturen über dem Gefrierpunkt ist wohl eher auf die Verpackung der RNA, die sogenannten Liposomen, zurückzuführen. Diese Bläschen bestehen aus Fetten und je nachdem, welche dabei verwendet werden, sind sie unterschiedlich stabil. „Curevac hat da wohl eine bessere Rezeptur gefunden als die Konkurrenten“, sagt Pascolo. Bei der Verpackung sieht er auch kurzfristig ein großes Potenzial für die Verbesserung der RNA-Vakzinen. „Heute bestehen die Liposome aus vier Lipiden, künftig vielleicht nur noch aus zwei oder gar einem“, sagt er. „Dazu können wir vielleicht auch noch mit der Wirkstoff-Dosis runtergehen, 2025 haben wir wohl RNA-Impfstoffe, die sehr günstig sind und einfach zu lagern.“ |
Literatur
[1] Dai L et al. Viral targets for vaccines against COVID-19. Nat Rev Immunol 2021;21:73–82
[2] Gao D, Li W. Structures and recognition modes of toll-like receptors. Proteins 2017;85(1):3-9
[3] Saito T et al. Innate immunity induced by composition-dependent RIG-I recognition of hepatitis C virus RNA. Nature 2008;454(7203):523-527
[4] Hornung V et al. 5‘-Triphosphate RNA is the ligand for RIG-I. Science 2006;314(5801):994-997
[5] Georg P, Sander LE. Innate sensors that regulate vaccine responses. Curr Opin Immunol 2019;59:31-41
[6] Honke N et al. Enforced viral replication activates adaptive immunity and is essential for the control of a cytopathic virus. Nat Immunol 2011;13(1):51-57
[7] Karikó K et al. Suppression of RNA recognition by Toll-like receptors: the impact of nucleoside modification and the evolutionary origin of RNA. Immunity 2005;23(2):165-175
[8] Kranz L et al. Systemic RNA delivery to dendritic cells exploits antiviral defence for cancer immunotherapy. Nature 2016;534:396–401
[9] Roth N et al. CV2CoV, an enhanced mRNA-based SARS-CoV-2 vaccine candidate, supports higher protein expression and improved immunogenicity in rats. bioRxiv 2021.05.13.443734
[10] Arzt I, Simmank J. CureVac: Der Impfstoff lahmt. Zeit online vom 17. Juni 2021, www.zeit.de/gesundheit/2021-06/curevac-impfstoff-wirksamkeit-studie-coronavirus?utm_referrer=https%3A%2F%2F






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.