
- DAZ.online
- DAZ / AZ
- DAZ 27/2021
- Herausforderung ...
Pandemie Spezial
Herausforderung Vektorimpfstoffe
Das Wirkprinzip, der Herstellungsprozess und das Problem mit den Fremdproteinen
Mit der Entwicklung der Impfstoffe gegen SARS-CoV-2 kommen zwei völlig neue Immunisierungs-Konzepte breit zum Einsatz, die vorher noch nicht dagewesen waren: die mRNA- und die Vektor-Vakzine. Gemeinsam ist diesen beiden Impfstoff-Typen, dass der Körper das Antigen selbst herstellen muss, bevor eine Immunantwort dagegen etabliert werden kann. Während die mRNA-Impfstoffe Comirnaty und COVID-19 Vaccine Moderna in der Zielzelle direkt in das Spike-Protein translatiert werden können, liefern die Vektor-Vakzine die codierende DNA.
Adenoviren als DNA-Transportvehikel
DNA in Zellen einzubringen ist wegen der polyanionischen Moleküleigenschaften sehr schwer. In der Gentechnik und Gentherapie wird dieses Problem unter anderem durch die Verwendung viraler Vektoren gelöst, wobei sich Adenoviren als „Gen-Fähren“ seit Langem bewährt haben.
Adenoviren sind nicht behüllte Viren mit einem ikosaedrischen Capsid und einem doppelsträngigen, linearen DNA-Genom mit einer Länge von ca. 36.000 Basenpaaren. Mindestens 57 Serotypen der Adenoviren sind bekannt, die in verschiedene Spezies gruppiert werden. Humane Adenoviren sind allgegenwärtig und die meisten Menschen haben sich bereits als Kind mit einem oder mehreren Serotypen infiziert. In Immunkompetenten verläuft eine Infektion meist asymptomatisch oder nur mit milden Symptomen. Häufig ist der Respirationstrakt betroffen, aber auch der Gastrointestinal- oder Urogenitaltrakt können in Mitleidenschaft gezogen sein.
Mehrere Eigenschaften von Adenoviren sind vorteilhaft für ihre Verwendung als Vektoren zum Einbringen von DNA: Ganz wichtig ist ihre Fähigkeit, nicht nur teilungsaktive, sondern auch ruhende Zellen zu infizieren. Damit wird eine möglichst weite Verbreitung der einzubringenden genetischen Information gewährleistet. Innerhalb der infizierten Zellen bleibt das Genom der Adenoviren als Episom im Zellkern und integriert nicht in die Chromosomen. Dadurch werden potenziell schädliche Integrationsereignisse vermieden. Außerdem sind diese Viren mittlerweile sehr gut untersucht. Sie lassen sich genetisch verändern und in größerem Maßstab vermehren.
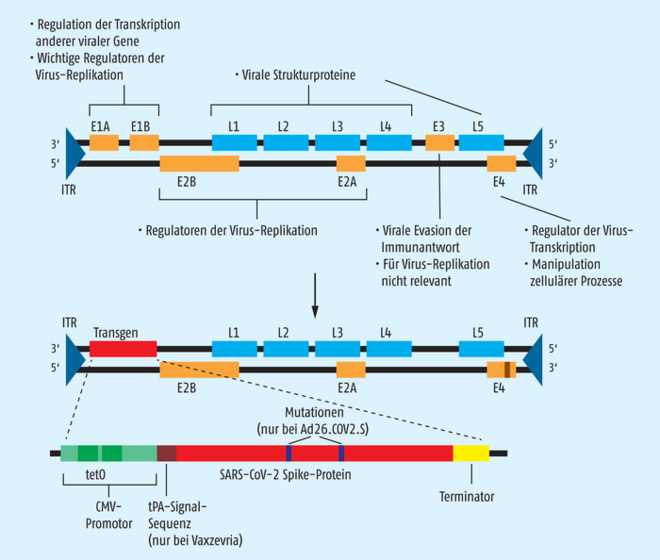
Ungefähr 20 sogenannte „early genes“ (E), also bereits kurz nach der Infektion exprimierte Proteine, sind auf der Virus-DNA in Gruppen codiert und sorgen dafür, dass das virale Genom repliziert wird (Abb. 1). Die restlichen ca. 15 Proteine (late genes, L, ebenfalls in Gruppen angeordnet) werden später gebildet und sind vor allem für die Struktur des Virions verantwortlich. In geeigneten Wirtszellen entstehen wenige Tage nach der Infektion ungefähr 10.000 neue Virus-Partikel pro Zelle, die nach Zelllyse freigesetzt werden.
Abb. 1: Das Adenovirus-Genom. Oben: Damit das lineare Genom in voller Länge repliziert werden kann, befinden sich an den beiden Enden kurze invertierte Wiederholungseinheiten (ITR: inverted terminal repeats). Zur Platzersparnis sind auf beiden Strängen (schwarze Linien) der linearen doppelsträngigen DNA Gene codiert. Die Funktionen der entsprechenden Proteine sind in der Abbildung aufgeführt. Unten: Für die rekombinanten, replikationsdefizienten Adenoviren wurde der Genbereich E1 entfernt, damit sich die resultierenden Viren nicht weiter vermehren können. Außerdem wurde E3 deletiert und die Region E4 so modifiziert, dass sie Sequenzen des humanen Adenovirus 5 (braun) enthält, um eine möglichst hohe Virusausbeute in HEK293-Zellsystemen zu erzielen. Für die Produktion des Spike-Proteins wurde eine Expressions-Cassette (Transgen) bestehend aus CMV-Promotor, S-Gen und Terminator in das Genom integriert. Der CMV-Promotor sorgt für eine starke Transkription und enthält die Bindestellen für den Tetracyclin-Repressor (tetO), wodurch er in Anwesenheit des Repressor-Proteins nicht aktiv ist. Dadurch wird gewährleistet, dass das Spike-Protein nicht während der Virusproduktion, sehr wohl aber in der späteren Zielzelle im Körper der Geimpften exprimiert wird. Das S-Gen trägt im Fall von Vaxzevria noch die Information für die Signalsequenz des Gewebeplasminogenaktivators (t-PA). Bei Ad26.COV2.S ist das S-Gen an zwei Stellen mutiert (dunkelblau): Zwei Aminosäureaustausche am Übergang der S1/S2-Region zerstören die Schnittstelle für die Protease Furin und zwei Aminosäuresubstitutionen in der Hinge-Region durch Proline halten das Spike-Protein in der sogenannten Präfusionskonformation.
Für die Anwendung als Vektoren für den Gen-Transfer stehen im Prinzip zwei Typen modifizierter Adenoviren zur Verfügung: replikationsdefiziente und replikationsfähige Virionen. Bei replikationsdefizienten Viren, wie sie auch für die beiden COVID-19-Vakzinen verwendet wurden, sind die early genes E1A und E1B entfernt und durch die Information für das Spike-Protein ersetzt worden. Zusätzlich wird meist noch das E3-Gen deletiert, das beim Wildtyp-Adenovirus dafür sorgt, dass die infizierte Zelle nicht vom Immunsystem attackiert wird. E3 wird bei der In-vitro-Vermehrung nicht benötigt, die Deletion schafft jedoch Platz für das einzubringende Transgen. Adenoviren können nur DNA in einer Länge bis zu 105 % der ursprünglichen Genomgröße verpacken, bevor die Viruspartikel instabil werden. Durch die Deletion der E1- und der E3-Region ist der Einbau eines bis zu 7.500 Basenpaare großen Transgens möglich. Um replikationsdefiziente Adenoviren in größeren Mengen herzustellen, müssen eukaryontische Zelllinien gentechnisch so verändert werden, dass sie die für die Virusvermehrung nötigen E1A- und E1B-Proteine exprimieren.
Ein Nachteil der Adenoviren ist ihre eigene immunogene Wirkung. Das Immunsystem der mit Adenoviren behandelten Person produziert spezifische Antikörper und T-Zellen, weshalb eine mehrfache Anwendung eigentlich nicht möglich ist, ohne dass das Immunsystem die erneut eingebrachten Viruspartikel neutralisiert. Zudem induzieren Adenoviren und adenovirale Vektoren eine starke Antwort des angeborenen Immunsystems. Die Verabreichung hoher Virusmengen direkt in die Blutbahn kann im Tiermodell durch massive Expression proinflammatorischer Zytokine zum Tod führen. Es wird vermutet, dass der fatale Ausgang einer Gentherapiestudie an dem US-Amerikaner Jesse Gelsinger in den 1990er-Jahren darauf zurückzuführen ist, dass zu viele adenovirale Vektoren (insgesamt > 3 × 1013 Virionen) direkt in seine Pfortader appliziert wurden.
Vaxzevria, der Vektorimpfstoff von AstraZeneca
Die COVID-19-Vakzine der Firma AstraZeneca (Vaxzevria; AZD1222) basiert auf dem replikationsdefizienten Schimpansen-Adenovirus ChAdOx1. Dieser Vektor kann nach Bindung an den Coxsackie- und Adenovirus-Rezeptor (CAR) sehr viele verschiedene menschliche Zellen infizieren. Er wurde bereits vor einigen Jahren am Jenner-Institut der Universität Oxford entwickelt und für einen potenziellen Impfstoff gegen MERS-CoV optimiert. Wesentliche Eigenschaften dieses Vektors sind in Abbildung 1 wiedergegeben. Bei Vaxzevria wurde in diesen Vektor die genetische Information für das Spike-Protein von SARS-CoV-2 eingesetzt, die so verändert (Codon-optimiert) ist, dass in den Körperzellen eine möglichst große Proteinmenge des Wildtyp-Spike-Proteins als Antigen entsteht. Derartige Vektor-Konstruktionen finden in Bakterienzellen statt, in denen sich die Plasmid-DNA gut vervielfältigen lässt. Für Vaxzevria wurde das Plasmid p5713 pDEST-ChAdOx1-nCOV-19 generiert und genau charakterisiert. Das Plasmid kann dann als sogenannter Shuttle-Vektor nicht nur in Bakterien vermehrt, sondern auch in eukaryontischen Zellen exprimiert werden.
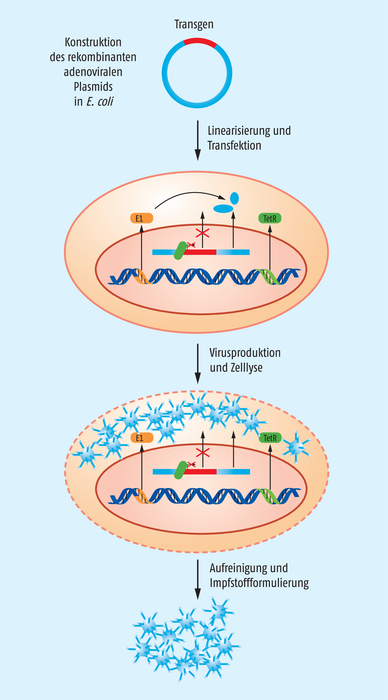
Produziert werden die Adenoviren in sogenannten T-REx-293-Zellen (Abb. 2). Diese Zellen stammen von der HEK-293-Zelllinie ab, die ursprünglich aus einer humanen embryonalen Niere isoliert und mithilfe eines humanen Adenovirus Serotyp 5 transformiert wurde. Bekannt ist, dass die adenovirale E1-Region stabil in das Chromosom 19 des HEK-Genoms integriert ist und auch exprimiert wird. HEK-Zellen sind einfach zu kultivieren und auch leicht zu transfizieren, weshalb sie zum Standard-Repertoire in Forschungslaboratorien gehören. Über die Expression der E1-Gene durch die HEK-Wirtszelle können replikationsdefiziente Adenoviren mit deletierter E1-Region in der Zelllinie gezüchtet werden. T-REx-293-Zellen enthalten das Tetracyclin-Repressor-Gen. Mithilfe des Tetracyclin-Repressors wird das Spike-Protein während der Produktion der Schimpansen-Adenoviren in der Zellkultur nicht exprimiert.
In einer ersten Transfektion von T-REx-293-Zellen mit dem Plasmid p5713 pDEST-ChAdOx1-nCOV-19 werden Adenoviren hergestellt, die nach umfassender Charakterisierung als Master-Virus-Saat-Bank dienen. Ausgehend von entsprechenden Master-Banken sowohl für das Virus-Saatgut als auch für die Wirtszelllinie werden Working-Banken hergestellt, die vor der Impfstoffproduktion ebenfalls intensiv auf Identität und verschiedenste Verunreinigungen getestet werden müssen. Über den genaueren Produktionsprozess ist im Assessment-Report zu Vaxzevria wenig zu finden. Der gesamte Herstellungsprozess wird in Zellkultur und der Downstream-Weiterverarbeitung unterschieden. Die Zellkultur besteht laut Assessment-Report aus vier Schritten:
- 1. Auftauen der Fläschchen,
- 2. Expansion des Inokulums in Schüttelkolben und Wippbeuteln,
- 3. Aussäen in Bioreaktoren für die weitere Expansion des Inokulums und
- 4. Befüllung der Produktionsbioreaktoren zur Erzeugung von AZD1222-Rohmaterial.
Die virushaltigen Zellen im Produktionsbioreaktor werden nach einer ausreichenden Inkubationszeit geerntet und mithilfe eines Detergens lysiert. Eine dazugegebene Nuklease zerstört anschließend die Wirtszell-DNA, das Lysat wird durch Tiefenfiltration geklärt und über einen membranchromatografischen Schritt von prozessbedingten Verunreinigungen befreit. Es folgt eine Aufkonzentrierung und Diafiltration mittels Tangentialfluss-Ultrafiltration zur weiteren Entfernung prozessbedingter Verunreinigungen und zum Pufferaustausch. Nach einem Formulierungsschritt und einer 0,2-μm-Filtration in spezifizierte Behälter, ist die aktive Substanz zur Lagerung (bei -90 °C bis -55 °C) und zum Versand fertig.
Abb. 2: Produktion der Adenoviren. Für die Vermehrung replikationsdefizienter Adenoviren stehen Zelllinien wie T-REx-293 oder PER.C6-TetR zur Verfügung, in die das linearisierte, rekombinante, adenovirale Plasmid transfiziert wird. In diesen Zellen wird einerseits die adenovirale E1-Genregion und andererseits das Tetracyclin-Repressor-Protein stabil exprimiert. Nach der Transfektion stehen alle Komponenten zur Verfügung, um Adenoviren mit dem Transgen im Genom zu bilden. Gleichzeitig wird die Expression des Spike-Proteins in den Zellen unterdrückt. Nach Lyse der Wirtszellen müssen die Adenoviren aus dem komplexen Zelllysat aufgereinigt werden.
Jedes Vial enthält – je nach Abfüllort – 8 oder 10 Impf-Dosen mit ≥ 2,5 × 108 infektiösen Einheiten. Außerdem befinden sich L-Histidin und L-Histidinhydrochlorid-Monohydrat als Puffer sowie Natriumchlorid, Magnesiumchlorid-Hexahydrat, Ethylendiamintetraessigsäure (EDTA) und Saccharose als Stabilisatoren im Impfstoff. Zusätzliche Bestandteile sind Ethanol, Polysorbat 80 und Wasser für Injektionszwecke.
COVID-19-Vakzine Janssen
Die Basis für den COVID-19-Impfstoff der Firma Janssen Ad26.COV2.S, ist das humane Adenovirus 26 (Ad26). Die „Durchseuchung“ der Bevölkerung mit Ad26 ist relativ gering und eine Infektion führt nur zu niedrigen Konzentrationen an neutralisierenden Antikörpern. Nach Bindung an das auf allen kernhaltigen Zellen exprimierte Oberflächenprotein und Komplementrezeptor CD46 kann Ad26 eine Vielzahl verschiedener Zellen infizieren. Bekannt ist dieser virale Vektor bereits von der replikationsdefizienten Virus-Vakzine Zabdeno gegen Ebola, die bei der EMA zugelassen ist. Durch die Deletion des E1-Bereichs kann sich das modifizierte Adenovirus nicht mehr eigenständig vermehren. Außerdem ist ein Teil der E3-Genomregion entfernt worden. Für eine effiziente Virusproduktion wurde die E4-Region von Ad26 durch die entsprechende Sequenz aus Ad5 ersetzt. Das im Vektor enthaltene Transgen codiert für das komplette SARS-CoV-2-Spike-Protein mit zwei Mutationen, die das Protein stabilisieren (Abbildung 1). Die Kombination aus Wildtyp-Signalsequenz und diesen Mutationen hatte sich in präklinischen Untersuchungen als optimal bezüglich der Induktion einer neutralisierenden humoralen und zellulären Immunantwort erwiesen. Kontrolliert wird die Expression des Spike-Proteins wie bei Vaxzevria vom CMV-Promotor, der auch hier Bindestellen für das Tetracyclin-Repressor-Protein enthält. Weitere Details zur Genexpressions-Cassette sind im Assessment-Report nicht hinterlegt.
Für die Vermehrung des Adenovirus werden PER.C6-TetR-Zellen verwendet (Abb. 2). Diese Zelllinie stammt von humanen embryonalen Retinazellen ab, die mithilfe des Plasmids pIG.E1A.E1B immortalisiert wurden und E1 für die Herstellung replikationsdefizienter Adenoviren exprimieren. Die dadurch entstandene PER.C6-Zelllinie erhielt anschließend das Gen für den Tetracyclin-Repressor, der stabil exprimiert wird. Somit stellen die PER.C6-TetR-Zellen während der Produktion der Adenoviren kein Spike-Protein her. Das Vektorkonstrukt pAd26.E1.CMVdel134-TO.COR200007 wurde zunächst in Bakterienzellen amplifiziert und als linearisierte DNA in PER.C6-TetR-Zellen transfiziert, um Adenoviren für eine Master-Virus-Saat-Bank zu erzeugen. Ausgehend von Master-Banken sowohl für die Virus-Saat als auch für die Wirtszelllinie werden Working-Banken hergestellt, die vor der Impfstoffproduktion intensiv auf Identität und verschiedenste Verunreinigungen getestet werden müssen. Der gesamte Herstellungsprozess der Adenoviren umfasst laut Assessment-Report zehn Stufen:
- 1. Vorkultur,
- 2. Expansion der Wirtszellen,
- 3. Inkubation mit Saat-Virus und Virus-Produktion,
- 4. Zelllyse,
- 5. Fällung der Wirtszell-DNA,
- 6. Klärung der Lösung,
- 7. Anionenaustauschchromatografie (AEX),
- 8. Feinreinigung (Polishing) und Pufferaustausch,
- 9. Endformulierung (final adjustment) und Abfüllung sowie
- 10. Einfrieren der aktiven Substanz.
Pro Dosis sind im Impfstoff mindestens 2,5 × 1010 Viruspartikel enthalten. Weitere Bestandteile sind 2-Hydroxypropyl-β-cyclodextrin (HBCD), Ethanol und Polysorbat-80 als Stabilisatoren, Natriumchlorid als Tonizitätsmittel und Stabilisator, Natriumhydroxid und Salzsäure um den pH-Wert einzustellen, Trinatriumcitrat-Dihydrat und Zitronensäure-Monohydrat als Puffersubstanzen und schließlich Wasser für Injektionszwecke.
Für die Formulierung zum eigentlichen Impfstoff werden die Adenoviren aufgetaut, vorgefiltert, gepoolt und mit vorgefiltertem Formulierungspuffer verdünnt. Die formulierte Masse wird homogenisiert, über zwei in Reihe geschaltete 0,2-μm-Filter sterilfiltriert und aseptisch in Fläschchen abgefüllt, verschlossen und mit einem Deckel versehen. Anschließend werden die Fläschchen visuell inspiziert, eingefroren, etikettiert und verpackt.
Der Prozess ist das Produkt
Eigentlich ist es hinlänglich bekannt: Die Herstellung von Arzneimitteln ist kein einfaches Unterfangen, besteht aus mehr oder weniger vielen Schritten und muss mit entsprechend zahlreichen Kontrollen überprüft werden. Biopharmazeutika setzen hier besondere Maßstäbe, denn für sie gilt der Grundsatz, dass das komplexe Produkt neben all seinen molekularen, chemisch-physikalischen Eigenschaften, die man mit den modernen analytischen Methoden immer genauer erfassen kann, entscheidend durch das validierte Herstellungsverfahren charakterisiert ist: the process is the product. Was dabei im Einzelnen bei den Firmen abläuft, ist Firmengeheimnis. In den EMA-Assessment-Reports können interessierte Leser nachverfolgen, dass der Zulassungsbehörde entsprechende Unterlagen und Nachweise zur Verfügung gestellt wurden und alle Daten den Erwartungen entsprochen haben. Die genauen Details werden allerdings nicht genannt, was natürlich dem Schutz der Zulassungsunterlagen geschuldet ist. Im Europäischen Arzneibuch kann man sich aber über die grundsätzlichen Anforderungen an Biopharmazeutika und Impfstoffe informieren, beispielsweise in den Monografien „Impfstoffe für Menschen“, „DNA-rekombinationstechnisch hergestellte Produkte“ oder „Zellkulturen für die Herstellung von Impfstoffen für Menschen“.
Die Herstellungsverfahren der Vektor-Vakzinen halten einige besondere Herausforderungen bereit: Die nichtreplikationsfähigen adenoviralen Vektoren können nur gewonnen werden, nachdem die Wirtszellen lysiert wurden. Aus der dabei entstandenen, sehr komplex zusammengesetzten Lösung sind die 80 bis 100 nm großen Viruspartikel so aufzureinigen, dass sie komplett (keine Virusbruchstücke, keine leeren Hüllen) und nach wie vor infektiös bleiben. Replikationskompetente Viren, die beispielsweise die E1-Genregion aus der Wirtszelle aufgenommen haben, dürfen nicht vorhanden sein. Verunreinigungen, die von den lysierten Wirtszellen und Bestandteilen des Kulturmediums stammen, müssen möglichst quantitativ abgereichert werden. Diese Eigenschaften müssen in jeder Charge innerhalb eines bestimmten, vorgegebenen Toleranz-Bereiches liegen – und das unabhängig vom Herstellungsort. (Jede Charge muss natürlich zudem wie bei allen Impfstoffen vom Paul-Ehrlich-Institut [PEI] freigegeben werden.) Was von der Zulassungsbehörde vorgegeben und dann final auch genehmigt wurde, ist nicht im Assessment-Report hinterlegt. Dass das Herstellungsverfahren nicht gleich bei der Markteinführung und in allen Punkten perfekt validiert ist und auch manchmal einige Kontrollen nachgeliefert oder nachgebessert werden müssen, lässt sich an den „wesentlichen Kritikpunkten“ (major objection) und „Empfehlungen“ (recommendation) des Committee for Medicinal Products for Human Use (CHMP) in den Assessment-Reports für beide Impfstoffe nachlesen. Die große Besonderheit der Vektor-Impfstoffe – wie auch der mRNA-Vakzinen – ist jedoch, dass das eigentliche Impfantigen, also das Spike-Protein, erst von den geimpften Personen hergestellt wird. Was mit der transient in den Körper eingebrachten genetischen Information passiert, ist hoch relevant: Wird das Spike-Protein tatsächlich so hergestellt, wie es geplant war – also in voller Länge und mit der richtigen Aminosäureabfolge? Oder entstehen auch Bruchstücke oder sogar ganz andere Proteine, wie man es aus einer kürzlich veröffentlichten Arbeit zu den neuen Splice-Donor- und -Akzeptorstellen schließen könnte? In den Assessment-Reports wird im Unterkapitel „Specification“ der „Active substance“ (2.2.2) der „Quality aspects“ (2.2) darauf kurz eingegangen: Während für Ad26.COV2.S ein qualitativer ELISA als Nachweis erwähnt wird, ist die Dokumentation für AZD1222 für die Zulassungsbehörde zunächst noch nicht zufriedenstellend und eine Nachbesserung erforderlich. |
Literatur
Afkhami S, Yao Y, Xing Z. Methods and clinical development of adenovirus-vectored vaccines against mucosal pathogens. Mol Ther Methods Clin Dev 2016;3:16030
Baker AH, Herzog RW. Did dendritic cell activation, induced by adenovirus-antibody complexes, play a role in the death of Jesse Gelsinger? Mol Ther 2020;28(3):704-706
Baker AT, Boyd RJ, Sarkar D et al. The structure of ChAdOx1/AZD-1222 reveals interactions with CAR and PF4 with implications for vaccine-induced immune thrombotic thrombocytopenia. bioRxiv 2021, https://doi.org/10.1101/2021.05.19.444882
Bos R, Rutten L, van der Lubbe JEM et al. Ad26 vector-based COVID-19 vaccine encoding a prefusion-stabilized SARS-CoV-2 Spike immunogen induces potent humoral and cellular immune responses. npj Vaccines 2020;5:91
Dicks MDJ, Spencer AJ, Edwards NJ, et al. A Novel Chimpanzee Adenovirus Vector with Low Human Seroprevalence: Improved Systems for Vector Derivation and Comparative Immunogenicity. PLoSONE 2012;7(7):e40385
EMA Assessment Report EMA/158424/2021 „COVID-19 Vaccine Janssen” www.ema.europa.eu/en/documents/assessment-report/COVID-19-vaccine-janssen-epar-public-assessment-report_en.pdf
EMA Assessment Report EMA/94907/2021 „COVID-19 Vaccine AstraZeneca”; www.ema.europa.eu/en/documents/assessment-report/vaxzevria-previously-COVID-19-vaccine-astrazeneca-epar-public-assessment-report_en.pdf
Geisbert TW, Bailey M, Hensley L et al. Recombinant adenovirus serotype 26 (Ad26) and Ad35 vaccine vectors bypass immunity to Ad5 and protect nonhuman primates against ebolavirus challenge. J Virol 2011;85(9):4222-4233
Kowarz E, Krutzke L, Reis J et al. „Vaccine-Induced COVID-19 Mimicry” Syndrome: Splice reactions within the SARS-CoV-2 Spike open reading frame result in Spike protein variants that may cause thromboembolic events in patients immunized with vector-based vaccines. ResearchSquare, DOI: 10.21203/rs.3.rs-558954/v1
Morris SJ, Sebastian S, Spencer AJ, Gilbert SC. Simian adenoviruses as vaccine vectors. Future Virol (2016;11(9):649–659
Wold WSM, Toth K. Adenovirus vectors for gene therapy, vaccination and cancer gene therapy. Curr. Gene Ther 2013;13(6):421–433























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.