
- DAZ.online
- DAZ / AZ
- DAZ 23/2021
- Eigentlich ja nur ein ...
Pandemie Spezial
Eigentlich ja nur ein Piks!?
Wie die Immunantwort bei einer Impfung abläuft und was sie stören kann
Was wollen wir eigentlich mit einer Impfung – egal gegen welche Krankheit – erreichen? Unser Immunsystem soll einen möglichst umfassenden Schutz gegen ein bestimmtes Pathogen aufbauen. Das heißt, dass der adaptive Teil des Immunsystems aktiviert werden muss, also die B- und T-Zellen, die spezifische Strukturen des Pathogens erkennen. In diesem Prozess vermehren sich die entsprechenden Zellklone, Antikörper werden zuhauf ausgeschüttet und zusätzlich entstehen Gedächtniszellen. Sollte es irgendwann später einmal zu einem Kontakt mit dem echten Pathogen kommen, werden die spezifischen (Gedächtnis-)Zellklone schnell reaktiviert und können den Eindringling bekämpfen. Letztendlich simulieren wir bei jeder Impfung eine Infektion, nur dass wir dabei nicht wirklich krank werden (sollten). Das ist also das Endziel, aber wie kommen wir da hin?
Wie läuft die Immunreaktion ab?
Mit dem Stich der Injektionsnadel in den Muskel wird natürlich lokal Gewebe verletzt. Die freigesetzten Cytoplasmabestandteile aus den zerstörten Zellen signalisieren den umliegenden Zellen die Gefahrensituation und Gewebemakrophagen und andere Immunzellen werden angelockt, um die Reste zu eliminieren. Zunächst wird also das angeborene Immunsystem mobilisiert. Für die Regeneration des Gewebes kommt es zu einer besseren Durchblutung des betroffenen Bereiches. Wichtige Mediatoren sind bei diesen Prozessen Zytokine, Eicosanoide und andere Signalmoleküle, die die inflammatorischen Prozesse koordinieren und später auch die Geweberegeneration einleiten. Als Resultat dieser lokalen Entzündungsreaktion ist die Einstichstelle leicht warm, gerötet und schmerzt (Abb. 1). Das war schon immer so, aber mittlerweile gibt es dafür sogar einen Begriff, den sogenannten COVID-Arm. Durch die Injektion des Impfstoffes gelangen zudem verschiedene Fremdpartikel in den Körper, die zum einen pathogenassoziiert sind, zum anderen die Immunreaktion steigern (Adjuvanzien) oder technologisch notwendig sind, wie zum Beispiel die Lipidnanopartikel bei den mRNA-Impfstoffen. Im Fall der mRNA- und Vektor-Vakzine gegen COVID-19 geht der Großteil der Partikel in die Muskelzellen, um darin das eigentliche Antigen, das Spike-Protein von SARS-CoV-2, exprimieren zu lassen. Die Muskelzellen werden also mit mRNA bzw. DNA transient transfiziert. Während die mRNA direkt für die Proteinbiosynthese verwendet werden kann, muss die von den jeweiligen Adenoviren eingebrachte DNA in den Zellkern, wo das Gen für das Spike-Protein transkribiert wird, bevor auch darüber die entsprechende mRNA zur Verfügung steht.
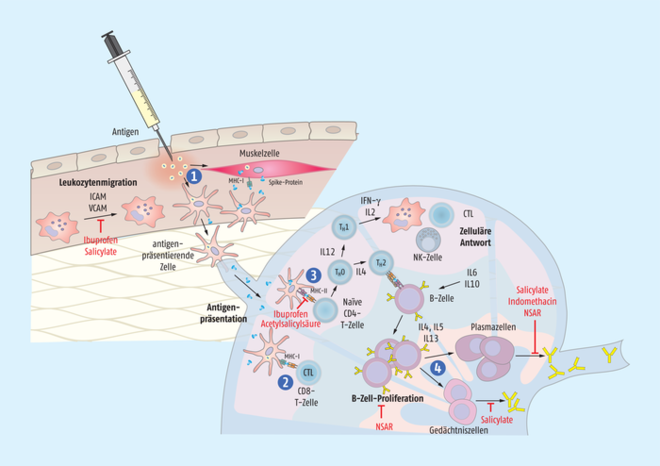
Abb.: Was passiert bei der Impfung mit Comirnaty® und Co.? Nach der Applikation der Vakzine gelangen die Adenoviren (Vaxzevria®) bzw. die Lipidnanopartikel von Comirnaty® oder COVID-19 Vaccine Moderna® in verschiedene Zellen, vor allem Muskelzellen, aber auch antigenpräsentierende Zellen wie die dendritischen Zellen (1). Dort wird die genetische Information für das Spike-Protein realisiert. Das neu gebildete virale Oberflächenprotein (blau) wird zum einen ausgeschleust, zum anderen werden Fragmente davon über MHC-I-Komplexe auf der Zelle präsentiert. Die MHC-I-Präsentation stimuliert spezifische, CD8-positive zytotoxische T-Zellen (CTL) zur Proliferation (2). Diese Zellen töten später alle virusinfizierten Zellen ab. Antigenpräsentierende Zellen nehmen aber auch das sezernierte Spike-Protein auf und exponieren Fragmente davon auf MHC-II-Molekülen auf der Zelloberfläche (3). Auf diesem Weg werden CD4-positive T-Helferzellen mobilisiert, die ihrerseits dazu beitragen, dass B-Zellen spezifische Antikörper gegen das Spike-Protein bilden. Alle aktivierten T- und B-Zellen proliferieren und differenzieren auch zu Gedächtniszellen (4), hier nur am Beispiel der B-Zellen gezeigt). Dadurch stehen später bei einer Infektion schnell Immunzellen zur Eliminierung des Pathogens zur Verfügung. All diese Prozesse werden über verschiedene Zytokine gesteuert. An verschiedenen Stellen können NSAR eingreifen (MHC: major histocompatibility complex).
Die Partikel gelangen aber auch in professionelle antigenpräsentierende Immunzellen (APC), die sich vor Ort befinden und zusätzlich durch den Entzündungsprozess vermehrt in das Gewebe einwandern. Vor allem dendritische Zellen spielen hierbei eine wesentliche Rolle. Wie Muskelzellen stellen die antigenpräsentierenden Immunzellen das Spike-Protein ebenfalls selbst her und präsentieren Bruchstücke davon über MHC-I-Moleküle auf ihrer Zelloberfläche. In den Lymphknoten werden über diesen Mechanismus die zytotoxischen (CD8-positiven) T-Zellen aktiviert, die einen wichtigen Teil der zellulären adaptiven Immunantwort darstellen. Aber die antigenpräsentierenden Immunzellen können noch mehr: Sie nehmen das von den Muskelzellen produzierte Spike-Protein über Phagozytose-Prozesse von außen auf und zeigen es über MHC-II-Moleküle auf ihrer Zelloberfläche anderen Immunzellen. Das spielt sich nicht nur am Ort der Injektion, also im Muskel, sondern vor allem in den Lymphknoten ab, die der Injektionsstelle am nächsten liegen, und ist wichtig für die humorale adaptive Immunantwort. Über die von MHC-II-Molekülen präsentierten Antigenbruchstücke werden (CD4-positive) T-Helferzellen stimuliert, die wiederum für eine vollständige Aktivierung von B-Zellen, ihre Umwandlung in Plasmazellen und damit eine effiziente Produktion von Antikörpern unerlässlich sind. Sowohl von den verschiedenen T-Zellen als auch von den B-Zellen werden Kopien in Form von Gedächtniszellen angelegt, die im Falle einer tatsächlichen Infektion rasch mobilisiert werden können, um das Pathogen zu bekämpfen. All diese Immunzellen und natürlich auch die Antikörper patrouillieren nun durch den gesamten Körper, aus der lokalen Immunreaktion ist eine systemische geworden. Unser Körper kann darauf mit Fieber, Schüttelfrost, Kopf-, Muskel- und Gliederschmerzen und auch Müdigkeit und Abgeschlagenheit reagieren, was man als Impfreaktionen bzw. Reaktogenität zusammenfasst. Diese Symptome fallen interindividuell sehr unterschiedlich aus, sagen aber überhaupt nichts über die Stärke des späteren Immunschutzes aus.
Wie lange dauert es bis zum Impfschutz?
Dieser Immunprozess braucht allerdings seine Zeit. Bereits wenige Tage nach der Impfung werden pentamere Antikörper vom IgM-Typ gebildet; nach dem Antikörperklassenwechsel dominieren monomere IgG-Antikörper. In den klinischen Studien zur Sicherheit und Immunogenität der derzeit eingesetzten Impfstoffe waren eine Woche nach der ersten Impfung (Prime) keine oder kaum spezifische IgG-Antikörper gegen das Spike-Protein nachweisbar. Und auch die T-Zell-Antwort war zu diesem Zeitpunkt erst schwach ausgebildet. Nach einer weiteren Woche, also am Tag 14, war der Immunschutz über (neutralisierende) Antikörper und T-Zellen jedoch deutlich nachweisbar. Sieben Tage nach der zweiten Immunisierung (Boost) war der Antikörpertiter sogar noch etwas höher. Aus der Erfahrung mit Impfstoffen gegen andere Infektionskrankheiten weiß man, dass der Boost die IgG-Konzentration im Blut auf hohem Niveau hält, denn ohne den zweiten Piks würde der Antikörperspiegel bald wieder abfallen, weshalb das Impfregime unbedingt eingehalten werden muss. Durch den Boost wird außerdem die Spezifität und Bindungsstärke der Antikörper verbessert. Bereits zwei Wochen nach der Prime-Injektion ist also eine vorläufige Schutzwirkung über einen relativ hohen Antikörpertiter gegen das Spike-Protein vorhanden. Den Phase-I/II-Studien der zurzeit angewendeten COVID-19-Impfstoffe kann man entnehmen, dass durch die Boosterung keine weitere deutliche Erhöhung der Antikörperkonzentration auftritt, die Spiegel steigen nur noch leicht an. Der Immunschutz wird nur noch wenig verstärkt. Weshalb man, wie offiziell angegeben, genau 15 Tage nach der zweiten Impfung als vollständig Geimpfter gilt, ist zumindest aus den Phase-I/II-Studien der verschiedenen Vakzine nicht nachzuvollziehen.
Was kann die Immunreaktion stören?
Damit eine Impfung eine gute Schutzwirkung aufbaut, braucht man einerseits einen genügend immunogenen Impfstoff, andererseits müssen die immunologischen Prozesse ungestört ablaufen können. In das „immunologische Räderwerk“ können wir auf vielfältige Weise eingreifen, pharmazeutisch durch Arzneistoffe und nicht-pharmazeutisch durch unser Verhalten. Die pharmazeutischen Aspekte sind zumindest in der Theorie gut nachvollziehbar, da sie auf bekannten Mechanismen beruhen. Beispiel Immunsuppressiva: Dass Methotrexat die Anzahl der Lymphozyten reduziert und Glucocorticoide die Bildung von Zytokinen, ist klar. Immunsupprimierte reagieren auf Impfungen daher prinzipiell schwächer. Wie relevant diese Effekte im klinischen Alltag für die betroffene Person werden, wie gut also die Impfung „funktioniert“, lässt sich allerdings im Einzelfall nur schwer vorhersagen. Wenn man darauf angewiesen ist, eine Abschätzung der Immunantwort vorzunehmen, bleibt nur die individuelle Bestimmung des Antikörpertiters – aber auch hier muss man vorsichtig sein: Der Impfschutz korreliert zwar grundsätzlich mit dem Titer, die Korrelation ist aber nicht immer stark und die Angabe eines Schwellenwertes, ab dem definitiv ein Schutz besteht, ist nicht für alle Impfstoffe möglich.
Auch bei entzündungshemmenden und fiebersenkenden Analgetika kann man sich gut vorstellen, dass sie einen Einfluss auf den Impferfolg haben. Dieses Thema wurde in den letzten Monaten immer wieder auch in der Laienpresse diskutiert. Darf man nach einer COVID-19-Impfung Ibuprofen nehmen? Wenn ja, wann? Kann man nichtsteroidale Antirheumatika (NSAR) vielleicht prophylaktisch geben, um den potenziellen Nebenwirkungen vorzubeugen? Verständliche Fragen, auf die wir aber nur unzureichende Antworten haben, da die Datenlage sehr dünn ist. Die vorhandenen älteren Studien wurden natürlich mit anderen als den COVID-19-Impfstoffen durchgeführt, viele Aussagen beruhen also rein auf Analogieschlüssen.
NSAR greifen auf zahlreichen Ebenen recht umfangreich in das Entzündungsgeschehen ein und vermindern die Einwanderung von Leukozyten in das Muskelgewebe, die Antigenpräsentation durch antigenpräsentierende Immunzellen, die T- und B-Zell-Proliferation und auch die Antikörperbildung (s. Abb.).
Die Entzündungsreaktion spielt in den ersten Stunden nach der Injektion eine sehr wichtige Rolle für den Impferfolg. Gerötete, heiße Körperstellen können natürlich gekühlt werden. Allerdings werden dadurch alle biochemischen Reaktionen verlangsamt, also auch die Immunreaktion. Nimmt man andererseits NSAR vor der Impfung ein, um Nebenwirkungen vorzubeugen, kann die Impfreaktion tatsächlich abgeschwächt sein – zumindest wurde das 2009 in einer Studie an Kindern gezeigt, die in den 24 Stunden vor der Impfung drei Dosen an Paracetamol erhalten hatten. In der Paracetamol-Gruppe wurden geringere Antikörpertiter gemessen. Die entscheidende Frage nach dem Einfluss auf den Impfschutz wurde in der Studie allerdings nicht beantwortet. Die amerikanischen Centers for Disease Control and Prevention (CDC) empfehlen, auf die Einnahme von NSAR vor einer Impfung zu verzichten, weist aber auch auf die unzureichende Datenlage hin. Personen, die dauerhaft mit NSAR therapiert werden, sollten allerdings laut CDC die regelmäßige Einnahme nicht unterbrechen. Im Übrigen wird auch empfohlen, auf eine prophylaktische Verwendung von Antihistaminika zur Vorbeugung einer allergischen Reaktion zu verzichten. Eine Studie aus dem Jahr 2014 an jüngeren Erwachsenen zeigte, dass Paracetamol, sechs Stunden nach der Impfung gegeben, keine Auswirkung auf den Antikörpertiter hatte, bei gleichzeitiger Gabe aber schon. Der Eingriff ganz am Anfang des immunologischen Geschehens hat also einen messbaren Einfluss auf die Immunantwort. Ist das Geschehen nach einigen Stunden schon voll im Gange, ist kein Effekt mehr feststellbar. Zu den momentan verwendeten COVID-19-Impfstoffen auf mRNA- und DNA-Basis gibt es keine Studien zur Beeinflussung der Immunantwort durch NSAR. Bezüglich eines vermeintlichen Sicherheitsabstands von sechs Stunden ist aber unbedingt zu berücksichtigen, dass das Spike-Protein erst in ausreichender Menge exprimiert werden muss, bevor die eigentliche Immunantwort beginnen kann.
Wie sieht es mit den nicht-pharmazeutischen Einflüssen, also unseren Lebensgewohnheiten, auf die Immunantwort aus? Sportliche Betätigung und regelmäßige Saunabesuche führen nachweislich zu einer Steigerung der Abwehrbereitschaft unseres Körpers und wohl auch zu einer verlangsamten Alterung des Immunsystems. Dadurch könnte, zumindest theoretisch, der Impferfolg verbessert werden. Nach einer Impfung empfiehlt die Ständige Impfkommission (STIKO), stärkere körperliche Belastungen bei Totimpfstoffen für einige Tage und bei Lebendimpfstoffen für sieben Tage zu reduzieren. Ganz auf (leichtere) sportliche Aktivitäten zu verzichten, ist nicht nötig. Das gilt auch für den Saunabesuch: Nicht die höhere Temperatur ist das grundsätzliche Problem, sondern die dadurch entstehende körperliche Belastung.
Fazit
Um einen optimalen Impfschutz zu erreichen, tut man gut daran, in das „immunologische Räderwerk“, das durch den Piks gestartet wird, möglichst wenig einzugreifen und den Körper in Ruhe arbeiten zu lassen. Durch die Vakzine werden zwar ähnliche Prozesse wie bei einer echten Infektion angestoßen. Aber im Gegensatz zu einem Pathogen kann sich das Impfantigen im Körper nicht weiter vermehren, wodurch die Impfreaktion auch zeitlich sehr begrenzt ist. |
Literatur
Etminan M, Sodhi M, Ganjizadeh-Zavareh S. Should Antipyretics Be Used to Relieve Acute Adverse Events Related to COVID-19 Vaccines? Chest 2021;5:S0012-3692(21)00254-3, doi: https://doi.org/10.1016/j.chest.2021.01.080
Folegatti PM, Ewer KJ, Aley PK et al. Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. Lancet 2020;396:467-478
Jackson LA, Anderson EJ, Rouphael NG et al. An mRNA Vaccine against SARS-CoV-2 - Preliminary Report. N Engl J Med 2020;383:1920-1931
Prymula R, Siegrist CA, Chlibek R et al. Effect of prophylactic paracetamol administration at time of vaccination on febrile reactions and antibody responses in children: two open-label, randomised controlled trials. Lancet 2009;374:1339–1350
Sahin U, Muik A, Vogler I et al. BNT162b2 induces SARS-CoV-2-neutralising antibodies and T cells in humans. medRxiv preprint, doi: https://doi.org/10.1101/2020.12.09.20245175
Saleh E, Moody MA, Walter EB. Effect of antipyretic analgesics on immune responses to vaccination. Hum Vaccin Immunother 2016;12:2391-2402
Stephenson KE, Le Gars M, Sadoff J et al. Immunogenicity of the Ad26.COV2.S Vaccine for COVID-19. JAMA 2021;325:1535-1544
Valenzuela PL, Simpson RJ, Castillo-García A, Lucia A. Physical activity: A coadjuvant treatment to COVID-19 vaccination? Brain Behav Immun 2021;94:1-3
Weitere Beiträge des Pandemie Spezials in DAZ 2021, Nr. 23
- Schutz auch vor Delta-Variante? Was eine vollständige Immunisierung leisten kann
- Rückendeckung für die STIKO: 30 Fachgesellschaften und die AWMF betrachten Übergehen der Empfehlungen mit Sorge
- Keine Boosterung mit Vaxzevria nach TTS: Rote-Hand-Brief zum Vorgehen nach Auftreten eines Thrombose-Thrombozytopenie-Syndroms
- Epidemisch, pandemisch oder endemisch: Wann und wie werden wir die Corona-Krise überstehen?























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.