
- DAZ.online
- DAZ / AZ
- DAZ 21/2021
- Zielgerichtet und ...
Pharmakotherapie
Zielgerichtet und mitdurchschlagendem Erfolg
Teil 2: Fortschritte in der medikamentösen Therapie von Hauttumoren
Das maligne Melanom (MM) ist zwar seltener als das Basalzellkarzinom (BCC) und das Plattenepithelkarzinom (PEK), kann aber frühzeitiger metastasieren. Grundlage der großen Erfolge in der Therapie von weit fortgeschrittenen oder aufgrund von hereditären Erkrankungen häufig rezidivierenden Basalzellkarzinomen, Plattenepithelkarzinomen und malignen Melanomen ist zum einen die Entdeckung von für diese Tumoren sehr spezifischen Rezeptoren bzw. die Proliferation treibenden Signalketten und zum anderen die Bedeutung der Immuntherapie mittels des an den Rezeptor CTLA-4 der T-Lymphozyten bindenden Ipilimumab oder die an den PD-1-Rezeptor (PD-1 = Programmed Cell Death Protein 1) bindenden Pembrolizumab, Nivolumab und Cemiplimab sowie die an PD-1-Liganden der T-Lymphozyten bindenden Atezolizumab, Avelumab und Durvalumab. Die Entdeckung der besonderen Rolle der Immuntherapie ist zumeist gebunden an Tumoren mit besonders vielen Mutationen in den Tumorzellen. Das triff vor allem auf maligne Melanome, Plattenepithelkarzinome und den Merkelzelltumor (MCC) zu, einem seltener auftretenden neuroendokrinen Hauttumor. Das führte dazu, dass die amerikanische Zulassungsbehörde FDA das PD-1-bindende Pembrolizumab generell für alle Tumoren ab einer Mutationslast von 10/Megabase zuließ [55]. Nachdem die Wirksamkeit der einzelnen Pharmaka in der adjuvanten Therapie überzeugten, folgte die Entwicklung der sequenziellen oder gleichzeitigen Therapie mit gegen spezifische Zielstrukturen gerichteten Präparaten wie des BRAF-Antagonisten in Kombination mit MEK-Inhibitoren und der Immuntherapie durch Kombination von mindestens zwei Checkpoint-Inhibitoren gleichzeitig. Als gegenwärtige Standardtherapie kann daher zum einen die Immuntherapie entweder als Monotherapie mit Nivolumab, Pembrolizumab oder Ipilimumab bzw. die Kombination insbesondere von Nivolumab und Ipilimumab einerseits und bei mutiertem BRAF die Kombination aus BRAF- mit MEK-Inhibitoren angesehen werden [40]. In der weiteren Entwicklung steht gegenwärtig vor allem die neoadjuvante Therapie im Vordergrund des Interesses, bei der Medikamente vor dem operativen Eingriff gegeben werden, um die Operation möglichst zu begrenzen.
Hemmung der RAF-Kinase
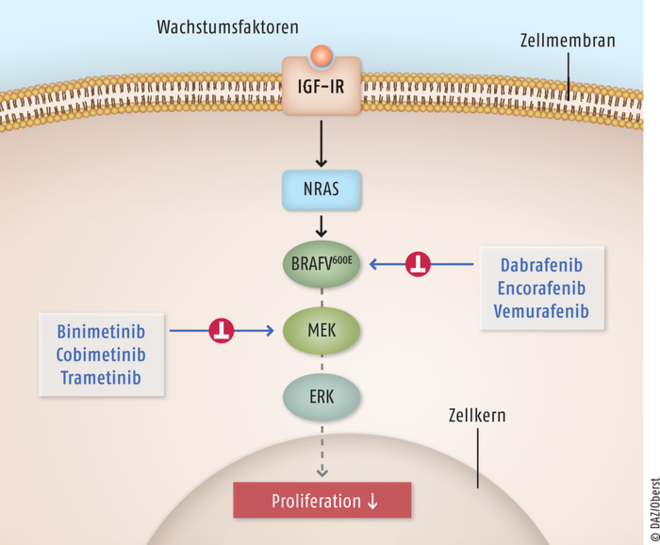
Das BRAF-Gen (proto-oncogene B-Raf) kodiert für das Protein Serin/Threonin-Proteinkinase B-Raf. BRAF gehört zur Familie RAF/mil der Serin/Threonin-Proteinkinasen und greift regulierend in den MAPK-(oder ERK-)Signalweg ein (MAPK = Mitogen-aktivierte Proteinkinasen, ERK = extracellular-signal regulated kinases). Etwa 55% der malignen Melanome haben eine Mutation in dem BRAF-Gen und in 90% davon handelt es sich um die V600K- oder V600E-Mutation, was den MAPK-Signalweg konstitutiv bzw. dauerhaft aktiviert [5]. Diese Signalkaskade RAS-RAF-MEK-ERK spielt eine wesentliche Rolle in der Proliferation von Zellen. Zur Aktivierung von BRAF führende Mutationen wurden im malignen Melanom 2002 zuerst entdeckt und mit Vemurafenib wurde ein niedermolekularer Inhibitor von BRAF 2011 von der FDA zur Behandlung des malignen Melanoms zugelassen. Der erste Hemmer der Proteinkinase MEK (Mitogen-aktivierte Proteinkinase-Kinase), Trametinib, wurde 2013 zugelassen (Abb. 1) [41].
Abb. 1: Die Hemmung von Tyrosin-Kinase-abhängigen Signalwegen als gezielte Therapie bei malignem Melanom ist erfolgversprechend, da in entarteten Zellen Kinase-abhängige Signalwege häufig überaktiv sind. BRAF: B-Raf proto-oncogen Serin/Threonin-Kinase; NRAS: Neuroblastoma RAS; MEK: Mitogen-aktivierte Proteinkinase; ERK: extrazellulär Signal-regulierte Kinase
Vemurafenib
Vemurafenib (Zelboraf®) ist eine niedermolekulare Substanz, die oral gegeben wird und eine Halbwertszeit von 57 Stunden hat. Der Name kommt von der Zielstruktur V600E mutated BRAF. Es interagiert auch mit der selteneren Mutation V600K. Der BRAF-Inhibitor wird von CYP3A4 metabolisiert. Er bindet auch an den Arylhydrocarbon-Rezeptor und induziert dadurch CYP1A2 [22, 66]. Eine mögliche Wechselwirkung kann vor allem mit dem als Muskelrelaxans benutzten α2-adrenergen Agonisten Tizanidin bestehen, das nur eine geringe therapeutische Breite besitzt [19]. Voraussetzung für seine Wirksamkeit ist die entsprechende Mutation im Melanom, es wirkt also nicht, wenn das Melanom das normale Gen BRAF exprimiert. Ein besonderes Problem ist, dass Melanome in vielen Fällen innerhalb kurzer Zeit – zumeist innerhalb von sechs Monaten – resistent werden [15]. Mögliche Ursachen sind eine NRAS-Mutante, Mutationen der Proteinkinase MEK, verstärkte Expression des Wachstumsrezeptors PDGFR-B oder alternative Signalwege wie PI3K/Akt, mTOR und STAT3 [15]. Eine Verzögerung dieser Resistenzbildung kann mit der zusätzlichen Gabe der MEK-Inhibitoren Trametinib oder Cobemitinib erreicht werden [16].
Dabrafenib
Dabrafenib (Tafinlar®) ist ebenfalls eine niedermolekulare Substanz, die sowohl das normale BRAF wie auch das mutierte BRAF hemmt. Jedoch ist die Hemmung des mutierten BRAF bis zu fünfmal stärker, sodass es zur Behandlung von Melanomen mit dieser Mutation verwendet werden kann. Es hat eine Halbwertszeit von acht Stunden und wird über die Enzyme CYP2C8 und CYP3A4 metabolisiert. Wechselwirkungen mit CYP2C8- und/oder CYP3A4-induzierenden Substanzen können Dabrafenib daher in seiner Aktivität hemmen [19]. Die Resistenzbildung ist ähnlich wie bei Vemurafenib. Unerwünschte Wirkungen umfassen Hyperkeratosen, Kopfschmerzen, Arthralgie, Papillome und Alopezie. Auch bei Dabrafenib sieht man bei ca. 10% der Patienten nach ca. zwei Monaten das Auftreten von Plattenepithelkarzinomen, was man durch Kombination mit dem MEK-Inhibitor Trametinib auf ca. sieben Monate herauszögern kann, und die Häufigkeit sinkt auf ca. 3% [16].
Entsprechend bevorzugt man bei Behandlung des malignen Melanoms mit BRAF-Mutationen die BRAF-Inhibitoren in Kombination mit MEK-Inhibitoren, zumal damit auch das Auftreten von Plattenepithelkarzinomen bei alleiniger BRAF-Inhibition vorgebeugt werden kann [61]. Dabei haben sich diese Kombinationen ergeben:
- Dabrafenib mit Trametinib,
- Vemurafenib mit Cobimetinib und
- Encorafenib mit Binimetinib.
Während die Wirksamkeit gegen den Tumor bei den Kombinationen ähnlich ist, unterscheiden sie sich in ihren unerwünschten Effekten. So stehen bei der Kombination Dabrafenib mit Trametinib Fieberschübe und unter Vemurafenib mit Cobimetinib Exantheme, vor allem fototoxische Reaktionen, im Vordergrund. Vemurafenib erhöht die Lichtempfindlichkeit der Haut und kann zu fototoxischen Reaktionen führen, dem mit Sonnenschutzsalben mit hohem Lichtschutzfaktor vorgebeugt werden kann [16]. Bei allen Kombinationen kann Übelkeit auftreten, vor allem aber kommt es in 8% zu linksventrikulären kardialen Dysfunktionen bzw. QT-Zeit-Verlängerungen (4%), weshalb ein engmaschiges kardiologisches Monitoring notwendig ist. Eine weitere schwerwiegende Komplikation kann eine seröse Retinopathie sein, für die ein Netzhautvenenverschluss in der Anamnese ein Risikofaktor darstellt. Die mediane Überlebenszeit der Patienten mit einem metastasierenden Melanom beträgt bei kombinierter BRAF/MEK-Inhibition 22 bis 25 Monate und die Drei- bis Fünf-Jahres-Überlebenszeit beträgt 40% [57]. Ein Problem bleibt die Resistenzentwicklung durch Reaktivierung des MAPK-Signalwegs bzw. Aktivierung von alternativen Signalwegen über PI3K-AKT durch BRAF-Genamplifikationen oder MEK1/MEK2 Mutationen [15].
Immuncheckpoint-Hemmung
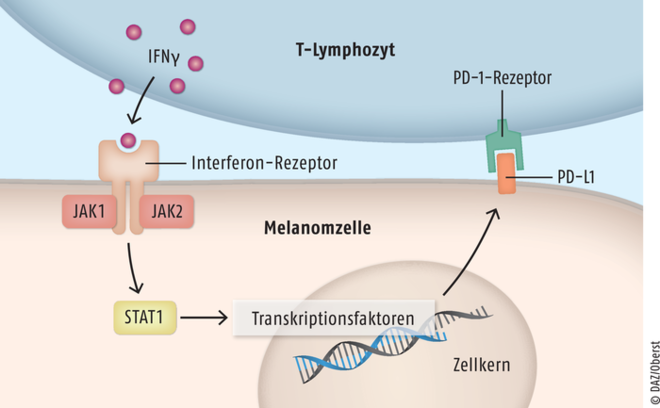
Die Wirkstoffe dieser Gruppe haben in den letzten fünf bis zehn Jahren die wesentlichen Erfolge insbesondere in der Behandlung des malignen Melanoms, aber auch des Plattenepithelkarzinoms und des Merkelzelltumors gebracht und dazu geführt, dass die Fünf-Jahres-Überlebenszeit auch schon weiter fortgeschrittener maligner Melanome von unter 20% auf über 50% angestiegen ist [4, 18, 36, 70]. Interessanterweise ist dieses Therapieprinzip vor allem bei Tumoren mit hoher Mutationsrate besonders erfolgreich, was für die zumeist UV-abhängig entstandenen Tumore der Haut gilt [55]. Grundlage dieser Therapie ist die Entdeckung von Rezeptoren, Liganden und deren Funktion in der Kontrolle der T-Zell-Aktivierung, dem Immuncheckpoint [67]. Sie führten zu Medikamenten, die es T-Lymphozyten erleichtert, Tumorzellen zu erkennen und zu zerstören [41]. Die Antigenerkennung von T-Lymphozyten erfolgt nicht nur über den T-Zell-Rezeptor, sondern wird bei dem Kontakt des T-Lymphozyten mit der Antigen-präsentierenden Zelle ergänzt durch kostimulierende Rezeptoren und Liganden, die T-Lymphozyten in Abhängigkeit von der Antigenerkennung aktivieren und damit augmentierende Wirkungen besitzen (Abb. 3). Um wiederum eine zu starke Stimulierung des T-Lymphozyten zu hemmen, was zu chronischen autoimmunabhängigen Entzündungen führen würde, exprimiert der aktivierte T-Lymphozyt hemmende Signale. Ein Beispiel ist die Interaktionen zwischen den T-Zelloberflächenproteinen CD28 und B7. Der aktivierte T-Lymphozyt exprimiert nun das hemmende zytotoxische T-Lymphozyten-assoziierte Protein 4 (CTLA-4) – einer homologen Struktur zu CD28 mit höherer Affinität zu B7 (67]. Auch das Programmed Cell Death Protein 1 (PD-1), ein weiteres die Interaktion von aktivierten T-Lymphozyten hemmendes Molekül, bindet mit dem PD-1-Liganden der Antigen-präsentierenden Zelle, was die T-Lymphozyten deaktiviert.
Abb. 3: PD1/PD1-Ligand-abhängige T-Zellaktivierung Der PD-1-Rezeptor wird auf aktivierten T-Lymphozyten gebildet und verhindert im Zusammenspiel mit seinem Ligand PD-L1 überschießende Immunreaktionen. PD-1-Rezeptor und PD-L1 werden Interferon-γ(IFN γ)-abhängig gebildet. Durch IFN γ wird der JAK/STAT-Signalweg aktiviert. Auch Tumorzellen nutzen den PD-1-Signalweg, indem sie PD-L1 exprimieren: T-Zellen erhalten vom Tumor das Signal zur eigenen Inaktivierung statt zur Zerstörung der Tumorzellen. Die Blockade der Bindungsstelle mit einem PD-1-Antikörper kann die PD-1-vermittelte Immunbremse lösen und die antitumorale Immunantwort reaktivieren (PD-1: Programmed Cell Death Protein 1).
Ipilimumab
Ipilimumab (Yervoy®) ist ein CTLA-4-hemmender humaner monoklonaler IgG1-Antikörper, der bei Verwendung von Patienten mit malignem Melanom bereits in ersten Studien so überzeugte, dass er 2011 von der FDA zur Behandlung des malignen Melanoms zugelassen wurde [66]. Ipilimumab bindet und hemmt CTLA-4.
Ipilimumab wird intravenös verabreicht und besitzt eine lineare Pharmakokinetik im Bereich von 0,3 bis 10 mg/kg Körpergewicht mit einer Halbwertszeit von 15,4 Tagen. Die Dosierung ist entweder 3 mg/kg Körpergewicht i. v. über 90 Minuten alle drei Wochen viermal bei Patienten mit Metastasen und 10 mg/kg Körpergewicht alle zwölf Wochen über drei Jahre bzw. bis zum Erkrankungsrezidiv oder zu schweren unerwünschten Wirkungen [66]. Nachdem sich gezeigt hat, dass die Dosierung mit 10 mg/kg Körpergewicht keine Vorteile gegenüber 3 mg/kg Körpergewicht bringt, wurde die Therapie mit Ipilimumab in den USA – nicht in der EU – zur adjuvanten Therapie des malignen Melanoms im Stadium III zugelassen. Inzwischen gibt es Beobachtungen von Überlebenszeiten, die länger als zehn Jahre sind [57].
Nivolumab
Nivolumab (Opdivo®) ist ein humaner monoklonaler IgG4-Antikörper, der die Bindung von PD-1-Rezeptoren an seinen Liganden blockiert. Nivolumab hat eine Halbwertszeit von 26,7 Tagen und wird alle zwei Wochen intravenös in einer Dosierung von 3 mg/kg Körpergewicht über zwei Monate verabreicht bis zum Erkrankungsrezidiv bzw. nicht akzeptablen Nebenwirkungen. In dieser Dosierung zeigte es sich überlegen der Behandlung mit Ipilimumab 10 mg/kg Körpergewicht, und es ist besser verträglich. Es wurde von der FDA 2014 bereits nach Vorliegen der Daten von Phase-IB-Studien zur Behandlung des fortgeschrittenen malignen Melanoms zugelassen, in der EU im August 2018 [66].
Pembrolizumab
Pembrolizumab (Keytruda®), das früher auch Lambrolizumab genannt wurde, ist ein humanisierter monoklonaler IgGκ-Isotyp-Antikörper, der wie Nivolumab die Bindung zwischen PD-1-Rezeptoren und seinen Liganden hemmt. Es ist ein humanisierter Antikörper mit murinem Anteil und bindet an den PD-1-Rezeptor des Menschen und anderer Primaten, kaum aber an PD-1-Rezeptoren von Ratte oder Maus. Pembrolizumab wird zu 2 mg/kg Körpergewicht bzw. fixer Dosis von 200 mg intravenös über 30 Minuten alle drei Wochen gegeben. Die Halbwertszeit beträgt 26 Tage. Es ist bei fortgeschrittenen Melanomerkrankungen nach Ipilimumab-Behandlungen indiziert [66]. Eine Zulassung erfolgte durch die EMA im Januar 2019.
Cemiplimab
Cemiplimab (Libtayo®) ist ein weiterer monoklonaler Antikörper, der wie Nivolumab und Pembrolizumab an den Immun-Checkpoint-Rezeptor PD-1 bindet und ihn dadurch hemmt. Cemiplimab ist zur medikamentösen Systemtherapie beim Plattenepithelkarzinom im fortgeschrittenen Stadium indiziert [52, 54]. Unter fortgeschrittenem Stadium versteht man in diesem Fall Tumoren, die nicht mehr allein operativ oder durch Bestrahlung behandelbar sind. Das kann bei lokal fortgeschrittenem Stadium ein sehr großer Primärtumor oder ein metastasierender Tumor sein [38]. Einzig zugelassen für diese Indikation ist Cemiplimab. Es weist beim Plattenepithelkarzinom eine Ansprechrate von 44 bis 50% auf, die über eine Dauer von deutlich über zwölf Monaten erhalten bleibt [38]. Auch zur Behandlung des lokal fortgeschrittenen oder metastasierenden Basalzellkarzinoms wurde Cemiplimab durch die FDA am 9. Februar 2021 zugelassen, wenn Hedgehog-Inhibitoren nicht zufriedenstellend wirken bzw. kontraindiziert sind.
Atezolimumab (Tecentriq®), Avelumab (Bavencio®) und Durvalumab (Imfinzi®) binden an die PD-1-Liganden der T-Lymphozyten. In der Dermatologie spielt vor allem Avelumab eine Rolle, das zur Behandlung des Merkelzellkarzinoms zugelassen ist [14, 63]. Durch die PD-1-Liganden-Bindung wird die T-Lymphozytenhemmung aufgehoben. Es wird in einer Dosis von 10 mg/kg Körpergewicht i. v. alle drei Wochen gegeben, auch eine fixe Dosierung von 800 mg ist möglich [63].
Hemmung des Hedgehog-Signalwegs
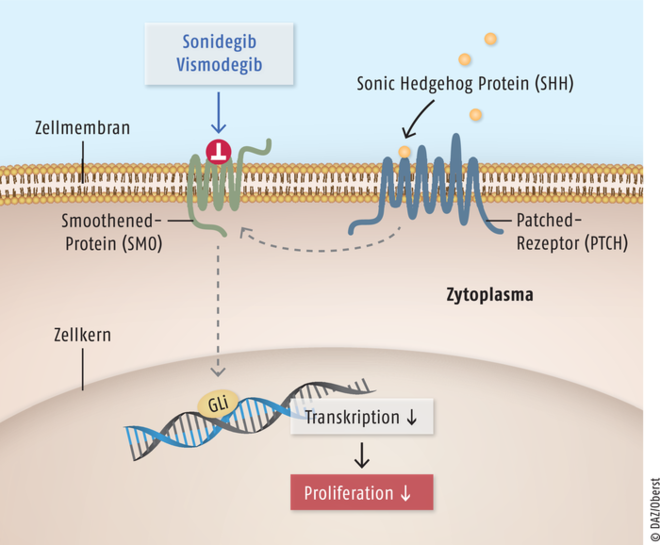
Eine wesentliche Erkenntnis zum Verständnis der Pathophysiologie des Basalzellkarzinoms war die Beobachtung, dass sowohl bei Patienten mit einem Gorlin-Goltz-Syndrom, bei dem Basalzellkarzinom-artige Tumoren erblich bedingt auftreten, wie auch bei normalen Basalzellkarzinomen Mutationen in Genen für Proteine des Hedgehog-Signalweges vorkommen, die zu einer verstärkten Proliferation der Zellen des Basalzellkarzinoms führen [3, 8] (Abb. 2). Der Name Hedgehog (Igel) kommt von dem primären Nachweis dieses Signalweges bei der Fruchtfliege (Drosophila melanogaster), bei der der Ausfall dieses Signalweges zum fehlerhaften Wachstum der Flügel führt, sodass die Fruchtfliege wie ein kleiner Igel aussieht.
Abb. 2: Durch Mutationen im Gen für das Sonic Hedgehog Protein (SHH), den Patched-Rezeptor (PTCH) oder das Smoothened-Protein (SMO) fehlt die von SHH bewirkte Hemmung auf SMO. Inhibitoren des Hedgehog-Signalweges reduzieren die verstärkte Zellproliferation, die zum Basalzellkarzinom führen kann. (GLi: Transkriptionsfaktor)
Vismodegib
Vismodegib (Erivedge®) ist eine Substanz, die den Hedghog-Signalweg durch Inhibition des Smoothens-Hedgehog(SMO)-Rezeptor wirkt und zur Behandlung der Tumoren bei Gorlin-Goltz-Syndrom wie auch des rezidivierenden bzw. metastasierenden oder durch sein Wachstum inoperablen Basalzellkarzinoms angewendet wird [9, 35, 36]. Die wichtigsten unerwünschten Wirkungen resultieren durch andere wichtige Funktionen des Hedgehog-Signalweges bei Menschen wie der Geschmackswahrnehmung und dem Haarwachstum. Effekte der Hemmung sind daher Geschmacksstörungen und Sistieren des Haarwachstums. Weitere Nebenwirkungen umfassen Übelkeit, Diarrhöen, Muskelkrämpfe und Müdigkeit.
Sonidegib
Wirkungsweise und klinisch-pharmakologische Eigenschaften von Sonidegib (Odomzo®) entsprechen denen von Vismodegib.
Kombination von Anti-PD-1 und Anti-CTLA4
Die Kombination von Ipilimumab und Nivolumab oder Pembrolizumab hat besonders eindrucksvolle Erfolge bei fortgeschrittenen Melanomen gezeigt. Die Vier-Jahres-Überlebenszeit liegt bei 53% im Vergleich zu 47% bei Monotherapie mit Nivolumab. Dabei liegt bei Kombinationsbehandlungen die Ein- und Zwei-Jahres-Überlebensrate bei 94 bzw. 88% [40]. Allerdings treten auch häufiger Nebenwirkungen auf und sie manifestieren sich früher. So beobachtete man die zum Glück seltene, aber potenziell fatale Myokarditis bei der Kombinationsbehandlung in 0,17% der behandelten Patienten und unter Nivolumab allein in 0,01% der Patienten [2, 32]. Durch die T-Zell-Aktivierungen sind immuntoxikologische Entzündungsreaktionen die häufigsten unerwünschten Wirkungen in bis zu 73,6% der Behandlungen, schwere Nebenwirkungen treten bei 15 bis 30% auf, bei ca. 10% führten sie zum Therapieabbruch. Bei den Kombinationsbehandlungen z. B. von Ipilimumab und Nivolumab treten Nebenwirkungen noch häufiger auf (in ca. 95%), schwere Nebenwirkungen in 54% der Fälle, in ca. 40% führten sie zu einem Therapieabbruch. Auch treten die Nebenwirkungen früher auf als bei der Monotherapie. Im Vordergrund in Bezug auf die Häufigkeit stehen Pruritus, Vitiligo und Exantheme der Haut, aber auch – seltener – bullöse Hautreaktionen einschließlich Stevens-Johnson-Syndrom und toxische epidermale Nekrolyse. Weitere Nebenwirkungen umfassen Diarrhöen bei Colitis, Myositiden, Hepatitiden, Pneumonitiden und Nephritiden, die in 2,2% bis zu einem akuten Nierenversagen führen können. Schwere Nebenwirkungen, die zumeist rasches Handeln erfordern und eine entsprechende Infrastruktur im Management der Therapie voraussetzen, umfassen Kardiotoxizität, Endokrinopathien durch Hypophysitiden und Hypo- und Hyperthyreoidismus [32]. Auch durch das Nervensystem kann es zu seltenen, aber potenziell lebensbedrohlichen Komplikationen wie einem Guillain-Barré-Syndrom, Myasthenia gravis, Enzephalopathie oder nichtinfektiösen Meningopathien kommen. Die Behandlung besteht je nach Schwere in der Gabe von Glucocorticoiden, Symptom-spezifischen Maßnahmen bis zum Sistieren der Behandlung [32]. Wegen der gerade bei den Kombinationen wie z. B. Nivolumab und Ipilimumab häufigeren Nebenwirkungen möchte man Biomarker als Kriterien für die Kombinationsbehandlung objektivieren. Gegenwärtig stehen im Vordergrund erhöhte Lactatdehydrogenase-Werte, Melanom der Schleimhaut als Erstmanifestation, asymptomatische Hirnmetastasen und eine PD-L1-Expression auf weniger als 1% der Melanomzellen [70]. Zusammenfassend führt die Behandlung mit Checkpoint-Inhibitoren insbesondere bei den Kombinationstherapien in fast allen Fällen zu unerwünschten Wirkungen, die aber in vielen Fällen milde verlaufen oder mit Glucocorticoiden beherrscht werden können. Die allerdings selteneren schweren Nebenwirkungen erfordern ein sorgfältig geplantes, interdisziplinär organisiertes rasch zur Verfügung stehendes Management.
Neoadjuvante Therapie
Die großen Erfolge in der Melanombehandlung mit BRAF-Antagonisten oder der Immuntherapie mittels Checkpoint-Inhibitoren haben zum Konzept einer neoadjuvanten Therapie geführt, das heißt, einer konservativen Therapie vor der chirurgischen Behandlung eines diagnostizierten Melanoms. Inzwischen liegen dazu erste vielversprechende Ergebnisse aus sechs Studien vor, deren Ergebnisse kürzlich zusammengefasst dargestellt wurden [45]. Die dabei erzielten Ergebnisse bei Melanomen im Metastasierungsstadium waren sowohl bezüglich einer pathologisch bestätigten kompletten Remission wie auch der rezidivfreien Überlebenszeit von zwei Jahren sehr ermutigend. 40% der behandelten Patienten wiesen eine komplette, pathologisch bestätigte Remission auf, 47% bei BRAF/MEK-Therapie und 33% bei der Immuntherapie. Bei Patienten mit einer solchen kompletten Rückbildung des Melanoms und seiner Metastasen waren 89% anschließend über zwei Jahre rezidivfrei [45]. |
Literatur
[1] Amann PM, Merk HF, Baron JM. Retinoide in der Dermatopharmakologie. Hautarzt 2014;65(2):98-105
[2] Angelaki A, Lampropoulou DI, Aravantinos G. Immune-related dermatologic toxicities: to make a long story short. Cutan Ocul Toxicol 2020;39(1):10-12
[3] Athar M, Li C, Kim AL, Spiegelman VS, Bickers DR. Sonic hedgehog signaling in Basal cell nevus syndrome. Cancer Res 201415;74(18):4967-4975
[4] Barrios DM, Do MH, Phillips GS, Postow MA, Akaike T, Nghiem P, Lacouture ME. Immune checkpoint inhibitors to treat cutaneous malignancies. J Am Acad Dermatol 2020;83(5):1239-1253
[5] Bastian BC. The molecular pathology of melanoma: an integrated taxonomy of melanocytic neoplasia. Annu Rev Pathol 2014;9:239-271
[6] Bickers DR, Keogh L, Rifkind AB, Harber LC, Kappas A. Studies in porphyria. VI. Biosynthesis of porphyrins in mammalian skin and in the skin of porphyric patients. J Invest Dermatol 1977;68(1):5-9
[7] Blauvelt A, Kempers S, Lain E, Schlesinger T, Tyring S, Forman S, Ablon G, Martin G, Wang H, Cutler DL, Fang J, Kwan MR; Phase 3 Trials of Tirbanibulin Ointment for Actinic Keratosis. Phase 3 Tirbanibulin for Actinic Keratosis Group. N Engl J Med 2021;384(6):512-520
[8] Cameron MC, Lee E, Hibler BP, Barker CA, Mori S, Cordova M, Nehal KS, Rossi AM. Basal cell carcinoma: Epidemiology; pathophysiology; clinical and histological subtypes; and disease associations. J Am Acad Dermatol 2019;80(2):303-317
[9] Cameron MC, Lee E, Hibler BP, Giordano CN, Barker CA, Mori S, Cordova M, Nehal KS, Rossi AM. Basal cell carcinoma: Contemporary approaches to diagnosis, treatment, and prevention. J Am Acad Dermatol 2019;80(2):321-339
[10] Chen AC, Martin AJ, Choy B, Fernández-Peñas P, Dalziell RA, McKenzie CA, Scolyer RA, Dhillon HM, Vardy JL, Kricker A, St George G, Chinniah N, Halliday GM, Damian DL. A Phase 3 Randomized Trial of Nicotinamide for Skin-Cancer Chemoprevention. N Engl J Med 2015 22;373(17):1618-1626
[11] Cornejo CM, Jambusaria-Pahlajani A, Willenbrink TJ, Schmults CD, Arron ST, Ruiz ES. J Field cancerization: Treatment. Am Acad Dermatol 2020 Sep;83(3):719-730
[12. Diepgen TL. Neue Entwicklungen in der Berufsdermatologie. J Dtsch Dermatol Ges 2016 Sep;14(9):875-90
[13] Dillaha CJ, Jansen GT, Honeycutt WM, Bradford AC. Selective cytotoxic effect of topical 5-Fluorouracil. Arch Dermatol 1963;88:247-256
[14] Drusio C, Becker JC, Schadendorf D, Ugurel S. Merkelzellkarzinom. Hautarzt 2019;70(3):215-227
[15] Dulgar O, Kutuk T, Eroglu Z. Mechanisms of Resistance to BRAF-Targeted Melanoma Therapies. Am J Clin Dermatol 2021;22(1):1-10
[16] Dummer R, Hauschild A, Santinami M, Atkinson V, Mandalà M, Kirkwood JM, Chiarion Sileni V, Larkin J, Nyakas M, Dutriaux C, Haydon A, Robert C, Mortier L, Schachter J, Lesimple T, Plummer R, Dasgupta K, Gasal E, Tan M, Long GV, Schadendorf D. Five-Year Analysis of Adjuvant Dabrafenib plus Trametinib in Stage III Melanoma. N Engl J Med 2020;383(12):1139-1148
[17] Eberlein B, Biedermann T, Hein R, Posch C. Photosensitivität unter Vemurafenib. J Dtsch Dermatol Ges 2020;18(10):1079-1084
[18] Geisler AN, Phillips GS, Barrios DM, Wu J, Leung DYM, Moy AP, Kern JA, Lacouture ME. Immune checkpoint inhibitor-related dermatologic adverse events. J Am Acad Dermatol 2020;83(5):1255-1268
[19] Geisslinger G, Menzel S. Wenn Arzneimittel wechselwirken. Wissenschaftliche Verlagsgesellschaft Stuttgart 2017
[20] Gellrich FF, Hüning S, Beissert S, Eigentler T, Stockfleth E, Gutzmer R, Meier F. Medical treatment of advanced cutaneous squamous-cell carcinoma. J Eur Acad Dermatol Venereol 2019;33(Suppl8):38-43
[21] Gollnick H, Dirschka T, Ostendorf R, Kerl H, Kunstfeld R. Long-term clinical outcomes of imiquimod 5% cream vs. diclofenac 3% gel for actinic keratosis on the face or scalp: a pooled analysis of two randomized controlled trials. J Eur Acad Dermatol Venereol 2020;34(1):82-89
[22] Hauschild A, Kähler KC, Egberts F. Modern treatment modalities in actinic keratoses of the skin. Dtsch Med Wochenschr 2006;131(9):447-452
[23] Hawerkamp HC, Kislat A, Gerber PA, Pollet M, Rolfes KM, Soshilov AA, Denison MS, Momin AA, Arold ST, Datsi A, Braun SA, Oláh P, Lacouture ME, Krutmann J, Haarmann-Stemmann T, Homey B, Meller S. Vemurafenib acts as an aryl hydrocarbon receptor antagonist: Implications for inflammatory cutaneous adverse events. Allergy 2019;74(12):2437-2448
[24] Heidelberger C. Fluorinated pyrimidines. Prog Nucleic Acid Res Mol Biol 1965;4:1-50
[25] Heppt MV, Steeb T, Szeimies RM, Berking C: Aktinische Keratosen. Hautarzt 2020;71:588-596
[26] Ikediobi O. Pharmacogenomics of Fluoropyrimidines-A Personalized Approach for Treating and Preventing Keratinocyte Carcinomas. JAMA Dermatol 2021;157(3):357-358
[27] Jacobs S, Grussendorf-Conen EI, Rösener I, Rübben A. Molecular analysis of the effect of topical imiquimod treatment of HPV 2/27/57-induced common warts. Skin Pharmacol Physiol 2004;17(5):258-266
[28] Jansen MHE, Mosterd K, Arits AHMM, Roozeboom MH, Sommer A, Essers BAB, van Pelt HPA, Quaedvlieg PJF, Steijlen PM, Nelemans PJ, Kelleners-Smeets NWJ. Five-Year Results of a Randomized Controlled Trial Comparing Effectiveness of Photodynamic Therapy, Topical Imiquimod, and Topical 5-Fluorouracil in Patients with Superficial Basal Cell Carcinoma. J Invest Dermatol 2018;138(3):527-533
[29] Jansen MHE, Kessels JPHM, Nelemans PJ, Kouloubis N, Arits AHMM, van Pelt HPA, Quaedvlieg PJF, Essers BAB, Steijlen PM, Kelleners-Smeets NWJ, Mosterd K. Randomized Trial of Four Treatment Approaches for Actinic Keratosis. N Engl J Med 2019;380(10):935-946
[30] Jarvis B, Figgitt DP. Am J Clin Dermatol. Topical 3% diclofenac in 2.5% hyaluronic acid gel: a review of its use in patients with actinic keratoses 2003;4(3):203-213
[31] Johnson MR, Hageboutros A, Wang K, High L, Smith JB, Diasio RB. Life-threatening toxicity in a dihydropyrimidine dehydrogenase-deficient patient after treatment with topical 5-fluorouracil. Clin Cancer Res 1999;5(8):2006-11
[32] Kähler KC, Hassel JC, Heinzerling L, Loquai C, Thoms KM, Ugurel S, Zimmer L, Gutzmer R für das Komitee „Kutane Nebenwirkungen“ der Arbeitsgemeinschaft Dermatologische Onkologie (ADO). Nebenwirkungsmanagement bei Immun-Checkpoint-Blockade durch CTLA-4- und PD-1-Antikörper beim metastasierten Melanom – ein Update. J Dtsch Dermatol Ges 2020;18(6):582-609
[33] Kamath P, Darwin E, Arora H, Nouri K. A Review on Imiquimod Therapy and Discussion on Optimal Management of Basal Cell Carcinomas. Clin Drug Investig 2018 Oct;38(10):883-899
[34] Kraemer KH, DiGiovanni JJ, Moshell AN, Tarone RE, Peck GL. Prevention of Skin Cancer in Xeroderma Pigmentosum with the Use of Oral Isotretinoin New Engl J Med 1988;318:1633-1637
[35] Lang BM, Balermpas P, Bauer A, Blum A, Brölsch GF, Dirschka T, Follmann M, Frank J, Frerich B, Fritz K, Hauschild A, Heindl LM, Howaldt HP, Ihrler S, Kakkassery V, Klumpp B, Krause-Bergmann A, Löser C, Meissner M, Sachse MM, Schlaak M, Schön MP, Tischendorf L, Tronnier M, Vordermark D, Welzel J, Weichenthal M, Wiegand S, Kaufmann R, Grabbe S. Basalzellkarzinom der Haut – Teil 2: Therapie, Prävention und Nachsorge. S2k-Leitlinie. J Dtsch Dermatol Ges 2019;17(2):214-231
[36] Lang BM, Grabbe S. Diagnostik und Therapie des Basalzellkarzinoms. Hautarzt 2020;71:580-587
[37] Larkin J, Chiarion-Sileni V, Gonzalez R, Grob JJ, Rutkowski P, Lao CD, Cowey CL, Schadendorf D, Wagstaff J, Dummer R, Ferrucci PF, Smylie M, Hogg D, Hill A, Márquez-Rodas I, Haanen J, Guidoboni M, Maio M, Schöffski P, Carlino MS, Lebbé C, McArthur G, Ascierto PA, Daniels GA, Long GV, Bastholt L, Rizzo JI, Balogh A, Moshyk A, Hodi FS, Wolchok JD. Five-Year Survival with Combined Nivolumab and Ipilimumab in Advanced Melanoma. N Engl J Med 2019;381(16):1535-1546
[38] Leiter U, Gutzmer R, Alter M, Ulrich C, Meiwes A, Heppt MV, Steeb T, Berking C, Lonsdorf AS, Sachse MM, Garbe C, Hillen U. Kutanes Plattenepithelkarzinom Hautarzt 2020;71(8):597-606
[39] Leiter U, Heppt MV, Steeb T, Amaral T, Bauer A, Becker JC, Breitbart E, Breuninger H, Diepgen T, Dirschka T, Eigentler T, Flaig M, Follmann M, Fritz K, Greinert R, Gutzmer R, Hillen U, Ihrler S, John SM, Kölbl O, Kraywinkel K, Löser C, Nashan D, Noor S, Nothacker M, Pfannenberg C, Salavastru C, Schmitz L, Stockfleth E, Szeimies RM, Ulrich C, Welzel J, Wermker K, Garbe C, Berking C. J Dtsch Dermatol Ges. S3-Leitlinie Aktinische Keratose und Plattenepithelkarzinom der Haut – Kurzfassung, Teil 2: Epidemiologie, chirurgische und systemische Therapie des Plattenepithelkarzinoms, Nachsorge, Prävention und Berufskrankheit. 2020;18(4):400-413
[40] Lodde G, Zimmer L, Livingstone E, Schadendorf D, Ugurel S. Malignes Melanom. Hautarzt 2020;71(1):63-77
[41] Luke JJ, Flaherty KT, Ribas A, Long GV. Targeted agents and immunotherapies: optimizing outcomes in melanoma. Nat Rev Clin Oncol 2017;14(8):463-482
[42] Markham A, Duggan S Tirbanibulin: First Approval . Drugs 2021;81(4):509-513
[43] Matta MK, Zusterzeel R, Pilli NR, Patel V, Volpe DA, Florian J, Oh L, Bashaw E, Zineh I, Sanabria C, Kemp S, Godfrey A, Adah S, Coelho S, Wang J, Furlong LA, Ganley C, Michele T, Strauss DG. Effect of Sunscreen Application Under Maximal Use Conditions on Plasma Concentration of Sunscreen Active Ingredients: A Randomized Clinical Trial. JAMA 2019;321(21):2082-2091
[44] Matta MK, Florian J, Zusterzeel R, Pilli NR, Patel V, Volpe DA, Yang Y, Oh L, Bashaw E, Zineh I, Sanabria C, Kemp S, Godfrey A, Adah S, Coelho S, Wang J, Furlong LA, Ganley C, Michele T, Strauss DG. Effect of Sunscreen Application on Plasma Concentration of Sunscreen Active Ingredients: A Randomized Clinical Trial. JAMA 2020;323(3):256-267
[45] Menzies AM, Amaria RN, Rozeman EA, Huang AC, Tetzlaff MT, van de Wiel BA, Lo S, Tarhini AA, Burton EM, Pennington TE, Saw RPM, Xu X, Karakousis GC, Ascierto PA, Spillane AJ, van Akkooi ACJ, Davies MA, Mitchell TC, Tawbi HA, Scolyer RA, Wargo JA, Blank CU, Long GV. Pathological response and survival with neoadjuvant therapy in melanoma: a pooled analysis from the International Neoadjuvant Melanoma Consortium (INMC). Nat Med 2021;27(2):301-309
[46] Merk HF, Bickers DR. Dermatopharmakologie und Dermatotherapie. Blackwell Wissenschaft, Berlin, 1992
[47] Merk HF. COX-Antagonisten. In: Szeimies RM, Hauschild A, Garbe C, Kaufmann R, Landthaler M. Tumoren der Haut. Thieme, Stuttgart, 2010:181-184
[48] Merk HF. Arzneimittel-Wechselwirkungen in der Dermatologie. Der Deutsche Dermatologe 2018;66:918-924
[49] Merk HF. Dermatopharmakologie. Übersetzung und Ergänzung des Kap. 62 LP Fox, HF Merk, DR Bickers Dermatopharmacology in LL Brunton, JS Lazo, KL Parker (Eds.) Goodman & Gilman’s The Pharmacological Basis of Therapeutics, 11. Aufl., ABW Verlag, Berlin, 2006
[50] Micali G, Lacarrubba F, Nasca MR, Ferraro S, Schwartz RA. Topical pharmacotherapy for skin cancer: part II. Clinical applications. J Am Acad Dermatol 2014;70(6):979,e1-12
[51] Micali G, Lacarrubba F, Nasca MR, Schwartz RA. Topical pharmacotherapy for skin cancer: part I. Pharmacology. J Am Acad Dermatol 2014 Jun;70(6):965.e1-12
[52] Migden MR, Rischin D, Schmults CD, Guminski A, Hauschild A, Lewis KD, Chung CH, Hernandez-Aya L, Lim AM, Chang ALS, Rabinowits G, Thai AA, Dunn LA, Hughes BGM, Khushalani NI, Modi B, Schadendorf D, Gao B, Seebach F, Li S, Li J, Mathias M, Booth J, Mohan K, Stankevich E, Babiker HM, Brana I, Gil-Martin M, Homsi J, Johnson ML, Moreno V, Niu J, Owonikoko TK, Papadopoulos KP, Yancopoulos GD, Lowy I, Fury MG. PD-1 Blockade with Cemiplimab in Advanced Cutaneous Squamous-Cell Carcinoma. N Engl J Med 2018 Jul 26;379(4):341-351
[53] Nashan D, Hüning S, Heppt MV, Brehmer A, Berking C. Aktinische Keratosen. Aktuelle Leitlinie und praxisbezogene Empfehlungen. Hautarzt 2020;71:463-473
[54] Nehal KS, Bichakjian CK Update on keratinocyte carcinomas. N Engl J Med 2018;379:363-374
[55] Pickering CR, Zhou JH, Lee JJ, Drummond JA, Peng SA, Saade RE, Tsai KY, Curry JL, Tetzlaff MT, Lai SY, Yu J, Muzny DM, Doddapaneni H, Shinbrot E, Covington KR, Zhang J, Seth S, Caulin C, Clayman GL, El-Naggar AK, Gibbs RA, Weber RS, Myers JN, Wheeler DA, Frederick MJ. Mutational landscape of aggressive cutaneous squamous cell carcinoma. Clin Cancer Res 2014;20(24):6582-6592
[56] Reynolds KA, Schlessinger DI, Vasic J, Iyengar S, Qaseem Y, Behshad R, DeHoratius DM, Denes P, Drucker AM, Dzubow LM, Etzkorn JR, Harwood C, Kim JYS, Lee EH, Lissner GS, Marghoob AA, Matin RN, Mattox A, Mittal BB, Thomas JR, Zhou XA, Zloty D, Schmitt J, Kirkham J, Poon E, Sobanko JF, Cartee TV, Maher IA, Alam M. Core Outcome Set for Actinic Keratosis Clinical Trials. JAMA Dermatol 2020;156(3):326-333
[57] Schadendorf D, van Akkooi ACJ, Berking C, Griewank KG, Gutzmer R, Hauschild A, Stang A, Roesch A, Ugurel S. Melanoma. Lancet 2018 Sep 15;392(10151):971-984
[58] Schauder DM, Kim J, Nijhawan RI. Evaluation of the Use of Capecitabine for the Treatment and Prevention of Actinic Keratoses, Squamous Cell Carcinoma, and Basal Cell Carcinoma: A Systematic Review. JAMA Dermatol 2020, Doi: 10.1001/jamadermatol.2020.2327, Online ahead of print
[59] Schauder DM, Nijhawan RI. Pharmacogenomics of Fluoropyrimidines-a Personalized Approach for Treating and Preventing Keratinocyte Carcinomas-Reply. JAMA Dermatol 2021;157(3):358
[60] Stritt A, Merk HF, Braathen LR, von Felbert V.Photodynamic therapy in the treatment of actinic keratosis. Photochem Photobiol 2008;84(2):388-98
[61] Su F, Viros A, Milagre C, Trunzer K, Bollag G, Spleiss O, Reis-Filho JS, Kong X, Koya RC, Flaherty KT, Chapman PB, Kim MJ, Hayward R, Martin M, Yang H, Wang Q, Hilton H, Hang JS, Noe J, Lambros M, Geyer F, Dhomen N, Niculescu-Duvaz I, Zambon A, Niculescu-Duvaz D, Preece N, Robert L, Otte NJ, Mok S, Kee D, Ma Y, Zhang C, Habets G, Burton EA, Wong B, Nguyen H, Kockx M, Andries L, Lestini B, Nolop KB, Lee RJ, Joe AK, Troy JL, Gonzalez R, Hutson TE, Puzanov I, Chmielowski B, Springer CJ, McArthur GA, Sosman JA, Lo RS, Ribas A, Marais R. RAS mutations in cutaneous squamous-cell carcinomas in patients treated with BRAF inhibitors. N Engl J Med 2012;366(3):207-215
[62] Tanese K, Nakamura Y, Hirai I, Funakoshi T. Updates on the systemic treatment of advanced non-melanoma skin cancer. Front Med 2019;6:160, Doi: 10.3389/fmed.2019.00160
[63] Terheyden P, Mohr A, Langan EA. Immuncheckpointinhibition beim Merkel-Zell-Karzinom. Hautarzt 2019;70(9):684-690
[64] Trager MH, Queen D, Samie FH, Carvajal RD, Bickers DR, Geskin LJ. Advances in Prevention and Surveillance of Cutaneous Malignancies. Am J Med 2020;133(4):417-423
[65] Wellstein A, Giaccone G, Atkins MB, Sausville EA. Cyotoxic drugs. in Brunton LL, Hilal-Dandan R, Knollman BC (Eds.) Goodman & Gilman’s The Pharmacological Basis of Therapeutics, 13. Auflage 2018, New York:1161-1166
[66] Wellstein A, Giaccone G, Atkins MB, Sausville EA. Pathway-targeted therapies: Monoclonal antibodies, protein-kinase inhibitors, and various small molecules. in Brunton LL, Hilal-Dandan R, Knollman BC (Eds.) Goodman & Gilman’s The Pharmacological Basis of Therapeutics, 13. Auflage 2018, New York:1167-1202
[67] Wieder T, Eigentler T, Brenner E, Röcken M. Immune checkpoint blockade therapy. J Allergy Clin Immunol 2018 Nov;142(5):1403-1414
[68] Whiteman DC, Pavan WJ, Bastian BC. The melanomas: a synthesis of epidemiological, clinical, histopathological, genetic, and biological aspects, supporting distinct subtypes, causal pathways, and cells of origin. Pigment Cell Melanoma Res 2011;24(5):879-897
[69] Willenbrink TJ, Ruiz ES, Cornejo CM, Schmults CD, Arron ST, Jambusaria-Pahlajani AJ. Field cancerization: Definition, epidemiology, risk factors, and outcomes. Am Acad Dermatol 2020;83(3):709-717
[70] Wolchok JD, Chiarion-Sileni V, Gonzalez R, Rutkowski P, Grob JJ, Cowey CL, Lao CD, Wagstaff J, Schadendorf D, Ferrucci PF, Smylie M, Dummer R, Hill A, Hogg D, Haanen J, Carlino MS, Bechter O, Maio M, Marquez-Rodas I, Guidoboni M, McArthur G, Lebbé C, Ascierto PA, Long GV, Cebon J, Sosman J, Postow MA, Callahan MK, Walker D, Rollin L, Bhore R, Hodi FS, Larkin J. Overall Survival with Combined Nivolumab and Ipilimumab in Advanced Melanoma. N Engl J Med 2017;377(14):1345-1356
[71] Rote-Hand-Brief zu 5-Fluorouracil- (i.v.), Capecitabin- und Tegafur-haltigen Arzneimitteln: Tests vor Behandlungsbeginn zur Identifizierung von Patienten mit DPD-Mangel. 4. Juni 2020, www.bfarm.de/SharedDocs/Risikoinformationen/Pharmakovigilanz/DE/RHB/2020/rhb-fluorouracil.html






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.