
- DAZ.online
- DAZ / AZ
- DAZ 2/2021
- Welcher Weg ist der ...
Pandemie Spezial
Welcher Weg ist der richtige?
Ringen um die beste Corona-Impfstrategie
Wie hoch im Fall von SARS-CoV-2 die Durchimpfungsrate sein muss, um eine Herdenimmunität zu erreichen, ist unbekannt. Schätzungen variieren zwischen 70 und 85 Prozent. Sicher ist allerdings, dass der entscheidende Grenzwert umso schneller erreicht wird, je mehr Menschen in kürzester Zeit geimpft werden. Mit welcher Strategie dieses Ziel erreicht werden kann, ist weltweit Gegenstand heftiger Debatten.
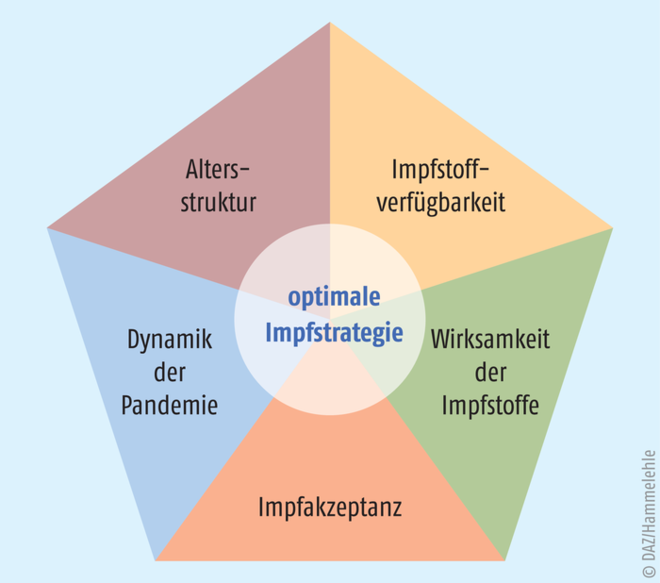
Man kann sich eine optimale Impfstrategie als imaginäres Zentrum eines Polygons mit fünf Ecken vorstellen, dessen Größe durch die Variablen Impfstoffverfügbarkeit, Wirksamkeit der vorhandenen Impfstoffe, Impfakzeptanz, Dynamik der Pandemie und Altersstruktur der zu impfenden Bevölkerung charakterisiert sind (Abb.). Jeder Eckpunkt steht nicht nur in Beziehung zu den benachbarten Variablen, sondern interagiert auch mit den anderen Faktoren. Der Wissensstand über einzelne „Eckpunkte“ ist unterschiedlich und ständig im Fluss. Der derzeit alle strategischen Überlegungen bestimmende Faktor ist die Verfügbarkeit: die meisten Impfzentren erreichen noch nicht einmal ansatzweise die pro Tag angepeilte Impffrequenz, weil es an Nachschub fehlt. Wie eklatant der Impfstoffmangel ist, belegt das „Feilschen“ um die Entnahme einer sechsten Dosis aus einer Ampulle. Die europäische Arzneimittel-Agentur EMA hat dieser ungewöhnlichen Prozedur gerade offiziell zugestimmt.
Eine Frage der Wirksamkeit
Auf Basis der Daten der randomisierten klinischen Studien wird die Wirksamkeit der bereits bzw. in naher Zukunft verfügbaren Impfstoffe auf 62 bis 95 Prozent geschätzt. Es ist offensichtlich, dass bei einem Wirkstoff mit einer Wirksamkeit von 62 Prozent mehr Personen geimpft werden müssen als mit einer Vakzine, deren Wirksamkeit 95 Prozent beträgt, um eine Herdenimmunität zu erreichen. Werden unterschiedliche Impfstoffe simultan eingesetzt, hat das also Folgen für die Impfstrategie.
Eine altersabhängige Wirksamkeit der Impfung hätte ebenfalls Einfluss auf die Impfstrategie. Bislang ist nicht sicher, ob die Wirksamkeit der Impfstoffe in den hohen Altersgruppen – die besonders vulnerabel sind und deshalb so sicher wie möglich vor einer Infektion mit SARS-CoV-2 geschützt werden müssen – ähnlich gut ist wie bei den verhältnismäßig jungen Probanden, die an den Vakzinierungsstudien teilgenommen haben [1, 2]. Für die mRNA-Impfstoffe der Firmen Biontech/Pfizer und Moderna scheint das der Fall zu sein, für den AstraZeneca-Impfstoff, der kurz vor einer bedingten Zulassung steht, jedoch nicht .
Die auf den ersten Blick genial anmutende Idee, erst einmal nur eine Impfdosis zu injizieren und die für die Booster-Impfung vorgesehene zweite Dosis nicht aufzubewahren, sondern gleich an eine weitere Person zu verimpfen, hat einen entscheidenden Haken: Keine der bislang publizierten Studien war darauf ausgerichtet, Unterschiede in der Schutzwirkung nach einer oder zwei Impfdosen statistisch nachweisen zu können [1, 2].
Eine Frage der Akzeptanz
Wie viele Menschen aus den unterschiedlichen Prioritätsgruppen die Corona-Impfung grundsätzlich ablehnen, und wie viele „erst einmal abwarten“ wollen, ist de facto unbekannt. Laut Aussage von Gesundheitsminister Spahn schwankt allein die Impfakzeptanz von Personal im Altenpflegebereich zwischen 20 und 80 Prozent. Schlimmer noch, die mit fehlender Impfakzeptanz zusammenhängenden psychologischen Faktoren sind nicht einmal annäherungsweise bekannt, hätten gleichwohl mit Methoden der klinischen Psychologie längst eruiert werden können. Unter Akzeptanzgesichtspunkten könnte eine rasche Durchimpfung der Bevölkerung sogar kontraproduktiv sein: Je mehr Impfdosen verabreicht werden, umso wahrscheinlicher ist es, dass auch gravierende Impfreaktionen auftreten. Grundsätzlich Impfwillige, die aber „erst einmal abwarten“ wollten, sähen sich dann in ihrer Skepsis bestätigt.
Ist der Anteil der Impfunwilligen im Einzugsbereich eines Impfzentrums hoch, macht es keinen Sinn, die gesamte Zielgruppe anzuschreiben – wie es in einigen Bundesländern vorgesehen ist – und mit der Vergabe von Impfterminen auf Rückmeldungen zu warten. Wertvolle Zeit würde verstreichen, die für die Impfung von Personen aus niedrigeren Prioritätsgruppen genutzt werden könnte. Eine optimale Impfstrategie hängt also auch von dieser Variablen ab.
Sichere Impfabstände
In den klinischen Studien wurden zwei Impfdosen im Abstand von 21 Tagen (Biontech/Pfizer) beziehungsweise 28 Tagen (Moderna) verabreicht. Andere Zeitintervalle wurden nicht untersucht. Schützende Antikörper konnten frühestens 14 Tage nach der ersten Impfung nachgewiesen werden. Die statistisch ermittelte mittlere Wirksamkeit von 95 Prozent (Biontech/Pfizer) bzw. 94 Prozent (Moderna) wurde erst sieben Tage bzw. 14 Tage nach der zweiten Impfung erreicht. Eine T-Zell-Immunität über Gedächtniszellen war erst nach der zweiten Impfung nachweisbar.
In Analogie zu anderen antiviralen Impfstoffen ist ein Abstand von 21 bis 28 Tagen zwischen erster und zweiter Impfung plausibel. Ist das Intervall kürzer, könnte die erste Immunreaktion die Boosterimpfung blockieren [6]. Von anderen Impfstoffen ist bekannt, dass, wenn die zweite Impfung deutlich später erfolgt, die zweite Injektion stärkere Nebenwirkungen auslösen kann [6].
Interdisziplinäre Betrachtungen
In einer derartig verzwickten Gemengelage eine wissenschaftlich fundierte Impfstrategie zu entwickeln, verlangt eine interdisziplinäre Herangehensweise. Jetzt haben erstmals drei US-amerikanische Forschergruppen versucht, das „Impfpolygon“ über mathematisch-statistische Ansätze zu quantifizieren. Maßeinheit für die Effektivität eines Strategiemodells war die Zahl der verhinderten Neuinfektionen – und damit zeitversetzt auch der Todesfälle. Dazu wurde die Effektivität des von den Herstellern untersuchten Impfschemas für mRNA-Vakzine – zwei Dosen im Abstand von 21 bzw. 28 Tagen – mit der einer einzelnen Impfdosis verglichen. Zugrunde gelegt wurde die aktuelle Pandemiedynamik in den USA.
Eine Gruppe von Impfforschern um David Paltiel von der Yale School of Public Health in New Haven, Connecticut, ging der Frage nach, wie wirksam eine einzelne Dosis sein muss, damit mit dem Ein-Dosis-Schema der gleiche Schutzeffekt erzielt wird wie mit dem Standardimpfschema [3]. Ein Ein-Dosis-Impfstoff müsste mindestens eine Wirksamkeit von 75 Prozent für einen Zeitraum von mindestens sechs Monaten haben, um dieselbe Anzahl von Neuinfektionen beziehungsweise Todesfällen zu verhindern wie die Standardimpfung mit einer Schutzwirkung von 95 Prozent.
Die Modellrechnung zeigte auch, dass die Wirksamkeit der Ein-Dosis-Impfung geringer als 75% sein kann, um Neuinfektionen in der gleichen Anzahl zu verhindern wie das Standardimpfschema, wenn der Reproduktionsfaktor R deutlich größer als 1,8 ist.
Yoshua Solomon, Leiter einer Gruppe von Gesundheitssystemforschern an der Stanford University, Kalifornien, nutzte ein sogenanntes Entscheidungskohortenmodell, um herauszufinden, welchen Effekt eine unterschiedlich lange Aufbewahrungszeit der Dosis für die Booster-Immunisierung auf die Zahl der verhinderten Neuinfektionen hat. Wenn von jeder Impfstofflieferung 10 Prozent (statt wie von den Herstellern vorgesehen die Hälfte) aller Ampullen für die Zweitimpfung zurückgelegt würden – also 90 Prozent der verfügbaren Dosen sofort für die Erstimpfung anderer Personen eingesetzt würden, käme es zu 29 Prozent weniger Neuinfektionen über einen Zeitraum von zwei Monaten [4].
Infektionsepidemiologen um Ruanne Barnabas von der University of Washington in Seattle nutzten eine Art digitalen Entscheidungsbaum, um herauszufinden, bei welcher Impfprozedur schneller der kritische Wert für eine Herdenimmunität erreicht wird. Anhand der Daten der Impfstudien mit den mRNA-Vakzinen von Biontech/Pfizer und Moderna kamen die Wissenschaftler zu zwei Schlussfolgerungen: Erstens, die Wirksamkeit einer Einzeldosisimpfung wird eher unter- als überschätzt. Zweitens sei es in der derzeitigen Pandemie-Situation der USA – mit einer hohen Zahl von ausbruchsfördernden Ereignissen (s. DAZ 2020, Nr. 40, S. 24) – effektiver, rasch einen nur partiellen Impfschutz der gesamten Bevölkerung durch eine Einzeldosisimpfung anzustreben als einen kompletten Impfschutz eines Teils der Bevölkerung durch zwei Impfungen [5].
Modellrechnung mit Vorsicht interpretieren
Alle Experten machen unmissverständlich klar, dass die Aussagen ihrer Modellrechnungen mit Vorsicht zu interpretieren sind, weil die tatsächliche Schutzwirkung der vorhandenen/erwarteten Impfstoffe nach einer Einmal-Dosis unbekannt ist.
STIKO: Zweitimpfung spätestens nach 42 Tagen
Die STIKO empfiehlt derzeit für die beiden zugelassenen mRNA-Impfstoffe eine Zweitimpfung frühestens nach 21 (Biontech/Pfizer) bzw. 28 Tagen (Moderna) und spätestens nach 42 Tagen.Das sei durch die Zulassungsstudien gedeckt (s. a. S. 34).
Die Deutsche Gesellschaft für Immunologie geht einen anderen Weg und basiert ihre Empfehlungen auf Erfahrungswerten mit seit vielen Jahren erfolgreich eingesetzten antiviralen Vakzinen. In der Stellungnahme plädiert die Fachgesellschaft dafür, die Zweitimpfung zeitlich variabel zu handhaben, um möglichst viele Menschen in kurzer Zeit zu immunisieren. Die Zweitimpfung müsse aber zwingend spätestens nach 60 Tagen erfolgen [6]. Die Immunologen empfehlen dringend, die Wirksamkeitsstudien der bisher verfügbaren Impfstoffe durch Untersuchungen zu ergänzen, in denen die Kinetik der Entwicklung einer B-Zell- und einer T-Zell-abhängigen Immunität nach unterschiedlichen Impfintervallen ermittelt wird.
Die neuen – erstmals in Großbritannien und Südafrika beobachteten Virusvarianten B1.1.7 und 501.V2. machen die Gemengelage noch undurchsichtiger. So fürchtete die Virologin Isabella Eckerle, Leiterin der Abteilung für Infektionskrankheiten an den Universitätskliniken in Genf (in einem Interview im Heute-Journal am 6.1.2021), dass eine Ein-Dosis-Impfstrategie die weltweite Ausbreitung von B1.1.7 und weiterer Mutanten forcieren könnte. Da mit einer einzelnen Impfdosis bei einer signifikanten Anzahl von geimpften Personen nur ein partieller Impfschutz entsteht, würde ein Selektionsdruck auf das Virus ausgeübt. Dadurch könnten mittelfristig sogar komplett Impfstoff-resistente Virusvarianten entstehen.
Jede Impfstrategie benötigt Begleitforschung
Ob sich eine Impfstrategie dauerhaft als effektiv erweist oder immer wieder angepasst werden muss, lässt sich nur durch gut durchdachte Begleitforschung ermitteln. Auch beim Einsatz des Standardimpfschemas wird nach der Booster-Impfung ein substanzieller Anteil der Geimpften keine oder nur eine partielle Immunität entwickeln. Diese Menschen können sich also weiter mit SARS-CoV-2 infizieren und die Virustransmission in Gang halten. Wird das nicht erkannt, wird das Ziel, über Massenimpfung rasch eine Herdenimmunität zu erreichen, unterlaufen.
Die Aufgabe der Begleitforschung ist es, die Entwicklung der Immunität gegen SARS-CoV-2 auf Bevölkerungsebene zu überprüfen. Dazu müssen repräsentative Stichproben von geimpften Personen auf die Präsenz von schützenden Antikörpern und Immungedächtniszellen untersucht werden. Diese Untersuchungen müssen zum Zeitpunkt der Impfung, zwischen der ersten und der zweiten Impfdosis und nach der vollständigen Immunisierung durchgeführt werden. Notwendig sind Studien für jeden Impfstoff und für jedes Impfschema. Werden Faktoren wie Alter, Vorerkrankungen, eine bereits früher durchgemachte Infektion mit SARS-CoV-2 mit einbezogen, so lassen sich störende bzw. unterstützende Faktoren für die Entwicklung einer Immunität ermitteln.
Der Virologe Paul Bieniasz von der Rockefeller University in New York geht noch einen Schritt weiter. In einem Twitter-Beitrag schreibt er: „Wenn ich ein Szenario für die Selektion einer Impfstoff-resistenten SARS-CoV-2-Variante entwerfen sollte, würde ich tun, was derzeit im Vereinigten Königreich passiert“. Ohne solide Daten zur Übertragbarkeit von B1.1.7 und 501.V2. und ohne Kenntnisse der Evolution von SARS-CoV-2 in Menschen mit einer partiellen Immunität als Folge nur einer Impfdosis, sei diese Vorgehensweise eine „furchtbare Idee“.
In einigen Ländern ist die Situation offensichtlich so dramatisch, dass Regierungen auf wissenschaftliche Überlegungen keine Rücksicht mehr nehmen können. In der Provinz Asturien in Nordspanien wird der derzeit gesamte verfügbare Impfstoff verimpft – ohne die entsprechende Anzahl von Dosen für die Booster-Impfung zurückzulegen. Und Großbritannien hat entschieden, die Zweitimpfung frühestens nach drei Monaten nach der ersten Injektion durchzuführen.
Fazit
Es ist offensichtlich, dass es keine universell gültige Impfstrategie, die für jedes Land und jede epidemiologische Situation gleichermaßen gilt, gibt. Fazit: Impfstrategien müssen kontinuierlich evaluiert und angepasst werden. |
Literatur
[1] Baden LR et al. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. The New England Journal of Medicine. 2020; doi: 10.1056/NEJMoa2035389.
[2] Polack FP et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. The New England Journal of Medicine. 2020; 383:2603-2615; doi: 10.1056/NEJMoa2034577.
[3] Paltiel AD et al. Speed Versus Efficacy: Quantifying Potential Tradeoffs in COVID-19 Vaccine Deployment. Annals of Internal Medicine. 2021; doi.org/10.7326/M20-7866.
[4] Salomon JA et al. Alternative Dose Allocation Strategies to Increase Benefits from Constrained COVID-19 Vaccine Supply. Annals of Internal Medicine. 2021; doi.org/10.7326/M20-8137.
[5] Barnabas RV and Wald A. A Public Health COVID-19 Vaccination Strategy Health Gains for Every Single Vaccine Dose. Annals of Internal Medicine. 2021; doi.org/10.7326/M20-8060.
[6] Falk CS. DGfI Stellungnahme zur Impfung gegen SARS-CoV-2: Kann die zweite Dosis warten? Deutsche Gesellschaft für Immunologie e.V. 2021; https://dgfi.org/corona/
Weitere Beiträge des Pandemie Spezials in DAZ 2021, Nr. 2
- Maskenverteilung – wie werden die Vorgänge gebucht? Folgen für Warenwirtschaft und Besteuerung
- Rekonstitution oft ohne Apotheker: Wer bei der Impfstoffzubereitung auf pharmazeutisches Know-how verzichtet
- Apotheker und Ärzte auf Augenhöhe: Berliner Kammerpräsidentin hält Vergütung in Impfzentren für angemessen
- Warten auf die Impfstoffe: Versorgungsstrategie der EU in der Kritik
- Biontech/Pfizer versus Moderna: Die zugelassenen mRNA-Impfstoffe im Vergleich
- Impfstoff erfasst wohl auch Mutationen: Sorge um Cormirnaty®-Impfschutz gegen SARS-CoV-2-Varianten vorläufig entkräftet






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.