
- DAZ.online
- DAZ / AZ
- DAZ 10/2021
- Und was macht die ...
Pandemie Spezial
Und was macht die Therapie?
Die Entwicklung von Arzneimitteln gegen COVID-19 führt ein Schattendasein
Fast ein Jahr nach Beginn der Pandemie hat erst eine Handvoll Therapeutika gültige Zulassungen zur Behandlung von COVID-19 erhalten. Dazu zählen Remdesivir (Veklury®) von Gilead Sciences in den USA, Großbritannien und Japan, Dexamethason in Großbritannien und ebenfalls in Japan und Favipiravir (Avigan®) in China, Italien und Russland. In der EU gibt es bislang lediglich für Remdesivir eine bedingte Zulassung. Die US Food and Drug Administration (FDA) hat darüber hinaus Notfallgenehmigungen (Emergency Use Authorization, EUA) für einige weitere Behandlungen ausgestellt (Tab. 1). Diese werden oft als Wegweiser für weitere Zulassungen in anderen Ländern herangezogen.
Datum | Wirkstoff/e | COVID-19-Zielgruppen |
|---|---|---|
1. Mai 2020 (EUA) 22. Oktober 2020 (Zulassung und eingeschränkte Weiterführung der EUA) | Remdesivir | Zulassung: Erwachsene und Kinder ab zwölf Jahren mit einem Gewicht von mindestens 40 kg, die hospitalisiert werden müssen EUA: hospitalisierte Kinder mit einem Gewicht zwischen 3,5 und 40 kg oder hospitalisierte Kinder unter zwölf Jahren, die mindestens 3,5 kg wiegen |
23. August 2020 Revision am 23. Februar 2021 | COVID-19-Rekonvaleszentenplasma | hospitalisierte Patienten |
9. November 2020 Revision am 2. März 2021 | Bamlanivimab | leicht bis mittelschwer erkrankte Erwachsene und Kinder ab zwölf Jahren mit einem Gewicht von mindestens 40 kg mit einem hohen Risiko für einen schweren Krankheitsverlauf und/oder für eine Krankenhausaufnahme. |
19. November 2020 | Baricitinib plus Remdesivir | hospitalisierte Erwachsene und pädiatrische Patienten ab zwei Jahren, die zusätzlich Sauerstoff, invasive mechanische Beatmung oder extrakorporale Membranoxygenierung (ECMO) benötigen |
21. November 2021 letzte Revision am 25. Februar 2021 | Casirivimab und Imdevimab | siehe Bamlanivimab |
9. Februar 2021 Revision am 25. Februar 2021 | Bamlanivimab plus Etesevimab | siehe Bamlanivimab |
Die weltweite Forschungstätigkeit ist immens. Die Datenbank clinicaltrials.gov listet aktuell allein 539 Phase-III-Interventionsstudien zu COVID-19 (Stand 4. März 2021, nicht nur medikamentöse Interventionen). 127 haben noch nicht mit der Patientenrekrutierung begonnen, 289 sind dabei, 59 sind aktiv, rekrutieren aber gerade nicht. 64 Phase-III-Studien sind abgeschlossen, davon ausweislich Clinical Trials.gov acht mit Ergebnissen.
Durchgefallen: Lopinavir/Ritonavir und Chloroquin/Hydroxychloroquin
Große Hoffnungen wurden von Beginn der Entwicklung effektiver COVID-19-Therapeutika in den Repurposing-Ansatz gesetzt. Bislang haben die mannigfachen Aktivitäten jedoch kaum überzeugende Ergebnisse geliefert. Für Lopinavir/Ritonavir sowie für Chloroquin und Hydroxychloroquin ist der Zug wohl abgefahren. Nach einer Zwischenanalyse der SOLIDARITY-Studie der WHO vom 15. Oktober 2020 haben beide Ansätze bei stationären Patienten kaum oder gar keine Auswirkungen auf die Gesamtsterblichkeit, die Einleitung der Beatmung und die Dauer des Krankenhausaufenthalts. Ein aktueller Cochrane-Review, der die Datenlage zu Chloroquin und Hydroxychloroquin bis zum 15. September 2020 aufgearbeitet hat, kommt zu einem ähnlichen Ergebnis und rät dazu, keine weiteren Studien mit Hydroxychloroquin oder Chloroquin zur Behandlung mehr durchzuführen [1].
Remdesivir: Therapie-Flaggschiff auf Bewährung
Ungeachtet der erteilten Genehmigungen sprach sich die Weltgesundheitsorganisation im November in einer „bedingten Empfehlung“ überraschend gegen den Einsatz von Remdesivir aus. Derzeit lägen keine Hinweise darauf vor, dass das Virostatikum unabhängig von der Schwere der Erkrankung wesentliche Auswirkungen auf die Mortalität, die Notwendigkeit einer mechanischen Beatmung, die Zeit bis zur klinischen Verbesserung oder andere für den Patienten wichtige Ergebnisse habe, so die Begründung. Die bedingte Zulassung in der EU berührt das bis auf Weiteres nicht. Die Europäische Arzneimittel-Agentur (EMA) hat ihrerseits eine Überprüfung der verfügbaren Daten angekündigt. Remdesivir wird in klinischen Studien unter anderem in dem umfangreichen Programm ACTIV-Associated der National Institutes of Health weiter untersucht (Tab. 2). Auf Basis der bisherigen Erkenntnisse erscheint ein Einsatz vor allem in der Frühphase der Erkrankung sinnvoll. Das Robert Koch-Institut (RKI) hat die aktuelle Datenlage zu Remdesivir zuletzt am 11. Januar 2021 zusammengefasst [2].
Sektoren des Studienprogramms | untersuchte Wirkstoffe |
|---|---|
ACTIV-1 Immunmodulatoren | Infliximab Abatacept Cenicriviroc (CVC) |
ACTIV-2 Monoklonale Antikörper und andere Therapien (ambulant) | LY-CoV555 BRII-196 and BRII-198 (monoklonale Antikörper von Brii Biosciences) SNG001 (inhalierbares Beta-Interferon) AZD7442 (monoklonale Antikörper AZD8895 und AZD1061 von AstraZeneca) Camostat Mesilat |
ACTIV-3 Monoklonale Antikörper und andere Therapien (stationär) | VIR-7831 (monoklonaler Antikörper von GSK und Vir Biotechnology) BRII-196 and BRII-198 (siehe oben) AZD7442 (siehe oben) |
ACTIV-4 Antithrombotika | ACTIV-4 ambulant: Apixaban, ASS ACTIV-4 stationär: unfraktioniertes und niedermolekulares Heparin ACTIV-4 Rekonvaleszenten |
ACTIV-5 „Big Effect Trial” (Phase 2) | Lenzilumab |
ACTIV-Associated | Remdesivir alleine Remdesivir plus Baricitinib Remdesivir plus Interferon Beta-1a Remdesivir plus Dexamethason gegen Remdesivir plus Baricitinib Remdesivir plus Hyperimmun - intravenöses Immunoglobulin (hIVIG) |
[Webseite der National Institutes of Health, www.nih.gov/research-training/medical-research-initiatives/activ/covid-19-therapeutics-prioritized-testing-clinical-trials] | |
Weitere Antiviralia
Neben Remdesivir sind auch noch andere Vertreter dieser Gruppe bereits in die klinische Phase III eingetreten, darunter das japanische „Reserve-Grippemittel“ Favipiravir (Avigan®). Russland hat die Verwendung des RNA-Polymerase-Inhibitors von Fujifilm Toyama Chemical sowohl für Krankenhauspatienten als auch für die ambulante Behandlung von SARS-CoV-2-Infektionen genehmigt. Die Wirkung wird aktuell in der Phase-III-Studie PRESECO (Preventing Severe COVID-19 Disease) überprüft (NCT04600895). Nach einer neuen Metaanalyse von neun Studien soll Favipiravir zwar einen Nutzen für frisch hospitalisierte Patienten bringen, die Mortalität von leicht bis mittelschwer Erkrankten aber nicht senken können [3].
Darüber hinaus wird der RNA-Polymerasehemmer Molnupiravir (MK-4482) von MSD in den USA in Phase II/III-Studien mit ambulant und stationär behandelten COVID-19-Patienten erprobt (NCT04575597, NCT04575584).
Angriffspunkt Herz-Kreislauf-System
Ob Antikoagulanzien oder Antithrombotika einen Einfluss auf die Verringerung kardiovaskulärer oder pulmonaler Komplikationen durch COVID-19 haben, ist Gegenstand der ambulanten ACTIV-4-Studie der US National Institutes of Health (NIH) (Tab. 2). Sie testet die Gerinnungshemmer Apixaban und Acetylsalicylsäure (ASS) (NCT04498273). Daneben versuchen die NIH-Forscher zu bewerten, ob Heparin bei hospitalisierten Patienten einen Einfluss auf die Gerinnungskomplikationen infolge von COVID-19 haben könnte (NCT04505774). Eine weitere Phase-II/III-Studie (ATTACC) bewertet Heparin bei Patienten, die mit COVID-19 ins Krankenhaus eingeliefert wurden (NCT04372589).
AstraZeneca evaluiert den SGLT-Inhibitor Dapagliflozin (Forxiga®), der für die Therapie von Diabetes Typ 2 zugelassen ist, in der Phase-III-Studie DARE-19 an COVID-19-Patienten mit Komorbiditäten wie Bluthochdruck, Typ-2-Diabetes, atherosklerotischen Herz-Kreislauf-Erkrankungen, Herzinsuffizienz und/oder chronischen Nierenerkrankungen (NCT04350593).
Erfolge mit Dexamethason
Die Wirksamkeit von Dexamethason bei schwerem Verlauf gehört zu den wenigen Lichtblicken in der bisherigen Erforschung von COVID-19-Therapeutika. Nach den Ergebnissen der RECOVERY-Studien ist die 28-Tage-Sterblichkeit bei Patienten, die mechanisch beatmet werden oder Sauerstoff erhalten, mit Dexamethason signifikant verringert (DAZ 2020, Nr. 31, S. 29). Es wurde daraufhin als Teil des Versorgungsstandards für entsprechende Patienten in die Therapie einbezogen (DAZ 2021, Nr. 9, S. 26 – 27). Im September letzten Jahres befürwortete die Europäische Arzneimittelagentur (EMA) den Einsatz bei Patienten, die Sauerstofftherapie benötigen. Nach einer Metaanalyse der REACT (Rapid Evidence Appraisal for COVID-19 Therapies)-Arbeitsgruppe der WHO scheint die relevante Verringerung der Sterblichkeit bei Patienten mit schweren COVID-19-Verläufen auch für andere systemische Corticosteroide generell zu gelten [4].
Monoklonale Antikörper gegen den Zytokinsturm
In der Reihe der monoklonalen Antikörper, die die überschießende Immunabwehr gegen das neuartige Coronavirus, den sogenannten „Zytokinsturm“, dämpfen sollen, genießt aktuell Tocilizumab (RoActemra®) die größte Aufmerksamkeit. Der IL-6-Rezeptor-Blocker hat seinen Nutzen in der Behandlung von schwerem COVID-19 unter anderem in der RECOVERY-Studie unter Beweis gestellt (DAZ 2021, Nr. 7, S. 28). Zusammen mit Corticosteroiden konnte das Rheuma-Therapeutikum bei Patienten, die beatmet werden mussten, die Sterblichkeit senken, die Notwendigkeit einer mechanischen Beatmung verringern und die Zeit bis zur Entlassung aus dem Krankenhaus verkürzen. Auch in der REMAP-CAP-Studie (NCT02735707) senkten die beiden Antikörper Tocilizumab und Sarilumab zusammen mit einem Corticosteroid das Sterberisiko von Intensiv-Patienten mit schwerem COVID-19 signifikant. In der randomisierten doppelblinden, placebokontrollierten Phase-III-Studie COVACTA (NCT04320615) hatte Tocilizumab dagegen sowohl den primären Endpunkt, das heißt die Verbesserung des klinischen Status, als auch den sekundären Endpunkt, die Senkung der Mortalitätsrate in Woche vier nach Behandlungsstart, verfehlt.
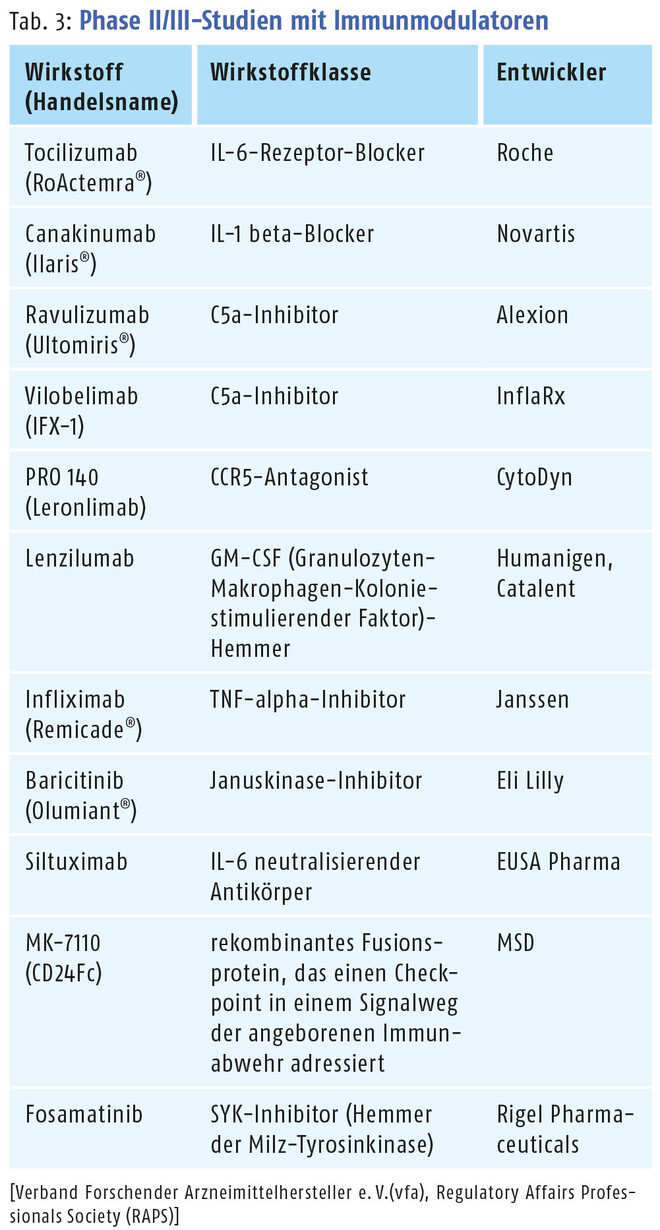
Zu weiteren immunmodulatorischen Kandidaten gegen COVID-19 siehe Tab. 3. Der Janus-Kinase-Inhibitor Baricitinib (Olumiant®) hat in den USA bereits eine Notfallgenehmigung (EUA) für den Einsatz in Kombination mit Remdesivir erhalten (Tab. 1).
Hype um Ivermectin
Das gängige Antiparasitikum Ivermectin ist seit April 2020 als potenzielles COVID-19-Therapeutikum verstärkt in den Fokus des Interesses gerückt. Kürzlich haben zwei Wissenschaftler-Teams von der Front Line COVID-19 Critical Care Alliance (FLCCC) und vom International lvermectin Project Team die Ergebnisse umfassender Metaanalysen dazu vorgelegt [5, 6]. Die FLCCC leitet aus der Gesamtheit der klinischen Daten die Schlussfolgerung ab, dass Ivermectin die Viruslast signifikant verringern kann. Außerdem soll es die Übertragung und Entwicklung von COVID-19 bei Infizierten eindämmen und bei Patienten mit einer leichten bis mittelschweren Ausprägung der Krankheit die Genesung beschleunigen und eine Verschlechterung verhindern, vorausgesetzt, es wird früh nach Symptomeintritt verabreicht. Bei schwer Erkrankten soll es die Hospitalisierung vermeiden helfen und die Sterblichkeit bei kritisch kranken Patienten mit COVID-19 vermindern.
Am 14. Januar 2021 wurden die US-Behandlungsrichtlinien für COVID-19 revidiert. Die Experten erachten die Datenlage für eine Empfehlung nach wie vor als nicht ausreichend, sprechen sich aber neuerdings nicht mehr gegen die Verwendung von Ivermectin zur Behandlung von COVID-19 aus (DAZ 2021, Nr. 4, S. 28 – 31).
Rekonvaleszentenplasma
Eine weitere immunologische Waffe im Kampf gegen SARS-CoV-2 ist Plasma von Personen, die eine Infektion überstanden haben. Eine umfangreiche Metaanalyse hat die Datenlage zur Anwendung von Rekonvaleszentenplasma (bis 15. Oktober 2020) evaluiert. Während die Ergebnisse begrenzter randomisierter kontrollierter Studien nicht darauf hindeuten, dass die Gabe die Sterblichkeit signifikant senken kann, haben einige nicht-kontrollierte Studien und Fallberichte (Serien) durchaus positive Effekte gezeigt. Hiernach konnte das Plasma von Genesenen die klinischen Symptome verbessern, das Virus löschen und die Sterblichkeit vermindern, insbesondere wenn es innerhalb der ersten zehn Erkrankungstage gegeben wurde [7]. Außerdem scheint es ein optimales Zeitfenster für die Spende zu geben. Nach einer neuen Studie sinken die virusneutralisierenden Antikörper schon nach 60 Tagen rasch unter das von der FDA in der Notfallzulassung (Tab. 1) empfohlene Niveau für die Spende von Rekonvaleszentenplasma [8].
Auch in der Europäischen Union wird Plasma von COVID-19-Genesenen notfallmäßig eingesetzt. Die EU-Kommission hat bereits im April 2020 Leitlinien für die Sammlung und Transfusion von COVID-19-Rekonvaleszenzplasma veröffentlicht, die zuletzt Anfang Dezember aktualisiert wurden (Version 3.0) [9].
Neutralisierende Antikörper
Neben Rekonvaleszentenplasma werden auch diverse neutralisierende Antikörper aktuell breit erforscht, und zwar mit einigem Erfolg. Derzeit am weitesten fortgeschritten sind die Entwicklungen von Regeneron (Casirivimab plus Imdevimab) und Eli Lilly (Bamlanivimab alleine oder in Kombination mit Etesevimab). Nach den Notfallzulassungen in den USA (siehe Tab. 1) könnte für den Regeneron-Cocktail Regen-Cov2 eine bedingte Zulassung in der EU bereits in greifbare Nähe gerückt sein. Am 4. Februar hat die EMA einen Rolling Review dazu in Gang gesetzt. Unabhängig davon hat der Ausschuss für Humanarzneimittel (CHMP) ebenfalls Anfang Februar eine Überprüfung sämtlicher verfügbarer Daten zur Verwendung der genannten Antikörper gestartet. Am 26. Februar 2021 befürwortete die EMA den Einsatz des Regeneron-Cocktails und zog am 5. März mit einem positiven Votum zu der Antikörper-Kombi Bamlanivimab plus Etesevimab nach. Beide Empfehlungen beziehen sich auf die Behandlung von bestätigtem COVID-19 bei Patienten, die keinen zusätzlichen Sauerstoff benötigen und ein hohes Risiko für einen schweren Verlauf haben. Trotz der Unsicherheiten in Bezug auf die Vorteile der Monotherapie kann aus Sicht der EMA auch die Verwendung von Bamlanivimab alleine als Behandlungsoption in Erwägung gezogen werden. Die Empfehlungen sind eine wertvolle Hilfestellung für die Mitgliedstaaten im Vorgriff auf eine etwaige EU-Zulassung der Antikörper.
Erwähnung verdienen an dieser Stelle außerdem der therapeutische Antikörper Regkirona (Regdanvimab bzw. CT-P59) der südkoreanischen Firma Celltrion, der Anfang Februar in Südkorea eine bedingte Marktzulassung für eine bestimmte COVID-19-Patientenpopulation erhalten hat, sowie die gentechnisch hergestellte Antikörperkombi AZD7442 von AstraZeneca. Für diese wurden die monoklonalen Antikörper AZD8895 und AZD1061 so verändert, dass sie länger als gewöhnliche Antikörper im Blut verbleiben. AZD7442 wird aktuell in der US-amerikanischen ACTIV-3-Studie getestet, ebenso wie das Antikörper-Duo BRII-196 und BRII-198 der Firma Brii Biosciences und der Antikörper VIR-7831 von GSK und Vir Biotechnology (Tab. 3). Näheres zu SARS-CoV-2-neutralisierenden monoklonalen Antikörpern in fortgeschrittenen klinischen Phasen siehe DAZ 2021, Nr. 9, S. 24 – 25.
Fazit
Augenscheinlich kann die Entwicklung von COVID-19-Therapeutika mit der bahnbrechenden Impfstoff-Szene bis dato nicht ganz mithalten. Der Repurposing-Ansatz hat sich vielfach als Irrweg erwiesen und Neuentwicklungen brauchen Zeit. In den nächsten Monaten ist aber durchaus mit weiteren aufschlussreichen klinischen Ergebnissen zu rechnen. |
Literatur
[1] Singh B, Ryan H et al. Chloroquine or hydroxychloroquine for prevention and treatment of COVID-19. Cochrane Database Syst Rev 2021;2:CD013587, doi: 10.1002/14651858.CD013587.pub2
[2] Wie ist die aktuelle Datenlage zur Behandlung von COVID-19 mit Remdesivir? Informationen des Robert Koch-Instituts (RKI), Stand: 11. Januar 2021; DOI 10.25646/6939.6
[3] Hassanipour S, Arab-Zozani M et al. The efficacy and safety of Favipiravir in treatment of COVID-19: A systematic review and meta-analysis of clinical trials. medRxiv preprint, doi: https://doi.org/10.1101/2021.02.14.21251693; this version posted 17. Februar 2021
[4] The WHO Rapid Evidence Appraisal for COVID-19 Therapies (REACT) Working Group. Association Between Administration of Systemic Corticosteroids and Mortality Among Critically Ill Patients With COVID-19A Meta-analysis. JAMA 2020;324(13):1330-1341
[5] Kory P, Meduri GU et al. Review of the Emerging Evidence Demonstrating the Efficacy of Ivermectin in the Prophylaxis and Treatment of COVID-19. https://covid19criticalcare.com/wp-content/uploads/2020/11/FLCCC-Ivermectin-in-the-prophylaxis-and-treatment-of-COVID-19.pdf
[6] Hill A, on behalf of the International Ivermectin Project Team. Preliminary meta-analysis of randomized trials of ivermectin to treat SARS-CoV-2 infection. ResearchSquare, www.researchsquare.com/article/rs-148845/v1
[7] Wang Y, Huo P et al. Convalescent plasma may be a possible treatment for COVID-19: A systematic review. Int Immunopharmacol 2021;91: 107262, doi: 10.1016/j.intimp.2020.107262. Epub 5. Dezember 2020
[8] Gontu A et al. Limited window for donation of convalescent plasma with high live-virus neutralizing antibody titers for COVID-19 immunotherapy. Commun Biol 2021;4:267
[9] European Commission. An EU programme of COVID-19 convalescent plasma collection and transfusion. Guidance on collection, testing, processing, storage, distribution and monitored use. Ref Ares 20207213671-30/11/2020, https://ec.europa.eu/health/sites/health/files/blood_tissues_organs/docs/guidance_plasma_covid19_en.pdf
Weitere Beiträge des Pandemie Spezials in DAZ 2021, Nr. 10
- Tempo sticht Genauigkeit: Häufig wiederholte Antigentests können helfen, die Pandemie unter Kontrolle zu bringen
- Vektorimpfungen leicht erklärt: Wie man Apothekenkunden zur Corona-Impfung motiviert – Teil 1
- Hochdosiertes Vitamin C und Zink wirkungslos? Studie mit COVID-19-Patienten mangels Effekt vorzeitig gestoppt
- Richtiges Timing bei Standardimpfungen: Zwei Wochen vor oder nach den Corona-Vakzinen zu impfen ist kein Problem
- COVID-19-Todesfälle korrelieren mit Blutzuckerspiegel: Die Deutsche Diabetes Gesellschaft warnt
- Rätselhaftes Neuro-COVID: Ursachen für persistierende neurologische Symptome sind ungeklärt
- Corona-Ticker: Neues zu SARS-CoV-2 in Kürze























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.