
- DAZ.online
- DAZ / AZ
- DAZ 13/2020
- Hoffnungsträger ...
Pandemie Spezial
Hoffnungsträger Remdesivir
Antivirales Nukleotidanalogon wird bei COVID-19-Patienten getestet
Die ersten Daten zur Hemmung von SARS-CoV-2 durch Arzneistoffe in Zellkulturen wurden bereits Anfang des Jahres veröffentlicht. Insgesamt sieben Arzneistoffe wurden in Vero-E6-Zellen – einer Nierenzelllinie aus Primaten – untersucht. Die höchste Aktivität zeigte Remdesivir, auch die Malariamittel Chloroquin und Hydroxychloroquin erwiesen sich als ähnlich aktiv wie Remdesivir, obwohl sich die Substanzen hinsichtlich ihrer Wirkungsmechanismen deutlich unterscheiden [Wang et al., 2020; Yao et al., 2020]. Das Malariamittel Chloroquin verhindert nach vorläufigen Berichten die terminale Glykosylierung des ACE2. ACE2 dient den SARS-CoV-2 als Rezeptor, um in die Zelle zu gelangen (s. DAZ 2020, Nr. 11, S. 36). Zusätzlich erhöht der Wirkstoff – beziehungsweise das Derivat Hydroxychloroquin – den pH-Wert in den Endosomen, die an der Aufnahme der Viren in die Zellen beteiligt sind. In mehreren klinischen Studien werden die Wirksamkeit und Verträglichkeit des Arzneistoffs im Rahmen der Prophylaxe und Therapie von COVID-19 untersucht (Tab. 1). Während die Malariamittel seit Jahrzehnten bekannt und hinsichtlich ihrer Nutzen-Risiko-Relation relativ gut abschätzbar sind, sind die Informationen zu Remdesivir noch limitiert, eine Zulassung liegt nicht vor, es gibt lediglich Daten aus Zellkulturen und Tierversuchen sowie Erkenntnisse aus klinischen Studien mit Ebola-Patienten.
Wirkstoff | Struktur | Pharmakologie | EC50 (µM) |
|---|---|---|---|
Remdesivir | Adeninderivat, Nukleotidanalogon | hemmt virale RNA-abhängige RNA-Polymerase, als Wirkstoff gegen Ebola-Viren entwickelt, mehrere klinische Studien bei COVID-19 | 0,77 |
Chloroquin | 4-Amino-chinolinderivat | Malariamittel, auch bei rheumatoider Arthritis; antivirale Wirkung durch erhöhten pH-Wert in Endosomen, zur Zeit mehrere klinische Studien bei COVID-19 | 1,1 5,5* |
Hydroxychloroquin | 4-Amino-chinolinderivat, Derivat des Chloroquin | wie Chloroquin | 0,72* |
Nitazoxanid | Nitrothiazolderivat, in vivo deacetyliert zum aktiven Metaboliten Tizoxanid | wirkt gegen Protozoen, wie Cryptosporidium parvum, und einige Bakterienarten; zusätzlich antivirale Wirkung, klinische Studien bei Influenza und anderen Virusinfektionen | 2,1 |
Favipiravir | Pyrazincarboxamid | hemmt virale RNA-abhängige RNA-Polymerase, in Japan zur Behandlung der Influenza zugelassen | 62 |
mod. nach Wang et al., 2020; Yao et al., 2020; * Daten von Yao et al., 2020 | |||
Antivirales Nukleotidanalogon
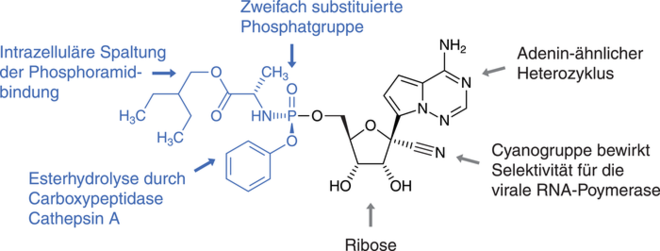
Remdesivir ist ein Nukleotidanalogon, genauer ein C-Nukleosid-Monophosphat mit einer Phosphoramidat-Struktur. Der Basenanteil ist ein Adenin-ähnlicher Heterozyklus, die Phosphatgruppe ist mit zwei Gruppen maskiert, die intrazellulär erst abgespalten werden müssen [Siegel et al., 2017]. Die Maskierung ist notwendig, denn Verbindungen mit freier Phosphatgruppe sind zu hydrophil, um ausreichend in die Zellen einzudringen (Abb. 1).
Abb. 1: Die Struktur des Nukleotidanalogons Remdesivir (GS-5734). Da Nukleotide mit einer freien Phosphatgruppe aufgrund ihrer Hydrophilie schlecht in die Zellen aufgenommen werden, ist die Phosphatgruppe hier mit anderen Gruppen verbunden. Dadurch lassen sich höhere intrazelluläre Konzentrationen erreichen. Dieses pharmakologische Prinzip wurde auch in anderen Virustatika angewandt (Sofosbuvir, Tenofovir-Alafenamid).
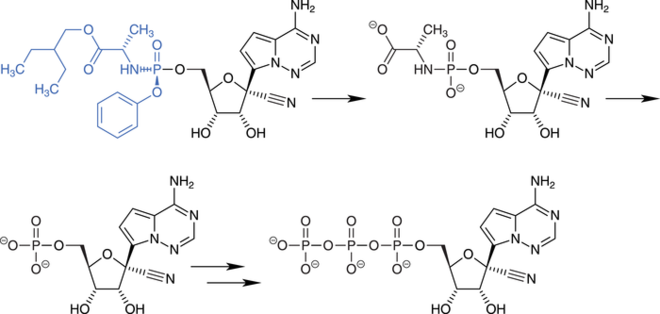
Intrazellulär wird das aus Remdesivir entstandene Monophosphat dann zum eigentlichen Wirkstoff, dem Triphosphat, verstoffwechselt, welches die RNA-abhängige RNA-Polymerase der Viren hemmt, wobei in den niedrigen Konzentrationen kein Effekt auf humane RNA-Polymerasen beobachtet wurde (Abb. 2). Bekanntlich können auch Nukleoside, also Verbindungen von Basen mit Zuckern ohne Phosphatgruppe, als Virustatika angewandt werden, jedoch ist die erste Phosphorylierung ein langsam verlaufender Schritt. Daher haben Nukleotidanaloga meist höhere Effektivität. In vitro können mit Remdesivir im Vergleich zu einer Substanz, die nur aus der entsprechenden Base und Ribose besteht, etwa 30-fach höhere Konzentrationen des Triphosphats erreicht werden. Entfernt man dann den Arzneistoff aus dem Medium, persistiert das Triphosphat intrazellulär mit einer Halbwertszeit von etwa 24 Stunden. Diese Untersuchungen wurden mit humanen Makrophagen durchgeführt [Warren et al., 2016].
Abb. 2: Intrazellulärer Metabolismus von Remdesivir. Nach Abspaltung der Reste am Phosphat wird das Molekül noch zweimal phosphoryliert zum Triphosphat. Dies ist der eigentliche Wirkstoff, der in der Lage ist, die virale RNA-abhängige RNA-Polymerase zu hemmen [mod. nach Warren et al., 2016].
Wenn die Makrophagen oder andere Zellen mit Viren infiziert werden, lässt sich die Konzentration bestimmen, bei der die Replikation der Viren gehemmt wird. Meist gibt man die Konzentration an, bei der ein halbmaximaler Effekt beobachtet wird (EC50). Bei Makrophagen, die mit Ebola-Viren infiziert wurden, lag die EC50 bei ca. 0,1 µM Remdesivir, erwartungsgemäß zeigte das entsprechende Nukleosid mit EC50-Werten von 0,77 bis > 20 µM eine deutlich geringere inhibitorische Aktivität.
Neben Ebola-Viren hemmt Remdesivir auch Corona- und eine Reihe anderer RNA-Viren, Retroviren wie HIV werden dagegen nicht gehemmt. In Primärkulturen mit Epithelzellen aus dem Respirationstrakt des Menschen zeigte der Wirkstoff hohe Aktivität gegen die Erreger von SARS oder MERS (Sheahan et al., 2017). Bei Untersuchungen mit SARS-CoV-2 in Vero-Zellen wurde ein EC50-Wert von 0,77 µM und ein EC90-Wert von 1,76 µM (1 µM = 0,6 mg/l) ermittelt (siehe Tabelle). Auf der Basis dieser Ergebnisse wurden eine Reihe von Tierexperimenten und erste Untersuchungen beim Menschen initiiert.
Tierexperimente bei MERS, SARS und Ebola
Die Experimente betreffen Infektionen mit Ebola-Viren sowie die Coronavirus-Infektionen SARS und MERS und wurden vor dem Beginn der COVID-19-Epidemie publiziert. Für diese Studien mussten spezielle, genetisch modifizierte Tiere verwendet werden, denn die Viren verhalten sich wirtsspezifisch. Der MERS-Erreger gelangt über das Enzym DPP4 (Dipeptidylpeptidase, CD26) in die Zellen des Menschen, die Mäuse müssen daher mit diesem humanen Enzym ausgestattet sein. Darüber hinaus findet bei Nagern aufgrund der hohen Esterase-Aktivität im Blutserum eine sehr rasche Hydrolyse des Remdesivir bereits außerhalb der Zellen statt. Für die Versuche muss daher auch das entsprechende Gen für dieses Enzym inaktiviert werden. In einem Modellversuch mit SARS bei den genetisch veränderten Mäusen bewirkte die prophylaktische oder frühzeitige Verabreichung von Remdesivir eine deutliche Reduktion der Viruslast in den Lungen der Tiere am Tag 4 oder 5 der Infektion. Im Vergleich zu unbehandelten Kontrolltieren wurden auch die Lungenfunktion und andere klinische Symptome der Erkrankung reduziert. Allerdings handelt es sich um Ergebnisse mit einem sehr komplexen Modell, die Daten können daher nur bedingt interpretiert werden [Sheahan et al., 2017].
Mehr Gemeinsamkeiten mit dem menschlichen Organismus bestehen bei Rhesusaffen. Die Esteraseaktivität und damit das kinetische Verhalten des Wirkstoffs entsprechen eher der Situation beim Menschen. Angesichts der Bedeutung des Ebolafiebers wurden daher auch Studien mit Ebola-infizierten nicht menschlichen Primaten durchgeführt. Mehrere Gruppen von je sechs Rhesusaffen wurden durch intramuskuläre Injektion mit Ebola-Viren infiziert. Etwa eine Stunde danach oder erst zwei bis drei Tage später begann eine Therapie mit dem Prüfpräparat. Bei Behandlung mit einer Dosis von 3 mg/kg Körpergewicht verstarben in zwei Gruppen zwei bzw. vier Tiere an der Infektion. Daraufhin wurde die Dosierung erhöht. Bei ansonsten ähnlichem Versuchsdesign zeigte der Wirkstoff in einer Dosierung von 10 mg/kg eine bessere Wirkung. Bei Therapiebeginn zwei oder drei Tage nach der Infektion überlebten alle Affen unter diesen Bedingungen, auch bei einer Dosisreduktion auf 3 mg/kg nach einer initial verabreichten loading dose von 10 mg/kg [Warren et al., 2016].
Remdesivir bei Patienten mit Ebolafieber
Da Remdesivir in dem Experiment mit Ebola-infizierten nicht menschlichen Primaten wirksam war, wurde eine umfangreiche Studie mit Patienten, die an Ebolafieber erkrankt waren, begonnen. In dieser Studie konnte Remdesivir nicht überzeugen. Eine Gruppe von 175 Patienten erhielt das Prüfpräparat in einer Dosierung von 200 mg am ersten Tag und anschließend täglich 100 mg intravenös für neun bis 13 Tage. Nach 28 Tagen waren mehr als die Hälfte der Patienten verstorben. Im direkten Vergleich schützten zwei Antikörper-Präparate besser vor einem tödlichen Verlauf. Nach diesem Zwischenergebnis wurden keine weiteren Patienten mehr mit Remdesivir behandelt. Die Gründe für die schwache Wirksamkeit in dieser klinischen Studie sind nicht genau geklärt [Mulangu et al., 2019]. In den Versuchen mit Affen hatte sich eine Dosis von 3 mg/kg – also ca. 210 mg für einen Menschen mit durchschnittlichem Körpergewicht von 70 kg – als nicht ausreichend wirksam erwiesen, die Therapie mit einer dreifachen Dosierung war dagegen erfolgreich. Eventuell sind auch beim Menschen höhere Dosierungen erforderlich. Da bisher keine Daten zur Pharmakokinetik des Wirkstoffes publiziert wurden und auch über mögliche toxische Wirkungen bei höherer Dosierung nichts bekannt ist, kann die Datenlage auf der Basis der verfügbaren Literatur nicht abschließend beurteilt werden.
Remdesivir bei COVID-19
Die Erreger von Ebola und COVID-19 sind zwar beide RNA-Viren, aber ansonsten unterscheiden sie sich wesentlich. Die Erkrankungen, die sie hervorrufen, sind sehr verschieden. Daher lassen sich keine direkten Rückschlüsse aus den klinischen Studien bei Ebola-Patienten hinsichtlich einer möglichen Wirksamkeit bei anderen Erkrankungen ziehen. Nur eine Erkenntnis bleibt: In der gewählten Dosierung führte Remdesivir bei einer – allerdings begrenzten Zahl von Patienten – nicht zu toxischen Wirkungen. Dies ist ein Grund, weshalb auch bei den inzwischen initiierten klinischen Studien, in denen die Sicherheit und Wirksamkeit von Remdesivir bei COVID-19 untersucht wird, das gleiche Dosierungsregime beibehalten wurde: Initial wird eine Dosis von 200 mg intravenös gegeben, danach werden täglich einmal 100 mg infundiert. Da bisher keine spezifische Therapie für die Infektion etabliert ist, und vor dem Hintergrund früherer Erfahrungen, sind einige Studien als Placebo-kontrollierte Doppelblindstudien konzipiert, in anderen wird die Patientengruppe, die Remdesivir erhält, mit anderen Kranken verglichen, bei denen nur die Standardtherapie angewendet wird.
Die Studien unterscheiden sich auch hinsichtlich der Einschlusskriterien, wie Schweregrad und Dauer der Erkrankung bis zum Zeitpunkt der Randomisierung. In Studien des Herstellers Gilead Sciences wird darüber hinaus auch der Einfluss einer unterschiedlichen Behandlungsdauer von fünf oder zehn Tagen untersucht. Ein gemeinsames Merkmal sämtlicher Studien ist jedoch die Dosierung – alle Patienten erhalten das gleiche Regime. Es ist nicht bekannt, warum nicht auch zumindest in einer Studie höhere Dosierungen eingesetzt werden. Die ersten Ergebnisse aus den Studien sollen bereits im April 2020 vorliegen. Eine Übersicht zu den Studien wurde bereits in einem früheren Beitrag in der DAZ veröffentlicht (DAZ 2020, Nr. 10, S. 24), Details zu den Studien zu Remdesivir sind auf der Website www.clinicaltrials.gov unter dem Stichwort „Remdesivir“ abrufbar.
Fazit
In vitro hemmt Remdesivir etliche RNA-Viren bereits in niedrigen Konzentrationen, darunter auch das neuartige Coronavirus SARS-CoV-2. Der noch nicht zugelassene Wirkstoff war bei Ebola-infizierten nicht menschlichen Primaten in höherer Dosierung von 10 mg/kg wirksam. Niedrigere Dosierungen von 3 mg/kg oder weniger waren unwirksam im Experiment und konnten auch bei Ebolapatienten nicht überzeugen. Da es bisher keine nachgewiesene wirksame Therapie gibt, muss auch Remdesivir erst in klinischen Studien zeigen, wo Stärken und Schwächen der Substanz liegen. Auch die Frage nach der optimalen Dosierung bei Patienten mit COVID-19 muss gestellt werden. Auf der Basis der publizierten Daten kann diese Frage nicht fundiert beantwortet werden. Mit ersten Ergebnissen der klinischen Studien ist in den nächsten Wochen zu rechnen. |
Literatur
Mulangu S et al. A Randomized, Controlled Trial of Ebola Virus Disease Therapeutics. N Engl J Med. 2019 Dec 12;381(24):2293-2303
Sheahan TP et al. Broad-spectrum antiviral GS-5734 inhibits both epidemic and zoonotic coronaviruses. Sci Transl Med. 2017 Jun 28;9(396). pii: eaal3653 PubMed PMID: 28659436
Siegel D, Hui HC, Doerffler E et al. Discovery and Synthesis of a Phosphoramidate Prodrug of a Pyrrolo[2,1-f][triazin-4-amino] Adenine C-Nucleoside (GS-5734) for the Treatment of Ebola and Emerging Viruses. J Med Chem. 2017 Mar 9;60(5):1648-1661.
Wang M et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro. Cell Research 2020 (ahead of print, February 4, 2020) Open Access
Warren TK, Jordan R, Lo MK et al. Therapeutic efficacy of the small molecule GS-5734 against Ebola virus in rhesus monkeys. Nature. 2016 Mar 17;531(7594):381-5. Erratum in: ACS Chem Biol. 2016 May 20;11(5):1463. PubMed PMID: 26934220; PubMed Central PMCID: PMC5551389.
Yao X, Ye F, Zhang M et al. In Vitro Antiviral Activity and Projection of Optimized Dosing Design of Hydroxychloroquine for the Treatment of Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2). Clin Infect Dis. 2020 Mar 9. pii: ciaa237. doi: 10.1093/cid/ciaa237. [Epub ahead of print] PubMed PMID: 32150618.






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.