
- DAZ.online
- DAZ / AZ
- DAZ 48/2018
- Impfen gegen Migräne
Arzneimittel und Therapie
Impfen gegen Migräne
Erenumab (Aimovig®) zur Prophylaxe eingeführt
Die Migräne belegt weltweit hinter Zahnkaries und Kopfschmerz vom Spannungstyp den dritten Platz der häufigsten Erkrankungen des Menschen [1]. Die Einjahresprävalenz für alle Formen der Migräne beträgt in Europa 43,6% bei Frauen und 26,9% bei Männern [2]. Jeden Tag sind allein in Deutschland etwa 900.000 Menschen von Migräneattacken betroffen. 100.000 Menschen sind wegen Migräneanfällen pro Tag arbeitsunfähig und bettlägerig. Drei Millionen Deutsche nehmen im Mittel täglich eine Kopfschmerztablette in der Selbstmedikation ein. Rund 59.000 Triptan-Einzeldosen werden in Deutschland jeden Tag zur Behandlung von Migräneattacken verwendet[3].
CGRP-Antikörper gegen Entzündungsreaktionen
Der Migräneschmerz basiert nach heutigen Erkenntnissen auf einer neurogenen Entzündungsreaktion an den Arterien der Hirnhäute. Entzündungsstoffe werden dort im Initialstadium der Migräneattacke freigesetzt [4 – 7]. Diese führen zu einer verstärkten Schmerzempfindlichkeit der Hirnhäute mit Schwellung und Erweiterung der Gefäßwände. Jeder Pulsschlag führt zu einem pochenden, hämmernden Migräneschmerz, jede Bewegung des Kopfes tut weh und verstärkt den Schmerz. Migränepatienten versuchen daher im Anfall möglichst Ruhe und Reizabschirmung einzuhalten sowie körperliche Tätigkeit und Erschütterungen zu vermeiden.
In den letzten Jahren ist es gelungen, spezifische Antikörper gegen Botenstoffe zu entwickeln, welche die Entzündung während des Migräneanfalles bedingen. Im Mittelpunkt steht dabei das Calcitonin Gene-Related Peptide, kurz CGRP [8 – 13]. Das Neuropeptid besteht aus 37 Aminosäuren und wird durch das identische Gen wie das Hormon Calcitonin kodiert. CGRP zählt zu den stärksten gefäßerweiternden Substanzen und spielt eine wichtige Rolle in der Entstehung der Migräne (s. Abbildung 1).
Gegen CGRP bzw. dessen Rezeptor gerichtete monoklonale Antikörper können die Wirkung dieser Entzündungsmediatoren für einige Wochen stoppen und die Wahrscheinlichkeit für Migräneattacken reduzieren. Es wurden vier Antikörper entwickelt und in zahlreichen Studien getestet: Erenumab (AMG 334) blockiert den CGRP-Rezeptor; Galcanezumab (LY2951742), Fremanezumab (TEV-48125) und Eptinezumab richten sich gegen den Liganden (ALD403) [10, 14 – 22]. Die Wirksamkeit der Antikörper wurde in groß angelegten Studien belegt. Erenumab wurde als erster Vertreter dieser neuen Wirkstoffklasse im Juli 2018 in Deutschland zugelassen und ist seit November 2018 in den Apotheken erhältlich.
Erenumab: erster Vertreter der Wirkstoffklasse
Erenumab ist zugelassen zur Migräneprophylaxe bei Erwachsenen mit mindestens vier Migränetagen pro Monat. Für den CGRP-Rezeptor-Blocker liegen Studiendaten für die episodische Migräne, d. h. bis zu 14 Kopfschmerztage pro Monat, und die chronische Migräne, d. h. mehr als 15 Kopfschmerztage pro Monat, vor [23 – 32]. Die Reduktion der Migränetage pro Monat im Vergleich zu Placebo liegt mit etwa ein bis drei Migränetagen in ähnlichen Größenordnungen wie durch die bisherigen für diese Indikation zugelassenen Prophylaktika. Direkte Vergleichsstudien wurden bislang allerdings noch nicht durchgeführt.
Lesetipp
Im Beitrag „Zielgerichtet gegen Migräne“ in DAZ 2018, Nr. 28, S. 38, erfahren Sie mehr zum Wirkmechanismus der CGRP-Antikörper und zu den verschiedenen Vertretern der neuen Substanzklasse.
Bei der Verordnung hat daher das Wirtschaftlichkeitsgebot eine besondere Bedeutung: Der Preis für die monatliche Dosis von 70 mg Erenumab (Aimovig®) beträgt 688,36 Euro. Dies entspricht Jahrestherapiekosten von 8260,32 Euro, die möglicherweise über Jahre oder Jahrzehnte anfallen können. Bei einer Behandlung mit 140 mg Erenumab betragen die Jahrestherapiekosten 16.520,64 Euro.
Es ist derzeit noch nicht abschließend festgelegt, für welche Migräneformen und für welche Patienten die Erstattung durch gesetzliche Krankenkassen erfolgen wird. Um das Wirtschaftlichkeitsgebot zu erfüllen, wird aufgrund der hohen Kosten die neue Immuntherapie erst dann zu erwägen sein, wenn die bisherigen verfügbaren speziellen Verhaltensmaßnahmen und vorbeugenden Migränemittel nicht effektiv sind, nicht vertragen werden oder wegen Gegenanzeigen nicht eingenommen werden dürfen.
Vor diesem Hintergrund strebt der Hersteller eine zeitlich begrenzte Erstattung für schwer betroffene Migränepatienten an, bei denen vier (für die episodische Migräne, d. h. weniger als 15 Kopfschmerztage pro Monat) bis fünf (für die chronische Migräne, d. h. 15 und mehr Kopfschmerztage pro Monat) zugelassene Vortherapien erfolglos waren. Welche Vortherapien dies genau sein sollen, ist aktuell noch nicht verbindlich definiert. Nach den Leitlinien sind für die Behandlung der episodischen Migräne Amitriptylin, Betablocker (Metoprolol, Propranolol, Bisoprolol), Flunarizin, Topiramat und Valproat relevant. Für die vorbeugende Behandlung der chronischen Migräne ist als derzeit einziges dafür spezifisch zugelassenes Arzneimittel Onabotulinumtoxin zusätzlich zu berücksichtigen. Für Patienten, bei denen diese Vortherapien nicht sachgerecht abgearbeitet wurden, soll die Verordnungsfähigkeit eingeschränkt sein.
Grünes Licht für Galcanezumab
Die Europäische Kommission hat am 20. November 2018 Galcanezumab (Emgality®) zur Migräne-Prophylaxe bei Erwachsenen mit mindestens vier Migränetagen pro Monat in der Europäischen Union zugelassen. Verabreicht wird Galcanezumab als subkutane Injektion (120 mg) mit einem Fertigpen oder einer Fertigspritze. Aufgrund offener Fragen zur Patentsituation ist aktuell der Zeitraum für eine Markteinführung offen. Lilly hat zudem bei der US-amerikanischen Regulierungsbehörde FDA die Zulassung für Galcanezumab in der Prophylaxe des episodischen Cluster-Kopfschmerzes beantragt. Für Europa ist die Einreichung für diese Indikation 2019 geplant.
Nicht jeder Patient profitiert
Direkte Evidenz eines Zusatznutzens für die Behandlung der so angestrebten Patientengruppe lässt sich jedoch nicht unmittelbar aus den Daten erkennen – obwohl in der LIBERTY-Studie eine vortherapierte Population betrachtet wurde [30]. In der Studie wurden die Wirksamkeit und Sicherheit von 140 mg Erenumab bei Patienten mit episodischer Migräne mit vier bis 14 Migränetagen pro Monat untersucht, bei denen zwei bis vier vorherige vorbeugende Therapien aufgrund mangelnder Wirksamkeit oder nicht tolerierbarer Nebenwirkungen versagt hatten. Dabei zeigten lediglich 30,3% unter Erenumab 140 mg gegenüber 13,7% unter Placebo eine Reduktion der monatlichen Kopfschmerztage um mindestens 50%. Klinisch bedeutet dies jedoch lediglich eine absolute Reduktion von 1,76 Kopfschmerztagen pro Monat unter 140 mg Erenumab und 0,15 Kopfschmerztagen pro Monat unter Placebo. Die Tage mit spezifischer Akutmedikation für Migräne pro Monat reduzierten sich um - 1,3 Tage unter Erenumab 140 mg gegenüber + 0,5 Tage unter Placebo. Unter den Studienvoraussetzungen ist somit bei rund 70% der behandelten Patienten keine signifikante Wirkung zu erwarten.
Es ist dabei zu beachten, dass diese bisher einzige Studie, die eine Wirksamkeit bei anderweitigem Therapieversagen thematisiert, nicht mit der zur Verfügung gestellten Standarddosis von 70 mg, sondern mit 140 mg Erenumab bei episodischer Migräne durchgeführt wurde. Die vorherigen erfolglosen Therapien umfassten zudem nicht explizit die jetzt im Rahmen der angestrebten Erstattungseinschränkung in Deutschland fokussierten vier Wirkstoffe. Sie schlossen Amitriptylin, Candesartan, Flunarizin, Lisinopril, Metoprolol, Propranolol, Topiramat, Valproat, Venlafaxin u. a. ein. 39% der Studienteilnehmer hatten bislang sogar erst zwei Prophylaktika erfolglos eingesetzt. Der Zusatznutzen von 70 mg Erenumab im Vergleich zu den bisherigen Therapieoptionen ist daher aktuell weder für die episodische noch für die chronische Migräne durch Studiendaten belegt. Für die schwer betroffene Patientengruppe mit chronischer Migräne mit komplettem Versagen der Migräneprophylaktika der ersten Wahl ist die Wirkung von 70 mg als auch 140 mg Erenumab völlig offen.
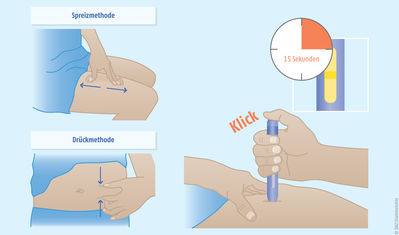
Applikation mittels Autoinjektor alle vier Wochen
Die Behandlung sollte von Ärzten eingeleitet werden, die mit der Diagnose und der Behandlung von Migräne Erfahrung haben. Erenumab wird subkutan mithilfe eines Autoinjektors durch die Patienten selbst appliziert (s. Abbildung 2). Die Injektion kann am Bauch, am Oberschenkel oder an der Außenseite des Oberarms erfolgen. Bei jeder Folgeinjektion sollte eine andere Injektionsstelle gewählt werden. Injektionen dürfen nicht in empfindliche, verletzte, gerötete oder verhärtete Hautpartien gegeben werden. Der Autoinjektor ist für den einmaligen Gebrauch bestimmt. Vielen Migränepatienten ist der Umgang mit dem Autoinjektor vertraut, da ein nahezu identischer Pen auch zur subkutanen Applikation von Sumatriptan verwendet wird. Im Unterschied dazu wird der Pen jedoch nicht in der Attacke bei Bedarf eingesetzt. Die Anwendung erfolgt vielmehr in festen Zeitabständen von vier Wochen zur Vorbeugung nach definiertem Behandlungsplan.
Bei der Immuntherapie mit Erenumab handelt es sich um eine passive Immunisierung. Die Antikörper werden nicht selbst im menschlichen Körper gebildet, sondern im Labor als ein vollständig humaner monoklonaler IgG2-Antikörper in Ovarialzellen chinesischer Hamster (CHO) mithilfe rekombinanter DNA-Technologie hergestellt. Aus diesem Grund muss die Gabe regelmäßig wiederholt werden. Immuntherapie oder passive „Impfung“ bedeutet nicht, dass die Erkrankung nicht mehr auftritt. Vielmehr wird das Risiko für zukünftige Attacken gesenkt. Während des Dosierungszeitraums wird Erenumab vorwiegend über einen unspezifischen proteolytischen Weg eliminiert und hat eine Eliminationshalbwertszeit von ca. 28 Tagen.
Die empfohlene Dosis beträgt 70 mg Erenumab alle vier Wochen. Manche Patienten können von einer Dosis mit 140 mg profitieren, welche in Form von zwei subkutanen Injektionen mit jeweils 70 mg verabreicht wird. In klinischen Studien zeigte sich durch die Dosierung mit 140 mg eine zahlenmäßig höhere Ansprechrate, die statistisch jedoch nicht signifikant war [23, 28 – 30, 32]. Das Ansprechen auf die Therapie kann sich bereits in den ersten beiden Behandlungswochen abzeichnen. Bei Patienten, die nach drei Monaten noch nicht auf die Therapie angesprochen haben, sollte die Behandlung nicht weitergeführt werden. Die Behandlung sollte kontinuierlich evaluiert werden. Zur Verlaufs- und Erfolgskontrolle eignet sich die Migräne-App (kostenlos für iOS und Android erhältlich), die eine genaue quantitative Evaluation der Vorbeugung und der Akuttherapie ermöglicht (s. DAZ 2018, Nr. 35, S. 27). Zudem werden umfangreiches Wissen zur Migräne und Verhaltenstechniken an Betroffene vermittelt.
Vor der Anwendung auf Raumtemperatur bringen
Das Arzneimittel ist im Kühlschrank bei zwei bis acht Grad Celsius zu lagern und nicht einzufrieren. Der Autoinjektor soll im Umkarton lichtgeschützt aufbewahrt werden. Wird das Arzneimittel bei Raumtemperatur bis zu 25 Grad Celsius gelagert, muss es innerhalb von 14 Tagen angewendet oder entsorgt werden. Vor der Anwendung sollte die Lösung visuell überprüft werden. Enthält sie Trübungen, Flocken, Partikel oder eine Gelbfärbung, darf sie nicht verwendet werden. Zur Vermeidung von Beschwerden an der Injektionsstelle sollte der Autoinjektor vor der Injektion aus der Kühlung entnommen und mindestens 30 Minuten bei Raumtemperatur unter Vermeidung von Schütteln und direkter Sonneneinstrahlung oder anderer Wärmequellen aufbewahrt werden.
Bei Übergebrauchskopfschmerz: Medikamentenpause vor Therapiebeginn
Etwa 50% der Patienten mit mehr als 15 Kopfschmerztagen pro Monat seit mindestens drei Monaten haben neben der ursprünglichen primären Kopfschmerzform als weiteren ursächlichen Grund für die zunehmende Häufung der Kopfschmerztage einen Medikamentenübergebrauchskopfschmerz (MÜK) [3, 33]. Die meisten Betroffenen zeigen im Gegensatz zur Ausgangssituation nach einer Medikamentenpause eine Reduktion der Kopfschmerztage pro Monat und ein erneutes Ansprechen auf vorbeugende sowie Akutmedikation. Die Beratung dazu, das Wissen um den Zusammenhang und die Konsequenzen des MÜK sind daher essenziell (s. auch DAZ 2018, Nr. 30, S. 18). Betroffene Patienten sollten aufgrund der ursächlichen Behandelbarkeit des MÜK und aus Wirtschaftlichkeitsgründen vor Einleitung einer Behandlung mit Erenumab eine adäquate Medikamentenpause über zwei bis vier Wochen durchführen und zum Einhalten der 10-20-Regel angehalten werden: Schmerzmittel und spezifische Migränemittel sollten an weniger als 10 Tagen pro Monat verwendet werden, mindestens 20 Tage im Monat sollten komplett frei von deren Einnahme sein.
Als Nebenwirkungen werden bei 70 mg bzw. 140 mg Erenumab Reaktionen an der Injektionsstelle, Obstipation, Muskelspasmen und Pruritus berichtet. Die meisten dieser Nebenwirkungen sind von leichter oder mittlerer Schwere. Langzeitwirkung und Langzeitnebenwirkungen sind aktuell jedoch noch nicht bekannt. Aus Vorsicht soll eine Anwendung von Erenumab während der Schwangerschaft vermieden werden. Auf eine ausreichende Kontrazeption ist daher zu achten.
Fazit
Die neue Immuntherapie ist im Gegensatz zu allen anderen bisher verfügbaren vorbeugenden Medikamenten erstmals spezifisch für die Migränevorbeugung entwickelt worden. Eine langsame Aufdosierung wegen eventueller Unverträglichkeiten und Nebenwirkungen ist nicht erforderlich. Der Wirkeintritt erfolgt bei Ansprechen schnell initial innerhalb von wenigen Tagen. Nebenwirkungen der bisherigen migränevorbeugenden Mittel wie z. B. Gewichtszunahme, Stimmungsveränderungen, Müdigkeit, Antriebsreduktion oder Benommenheit sind nicht zu erwarten. Die bisher verfügbaren Daten zeigen jedoch, dass man nicht davon ausgehen darf, dass mit dem neuen Wirkprinzip die Migräne aufhört und man leben kann, wie man will. Rund 70% – und möglicherweise noch mehr – der Patienten mit episodischer Migräne mit bisher erfolglosen anderen Therapieversuchen werden wahrscheinlich auch auf den neuen Wirkmechanismus nicht ansprechen. Wer zu den 30% Respondern gehört, kann bislang nicht vorhergesagt werden. Wie groß die Wirksamkeit bei Patienten mit einer chronischen Migräne ist, die bislang auf keine Standardprophylaxe einschließlich Onabotulinumtoxin angesprochen haben und am meisten eine Besserung ihres Zustandes erhoffen, ist zurzeit unbekannt. Vom Studienprogramm waren sie ausgeschlossen. |
Literatur
[1] Steiner TJ et al. Migraine: the seventh disabler. Cephalalgia 2013;33:289-290
[2] Steiner TJ et al. The impact of headache in Europe: principal results of the Eurolight project. J Headache Pain 2014;15:31
[3] Göbel H. Die Kopfschmerzen. Ursachen, Mechanismen, Diagnostik und Therapie in der Praxis. Springer-Verlag Berlin Heidelberg, 2012
[4] Charles A. The pathophysiology of migraine: implications for clinical management. Lancet Neurol 2018;17:174-182
[5] Dodick DW. A Phase-by-Phase Review of Migraine Pathophysiology. Headache 2018;58Suppl 1:4-16
[6] Goadsby PJ et al. Pathophysiology of Migraine: A Disorder of Sensory Processing. Physiol Rev 2017;97:553-622
[7] Ong JJY et al. Recent Advances in Pharmacotherapy for Migraine Prevention: From Pathophysiology to New Drugs. Drugs 2018;78:411-437
[8] Ashina H, Schytz HW, Ashina M. CGRP in Human Models of Migraine. Handb Exp Pharmacol, 2018
[9] Edvinsson L. The CGRP Pathway in Migraine as a Viable Target for Therapies. Headache 2018;58 Suppl 1:33-47
[10] Edvinsson L et al. CGRP as the target of new migraine therapies - successful translation from bench to clinic. Nat Rev Neurol 2018;14:338-350
[11] Holland PR. Foreword: The CGRP Pathway and Migraine Prevention: Reducing the Burden of Disease. Headache 2018;58Suppl1:1-3
[12] Maasumi K et al. CGRP and Migraine: The Role of Blocking Calcitonin Gene-Related Peptide Ligand and Receptor in the Management of Migraine. Drugs 2018;78:913-928
[13] Messina R, Goadsby PJ. CGRP - a target for acute therapy in migraine: Clinical data. Cephalalgia 2018:doi: 10.1177/0333102418768095
[14] Cauchi M, Robertson NP. CGRP and migraine. J Neurol 2016;263:192-194
[15] Deen M et al. Blocking CGRP in migraine patients - a review of pros and cons. J Headache Pain 2017;18:96
[16] Edvinsson L. The Journey to Establish CGRP as a Migraine Target: A Retrospective View. Headache 2015; 55:1249-1255
[17] Fiala JL, Lowery D. Patent watch: Migraine therapies targeting the CGRP pathway: intellectual property landscape. Nat Rev Drug Discov 2016;15:8-9
[18] Karsan N, Goadsby PJ. CGRP mechanism antagonists and migraine management. Curr Neurol Neurosci Rep 2015;15:25
[19] Khan S et al. CGRP, a target for preventive therapy in migraine and cluster headache: Systematic review of clinical data. Cephalalgia 2017:doi:10.1177/0333102417741297
[20] Wrobel Goldberg S, Silberstein SD. Targeting CGRP: A New Era for Migraine Treatment. CNS Drugs 2015; 29:443-452
[21] Yuan H et al. CGRP Monoclonal Antibodies for Migraine: Rationale and Progress. BioDrugs 2017;31:487-501
[22] Tepper SJ History and Review of anti-Calcitonin Gene-Related Peptide (CGRP) Therapies: From Translational Research to Treatment. Headache 2018;58 Suppl 3:238-275
[23] Ashina M et al. Erenumab (AMG 334) in episodic migraine: Interim analysis of an ongoing open-label study. Neurology 2017;89:1237-1243
[24] Ashina M et al. Efficacy and safety of erenumab (AMG334) in chronic migraine patients with prior preventive treatment failure: A subgroup analysis of a randomized, double-blind, placebo-controlled study. Cephalalgia 2018;38:1611-1621
[25] de Hoon J et al. Phase 1, randomized, parallel-group, double-blind, placebo-controlled trial to evaluate the effects of erenumab (AMG 334) and concomitant sumatriptan on blood pressure in healthy volunteers. Cephalalgia 2018;doi: 10.1177/0333102418776017
[26] de Hoon J et al. Phase I, Randomized, Double-blind, Placebo-controlled, Single-dose, and Multiple-dose Studies of Erenumab in Healthy Subjects and Patients With Migraine. Clin Pharmacol Ther 2018;103:815-825
[27] Depre C et al. A Randomized, Double-Blind, Placebo-Controlled Study to Evaluate the Effect of Erenumab on Exercise Time During a Treadmill Test in Patients With Stable Angina. Headache 2018;58:715-723
[28] Dodick DW et al. ARISE: A Phase 3 randomized trial of erenumab for episodic migraine. Cephalalgia 2018; 38:1026-1037
[29] Goadsby PJ et al. A Controlled Trial of Erenumab for Episodic Migraine. N Engl J Med 2017;377:2123-2132
[30] Reuter U et al. Efficacy and tolerability of erenumab in patients with episodic migraine in whom two-to-four previous preventive treatments were unsuccessful: a randomised, double-blind, placebo-controlled, phase 3b study. Lancet 2018;doi: 10.1016/S0140-6736(18)32534-0
[31] Schwedt T et al. Early onset of efficacy with erenumab in patients with episodic and chronic migraine. J Headache Pain 2018;19:92
[32] Tepper S et al. Safety and efficacy of erenumab for preventive treatment of chronic migraine: a randomised, double-blind, placebo-controlled phase 2 trial. Lancet Neurol 2017;16:425-434
[33] Göbel H, Heinze A. Chronic migraine and headache by medication overuse. Evolution and revision of classification. Schmerz 2011;25:493-500

































0 Kommentare
Das Kommentieren ist aktuell nicht möglich.