
- DAZ.online
- DAZ / AZ
- DAZ 28/2018
- Zielgerichtet gegen Migr...
Arzneimittel und Therapie
Zielgerichtet gegen Migräne
Prophylaxe mit neuen CGRP-Antikörpern steht vor der Zulassung
Migräne ist eine der häufigsten Kopfschmerzformen; ihre 1-Jahres-Prävalenz liegt zwischen 10 und 15%. Man unterscheidet die episodische Migräne mit weniger als 15 Migränetagen und die chronische Form mit mehr als 15 Migränetagen pro Monat. Je nach Häufigkeit und Stärke der Migräneattacken ist eine Migräneprophylaxe angezeigt. Dadurch sollen Häufigkeit, Schwere und Dauer der Migräneattacken verringert und ein Übergebrauch von Schmerz- und Migränemitteln verhindert werden. Zur medikamentösen Migräneprophylaxe werden vor allem Propranolol und Metoprolol, Flunarizin, Valproinsäure, Topiramat sowie Amitriptylin eingesetzt. Ihre Wirksamkeit ist indes nicht immer überzeugend, hinzu kommen unerwünschte Wirkungen, die die Adhärenz beeinträchtigen können. Den genannten Arzneistoffen ist auch gemein, dass sie nicht zur Migräneprophylaxe entwickelt wurden und an keinem spezifischen Target innerhalb der Migränepathogenese wirken. Im Gegensatz hierzu greifen die neu entwickelten CGRP-Antagonisten gezielt beim Entstehungsprozess der Migräne ein.
Pathophysiologie der Migräne
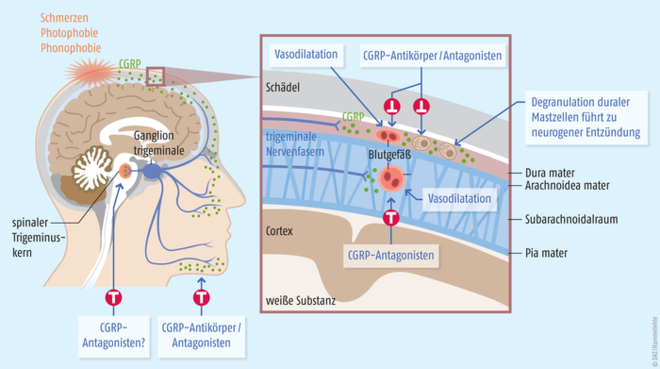
Die multikausale Pathophysiologie der Migräne ist nicht in allen Einzelheiten bekannt. Aufgrund vorliegender Kenntnisse und Hypothesen wird derzeit zur Erklärung pathogenetischer Vorgänge und zum Verständnis der Wirkweise einiger Migränemedikamente die neurovaskuläre Theorie bevorzugt. Dieser zufolge beruht die Migräne teilweise auf einer Überaktivität von Nervenzellen im Hirnstamm. Die Aktivierung des trigemino-vaskulären Systems bewirkt Entzündungsreaktionen in den großen Gehirn- und Gehirnkranzgefäßen. Es kommt zu einer erhöhten Ausschüttung vasoaktiver Neuropeptide wie CGRP oder Substanz P, die zu einer Gefäßerweiterung der Gehirnkranzgefäße führen und die Gefäßwände durchlässig machen (Extravasation). In der Folge werden vermehrt entzündliche Neurotransmitter wie etwa Serotonin freigesetzt. Diese neurogene Entzündung verursacht wiederum ausstrahlende Schmerzimpulse, die als Migränekopfschmerz wahrgenommen werden.
Das Neuropeptid CGRP und seine Rezeptoren
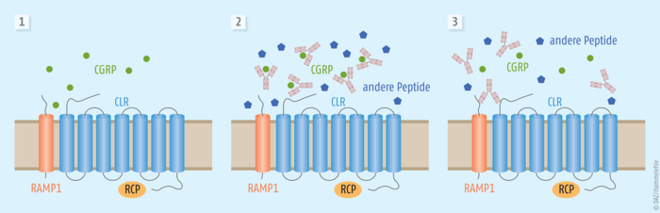
Wie gezeigt wurde, ist an der Entstehung einer Migräne auch das Calcitonin Gene-Related Peptide (CGRP) beteiligt. Das vor rund 30 Jahren entdeckte ubiquitär im ZNS und in vielen Organen vorkommende Neuropeptid gehört zur Familie der Calcitonin-Peptide, die aus Calcitonin, Adrenomedullin und Amylin besteht. Diese Neuropeptide sind primär in marklosen Nervenfasern (C-Fasern) lokalisiert und agieren in unterschiedlichen Bereichen des Organismus. CGRP ist eine der stärksten gefäßerweiternden endogenen Substanzen und wird im peripheren und im zentralen Nervensystem exprimiert. Es besteht aus 37 Aminosäuren und tritt in zwei Isoformen auf. Es wird durch dasselbe Gen wie Calcitonin codiert und durch selektives Splicing der mRNA gebildet. Physiologische und pathophysiologische Effekte erfolgen durch eine Bindung an spezielle Rezeptoren. Diese Rezeptoren bestehen aus einem Calcitonin Receptor-like Receptor (CLR), dessen Funktionalität wiederum an die Verlinkung mit dem Receptor Activity Modifying Protein (RAMP1, RAMP2, RAMP3) gekoppelt ist. Zur optimalen Funktion des Rezeptors bedarf es noch eines dritten, Membran-assoziierten Proteins, das als Receptor Component Protein (RCP) bezeichnet wird (s. Abb. 1). An diese Rezeptoren (CLR, RAMP, RCP) binden auch die weiteren Vertreter der Calcitonin-Peptide, allerdings mit unterschiedlicher Aktivität (s. auch Abb. 1).
Wirkungen von CGRP
Das Neuropeptid CGRP ist bei der Regulation zahlreicher physiologischer Vorgänge wie etwa der renalen glomerulären Filtrationsrate, dem Knochenstoffwechsel, dem Schutz der Magenmukosa und bei der Homöostase des kardiovaskulären Systems beteiligt. Aufgrund seiner starken vasodilatatorischen Wirkung besitzt es protektive Funktionen im kardiovaskulären System, ist aber auch an der Pathogenese einer Migräne beteiligt und in die Schmerzverarbeitung involviert. Ferner spielt es bei weiteren Erkrankungen wie Arthritis, Diabetes, Adipositas, bei der Wundheilung und Hauterkrankungen eine Rolle, die aber nur ansatzweise bekannt ist.
CGRP bei Migräne und neue Therapieansätze
Zahlreiche Hinweise unterstreichen die Rolle des Neuropeptids CGRP beim Zustandekommen der Migräne: Während spontaner Migräneattacken sind die CGRP-Konzentrationen in der Jugularvene erhöht. Nach Triptan-Gabe sinken zeitgleich mit dem Rückgang der Beschwerden die CGRP-Serumspiegel. Des Weiteren sind die Serumkonzentrationen des Neuropeptids bei chronischer Migräne und – in geringerem Ausmaß auch bei episodischer Migräne – interiktal, also zwischen den Anfällen, erhöht. Schließlich können i.v.-Infusionen von CGRP Kopfschmerzattacken triggern, die von spontanen Migräneanfällen nicht zu unterscheiden sind.
Dieser Hintergrund führte zur Entwicklung zweier neuer Wirkstoffgruppen:
- small moleculs (CGRP-Antagonisten; Gepante); sie haben ein Molekulargewicht < 1000 Da, eine kurze Halbwertszeit und wirken überwiegend zentral. Gepante waren in Studien zur Therapie der akuten Migräne wirksam, die Weiterentwicklung von zwei Vertretern wurde allerdings aufgrund lebertoxischer Wirkungen gestoppt. Ein neuer Vertreter, Ubrogepant, befindet sich derzeit in der klinischen Prüfung und soll bei akuter Migräne eingesetzt werden.
- monoklonale Antikörper (CGRP-Antikörper); sie haben ein Molekulargewicht von schätzungsweise 150.000 Da, eine lange Halbwertszeit und wirken überwiegend peripher. Sie richten sich gegen CGRP oder dessen Rezeptor und sollen zur Migräneprophylaxe eingesetzt werden.
Derzeit sind vier monoklonale Antikörper gegen CGRP bzw. dessen Rezeptor in der klinischen Prüfung: Erenumab, Fremanezumab, Galcanezumab und Eptinezumab (s. Tab. 1). Während Erenumab den CGRP-Rezeptor blockiert, wirken die anderen drei Vertreter am Neuropeptid CGRP. Ihre Wirksamkeit wurde bereits in klinischen Phase-3-Studien nachgewiesen, bei denen sie jeweils mit Placebo verglichen wurden. Ein Vergleich untereinander steht noch aus. Aufgrund ihres gleichen bzw. ähnlichen Wirkmechanismus ist mit keinen großen Unterschieden im Hinblick auf ihr Wirksamkeits- und Sicherheitsprofil zu rechnen. Allerdings könnten Unterschiede in ihrer Struktur und Pharmakodynamik sowie bei Assoziations- und Dissoziationsraten die therapeutische Aktivität beeinflussen.
Die Blut-Hirn-Schranke kann durch monoklonale Antikörper normalerweise nicht überwunden werden; d. h. es ist mit keinen zentralnervösen Wirkungen zu rechnen. Allerdings ist unklar, ob diese Barriere bei heftigen Migräneattacken bestehen bleibt.
Wirkstoff |
Hersteller |
Target |
Struktur |
Halbwertszeit |
Indikation |
Gabe |
|---|---|---|---|---|---|---|
Erenumab (Erenumab-aooe, AM 334; Aimovig®) |
Novartis/Amgen |
CGRP-Rezeptor |
humaner monoklonaler IgG2-Antikörper |
28 d |
episodische und chronische Migräne |
s.c. |
Fremanezumab (TEV-48125) |
TEVA |
CGRP |
humanisierter monoklonaler IgG2-Antikörper |
45 d |
episodische und chronische Migräne |
s.c. |
Galcanezumab (LY2951742) |
Lilly |
CGRP |
humanisierter monoklonaler IgG4-Antikörper |
28 d |
episodische und chronische Migräne |
s.c. |
Eptinezumab (ALD403) |
Alder Biopharmaceuticals |
CGRP |
humanisierter monoklonaler IgG1-Antikörper |
30 d |
episodische und chronische Migräne |
i.v. |
Günstiges Sicherheitsprofil
Alle vier Wirkstoffe werden nicht über CYP450 metabolisiert, so dass nur ein geringes Interaktionsrisiko besteht. Gleichfalls ist die Gefahr erhöhter Creatinin-Werte oder eines Anstiegs hepatischer Enzyme gering. Auch zeigten sich in den vorliegenden Studien mit monoklonalen Antikörpern keine Hinweise auf ernsthafte immunvermittelte Reaktionen. Hinweise auf ein erhöhtes kardiovaskuläres oder hepatisches Risiko liegen derzeit nicht vor. Letzteres wurde besonders aufmerksam verfolgt, da einige zentral wirkende CGRP-Antagonisten (small moleculs; Gepante) hepatotoxische Wirkungen aufwiesen.
Da das Neuropeptid CGRP bei der Regulation zahlreicher physiologischer Vorgänge wie etwa der renalen glomerulären Filtrationsrate, dem Knochenstoffwechsel, dem Schutz der Magenmukosa und bei der Homöostase des kardiovaskulären Systems (CGRP als endogener Vasodilatator) beteiligt ist, wurde möglichen unerwünschten Wirkungen ein besonderes Augenmerk geschenkt. Es ergaben sich aber keine Hinweise auf gravierende Nebenwirkungen, und das Sicherheitsprofil von CGRP-Antikörpern wird als günstig erachtet. Angaben über Auswirkungen eines dauerhaften Einsatzes liegen derzeit nicht vor.
Ein weiterer Vorteil von CGRP-Antikörpern ist ihre lange Halbwertszeit, die monatliche oder eventuell vierteljährliche Gaben erlauben. Erfolgt die Applikation subkutan, kann sie von einem geschulten Patienten selbst vorgenommen werden. Die langen Applikationsintervalle und das als günstig beurteilte Sicherheitsprofil fördern vermutlich die Adhärenz.
Klinische Studien und Zulassungsstatus
Für alle vier Vertreter liegen klinische Daten vor, die bei Migräne-Patienten einen schnellen Wirkeintritt, Responderraten im Bereich von zumeist 30% bis 60% und geringe Nebenwirkungsraten belegen. Ferner wurden mit allen vier CGRP-Antikörpern gemäß Eintragungen des amerikanischen Studienregisters bereits Phase-3-Studien durchgeführt (Tab. 2). Im Folgenden werden einige Studienergebnisse kurz skizziert (Tab. 3).
Wirkstoff |
Anzahl der Studieneinträge; (davon Phase-3-Studien) |
Studienarme |
Untersuchte Indikation im Rahmen einer Studie |
|---|---|---|---|
Erenumab |
16 (4) |
Erenumab vs. Placebo |
Migräne, Kopfschmerz, stabile Angina pectoris, Hitzewallungen |
Fremanezumab |
11 (9) |
Fremanezumab vs. Placebo |
Migräne, Cluster-Kopfschmerz |
Galcanezumab |
19 (10) |
Galcanezumab vs. Placebo
(Osteoarthritis-Studie: Galcanezumab vs. Placebo vs. Celecoxib)
|
Migräne, Cluster-Kopfschmerz, Osteoarthritis am Knie |
Eptinezumab |
6 (3) |
Eptinezumab vs. Placebo (eine Studie: Eptinezumab vs. Sumatriptan) |
Migräne |
Wirkstoff |
Studie |
Anzahl der Probanden |
Dauer |
einige Ergebnisse |
Studiennummer im amerikanischen Studienregister |
|---|---|---|---|---|---|
Fremanezumab |
Phase 3; Placebo-kontrolliert |
1130 |
12 Wochen |
Je nach Dosierungsschema erfuhren rund 38 bis 41% der Teilnehmer mit chronischer Migräne eine Reduktion der Kopfschmerztage um ≥ 50%; in der Placebo-Gruppe waren es 18%. |
NCT02621931 |
Galcanezumab |
EVOLVE-1, EVOLVE-2; Phase 3; Placebo-kontrolliert |
EVOLVE-1: 1671
EVOLVE-2: 915
|
6 Monate |
In der EVOLVE-1-Studie konnte dosisabhängig eine Reduktion der monatlichen Migränetage zwischen 4,6 und 4,7 Tagen erzielt werden; in der Placebo-Gruppe waren es durchschnittlich 2,8 Tage.
In der EVOLVE-2-Studie lag die durchschnittliche Reduktion zwischen 4,3 und 4,2 Tagen; unter Placebo waren es 2,3 Tage.
|
NCT02614196 NCT02614183 |
Eptinezumab |
PROMISE-1;Phase 3; Placebo-kontrolliert |
888 |
12 Wochen |
Unter verschiedenen Dosierungen von Eptinezumab wurde eine monatliche Reduktion der Migränetage um rund 4 Tage erzielt, in der Placebo-Gruppe betrug die monatliche Abnahme 3,2 Tage. Ferner erfuhr ein größerer Anteil der Verum-Gruppe eine ≥ 75%ige Reduktion der monatlichen Migränetage im Vergleich zu den Probanden der Placebo-Gruppe. |
NCT02559895 |
Erenumab |
STRIVE, ARISE; Phase 3; Placebo-kontrolliert |
STRIVE: 995
ARISE: 577
|
STRIVE: 6 Monate
ARISE: 3 Monate
|
STRIVE: Unter Erenumab (70 oder 140 mg pro Monat) konnte die Anzahl der monatlichen Migränetage verringert werden und zwar um 3,2 Tage (70 mg) bzw. um 3,7 Tage (140 mg); in der Placebo-Gruppe wurde ein Rückgang um 1,8 Tage verzeichnet.
ARISE: Die monatliche Injektion von 70 mg Erenumab führte zu einer monatlichen Abnahme der Migränetage um 2,9 Tage gegenüber einem Rückgang um 1,8 Tage in der Placebo-Gruppe. Etwa 40% der Patienten erreichten mit Erenumab eine Halbierung der Schmerzattacken gegenüber etwa 30% in der Placebo-Gruppe.
|
STRIVE: NCT02456740
ARISE: NCT02483585
|
FDA-Zulassung und positiver CHMP-Bescheid für Erenumab
Für den bislang einzigen zugelassenen (FDA-Zulassung) CGRP-Rezeptor-Blocker Erenumab liegen mehrere Phase-3-Studien vor, so unter anderem
- die STRIVE-Studie; bei 995 Probanden mit episodischer Migräne (8,3 Migräneattacken pro Monat) wurde Erenumab (70 oder 140 mg pro Monat) mit Placebo verglichen. Unter Erenumab konnte die Anzahl der monatlichen Migränetage verringert werden und zwar um 3,2 Tage (70 mg) bzw. um 3,7 Tage (140 mg); in der Placebo-Gruppe wurde ein Rückgang um 1,8 Tage verzeichnet (NCT02456740).
- die ARISE-Studie; bei 577 Patienten mit episodischer Migräne führte die monatliche Injektion von 70 mg Erenumab zu einer monatlichen Abnahme der Migränetage um 2,9 Tage gegenüber einem Rückgang um 1,8 Tage in der Placebo-Gruppe. Etwa 40% der Patienten erreichten mit Erenumab eine Halbierung der Schmerzattacken gegenüber etwa 30% in der Placebo-Gruppe (NCT02483585).
Die Therapie wurde gut vertragen. Die häufigsten unerwünschten Wirkungen waren Lokalreaktionen an der Injektionsstelle. Ferner wurden Obstipation, Muskelkrämpfe und Juckreiz beobachtet.
Erenumab in einer Dosierung von 70 mg ist vorgesehen für die Migräneprophylaxe bei Erwachsenen, die an mindestens vier Tagen pro Monat unter Migräne leiden. Die Applikation mit dem vorgefüllten Autoinjektor kann nach Unterweisung durch den Patienten erfolgen. Erenumab wurde als erstem Vertreter aus der Gruppe der monoklonalen Antikörper im Mai 2018 die FDA-Zulassung erteilt. Der Ausschuss für Humanarzneimittel CHMP der EMA hat sich ebenfalls positiv zu einer Zulassung geäußert; der Hersteller rechnet noch in diesem Jahr mit dem Marktzugang in Europa. In den USA kostet die Behandlung etwa 6.900 US-Dollar pro Jahr. |
Literatur
Bigal ME, Walter S, Rapoport AM, Therapeutic antibodies against CGRP or its receptor. Br J Clin Pharmacol, 2015,79(6),886-95.
Dodick D et al. ARISE: trial A Phase 3 randomized trial of erenumab for episodic migraine. Cephalalgia. 2018 May;38(6):1026-1037.
Edvinsson L et al. CGRP as the target of new migraine therapies - successful translation from bench to clinic. Nature reviews. Neurology Vol. 14, No. 6 (2018), p. 338-350.
Evers S. Daten zum neuen CGRP-Antagonisten Ubrogepant bei akuter Migräne. DNP (2017) 18:21. https://doi.org/10.1007/s15202-017-1671-1.
Goadsby P. et al. A Controlled trial of Erenumab for episodic migraine. N Engl J Med 2017;377:2123-2132.
Pellesi L et al. Spotlight on Anti-CGRP Monoclonal antibodies in migraine: The clinical evidence to date. Clin Pharmacol Drug Dev. 2017 Nov;6(6):534-547. doi: 10.1002/cpdd.345. Epub 2017 Apr 14.
Qi Zhang et al. Efficacy of Galcanezumab in patients who failed to respond to preventives previously: Results from EVOLVE-1, EVOLVE-2 and REGAIN Studies (S20.004). Neurology Apr 2018,90 (15 Supplement) S20.004.
Russell FA et al. Calcitonin gene-related peptide: Physiology and pathophysiology. Physiol Rev. 2014 Oct; 94(4):1099-1142.
Saper J et al. Primary results of PROMISE-1 (prevention of migraine via intravenous Eptinezumab safety and efficacy-1) trial: a phase 3, randomized, double-blind, placebo-controlled study to evaluate the efficacy and safety of eptinezumab for prevention of frequent episodic migraines. Presented at: American Academy of Neurology 2018 Annual Meeting; April 21-27; Los Angeles, CA. Poster S20.
Silberstein S et al. Fremanezumab for the preventive treatment of chronic migraine. N Engl J Med 2017;377:2113-2122.
Stauffer V et al. Evaluation of Galcanezumab for the prevention of episodic migraine. The EVOLVE-1 randomized clinical trial. JAMA Neurol. Published online May 29, 2018. doi:10.1001/jamaneurol.2018.1212.
Tepper S et al. Safety and efficacy of erenumab for preventive treatment of chronic migraine: a randomised, double-blind, placebo-controlled phase 2 trial. Lancet Neurol, 2017,16(6),425-434.
Tso AR et al. Anti-CGRP monoclonal antibodies: the next era of migraine prevention? Curr Treat Options Neurol 2017; 19(8): 27 [Epub 27. Juni; doi: 10.1007/s11940-017-0463-4].
https://clinicaltrials.gov/ct2/results?cond=&term=AMG+334&cntry=&state=&city=&dist= (Abruf am 22.6.2018).
https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&applno=761077 (Abruf am 22.6.2018).
https://www.dgn.org/leitlinien/3583-ll-030-057-2018-therapie-der-migraeneattacke-und-prophylaxe-der-migraene (Abruf am 26.06.2018).






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.