
- DAZ.online
- DAZ / AZ
- DAZ 43/2018
- Der Kampf ums Patent
Schwerpunkt Biosimilars
Der Kampf ums Patent
Wie Originalhersteller um den Erhalt der Marktexklusivität kämpfen
Damit tatsächlich eine Fehlfunktion aufgehoben werden kann, reicht es längst nicht aus, das Korrekturpotenzial des Wirkstoffs am Problemmolekül biochemisch zu belegen. Vielmehr müssen Wege gefunden werden, dass der Wirkstoff vom Organismus aufgenommen wird und in ausreichender Konzentration dort akkumuliert, wo der Fehler lokalisiert ist. Ferner muss garantiert sein, dass der Wirkstoff den Organismus in einer akzeptablen Zeit – weder zu schnell noch zu langsam – verlassen kann. Und schließlich sollte der Nutzen deutlich die Risiken überwiegen, die mit der Aufnahme eines Fremdstoffs verbunden sind oder verbunden sein können.
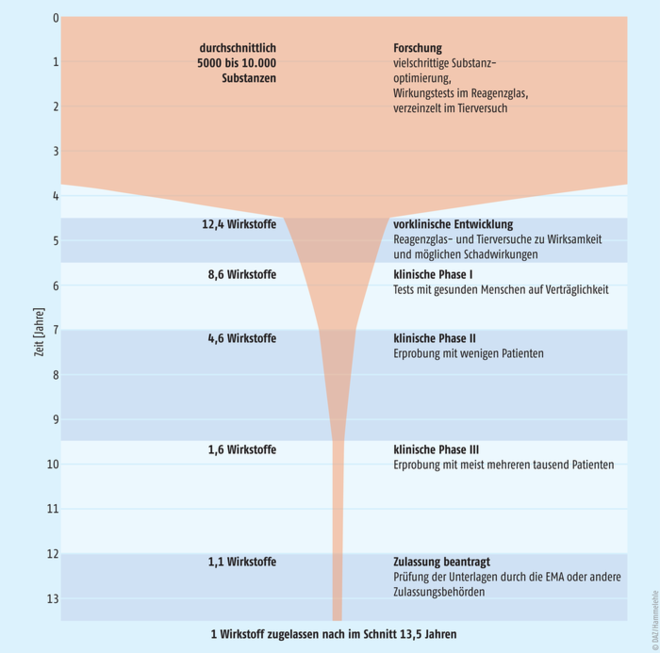
All dies erfordert extrem lange Entwicklungszeiten. Heerscharen von Wissenschaftlern unterschiedlicher Disziplinen sind an der Entwicklung eines Wirkstoffs beteiligt. Rechtsexperten überwachen penibel die Exklusivität der Substanz während des Patentschutzes. An Tieren, die unter ethisch anspruchsvollen Bedingungen gehalten und gepflegt werden, müssen die Wirksamkeit und die Sicherheit überprüft werden, bevor an einen klinischen Wirksamkeitsnachweis überhaupt gedacht werden kann. Patienten müssen rekrutiert werden, die sich zur Verfügung stellen, um den noch nicht zugelassenen Wirkstoff zu testen. Und Zulassungsbehörden haben in komplexen Verfahren alle Anforderungen an die Erteilung der Verkehrsfähigkeit der Innovation als Arzneimittel zu überprüfen.
Und trotz aller Bemühungen ist ein Erfolg niemals garantiert. Von 5000 bis 10.000 Substanzen, die nach dem Screening hergestellt und untersucht werden, kommen im Durchschnitt nur neun in ersten Studien mit Menschen zur Erprobung, und nur eine erreicht tatsächlich später den Markt (Abb. 1). So ist das unternehmerische Risiko in diesem Wirtschaftszweig enorm groß, und das hat seinen Preis. Nach Angaben des Verbands Forschender Arzneimittelhersteller e. V. (vfa) muss man pro zugelassenem Arzneimittel mit einem neuen Wirkstoff Entwicklungskosten von ca. 1,0 bis 1,6 Milliarden US-Dollar veranschlagen, wobei die fehlgeschlagenen Projekte (die ja auch bezahlt werden müssen) ebenso eingerechnet sind wie die Kapitalisierungskosten (das heißt die entgangenen Erträge durch jahrelanges Binden von Kapital) [1]. Dieses System bricht jäh, wenn auch klar vorhersehbar, in sich zusammen, wenn der Patentschutz erlischt (siehe Tabelle 1). Dann ist es jedem möglich, das erfolgreiche Produkt zu kopieren und mit dem Innovator in einen wirtschaftlichen Wettbewerb zu treten, dem in der Regel dadurch ein nicht unerheblicher Einbruch seines return of investments droht.
Handelsname |
INN |
Patentablauf (EU) |
|---|---|---|
Cerezyme®
|
Imiglucerase |
2001 |
Humulin®
|
Humaninsulin |
2001 |
Intron A®
|
Interferon alfa-2b |
2002 |
Avonex®
|
Interferon beta-1a |
2003 |
Humatrope®
|
Somatropin |
2003 |
Nutropin®/Nutropin® AQ |
Somatropin |
2003 |
Epogen®/Procrit®
|
Epoetin alfa |
2004 |
Activase®
|
Alteplase |
2005 |
Novolin®
|
Humaninsulin |
2005 |
Synagis®
|
Palivizumab |
2005 |
Albutein®
|
Humanalbumin |
2006 |
NeoRecormon®, Recormon®
|
Epoetin beta |
2006 |
Neupogen®
|
Filgrastim |
2006 |
Gonal-f®
|
Follitropin alfa |
2009 |
Kineret®
|
Anakinra |
2009 |
NovoSeven®
|
Faktor VII, Eptacog alfa |
2009 |
Advate®
|
Faktor VIII, Optacog alfa |
2010 |
Novorapid®, Novolog®
|
Insulin aspart |
2011 |
Lovenox®
|
Enoxaparin-Natrium |
2012 |
Humalog®
|
Insulin lispro |
2013 |
Rituxan®
|
Rituximab |
2013 |
Simulect®
|
Basiliximab |
2013 |
Zenapax®
|
Daclizumab |
2013 |
Zevalin®
|
Ibritumomab-Tiuxetan |
2013 |
Herceptin®
|
Trastuzumab |
2014 |
Erbitux®
|
Cetuximab |
2014 |
Lantus®
|
Insulin glargin |
2014 |
Enbrel®
|
Etanercept |
2015 |
Avonex®, Rebif®
|
Interferon beta-1a |
2015 |
Neulasta®
|
Pegfilgrastim |
2015 |
Remicade®
|
Infliximab |
2015 |
Synagis®
|
Palivizumab |
2015 |
Tysabri®
|
Natalizumab |
2015 |
Aranesp®
|
Darbepoetin alfa |
2016 |
Lucentis®
|
Ranibizumab |
2016 |
Actemra®, RoActemra®
|
Tocilizumab |
2017 |
Neulasta®
|
Pegfilgrastim |
2017 |
Orencia®
|
Abatacept |
2017 |
PegaSys®
|
Peginterferon alfa-2a |
2017 |
Xolair®
|
Omalizumab |
2017 |
Humira®
|
Adalimumab |
2018 |
Levemir®
|
Insulin detemir |
2018 |
Pegintron®, ViraferonPeg®
|
Peginterferon alfa-2b |
2018 |
Vectibix®
|
Panitumumab |
2018 |
Forteo®, Forsteo®
|
Teriparatid |
2019 |
Kadcyla®
|
Trastuzumab Emtansin |
2020 |
Removab®
|
Catumaxomab |
2020 |
Soliris®
|
Eculizumab |
2020 |
Benlysta®
|
Belimumab |
2021 |
Campath®, Lemtrada®
|
Alemtuzumab |
2021 |
Cimzia®
|
Certolizumab pegol |
2021 |
Nulojix®
|
Belatacept |
2021 |
Yervoy®
|
Ipilimumab |
2021 |
Avastin®
|
Bevacizumab |
2022 |
Lucentis®
|
Ranibizumab |
2022 |
Prolia®
|
Denosumab |
2022 |
Saxenda®, Victoza®
|
Liraglutid |
2022 |
Adcetris®
|
Brentuximab Vedotin |
2023 |
Cyramza®
|
Ramucirumab |
2023 |
Perjeta®
|
Pertuzumab |
2023 |
Betaferon®
|
Interferon beta-1b |
2024 |
Gazyva®
|
Obinutuzumab |
2024 |
Simponi®
|
Golimumab |
2024 |
Stelara®
|
Ustekinumab |
2024 |
Darzalex®
|
Daratumumab |
2026 |
Opdivo®
|
Nivolumab |
2026 |
Repatha®
|
Evolocumab |
2026 |
Eylea®
|
Aflibercept |
2027 |
Tecentriq®
|
Atezolizumab |
2027 |
Keytruda®
|
Pembrolizumab |
2028 |
Poteligeo®
|
Mogamulizumab |
2033 |
Sylvant®
|
Siltuximab |
2034 |
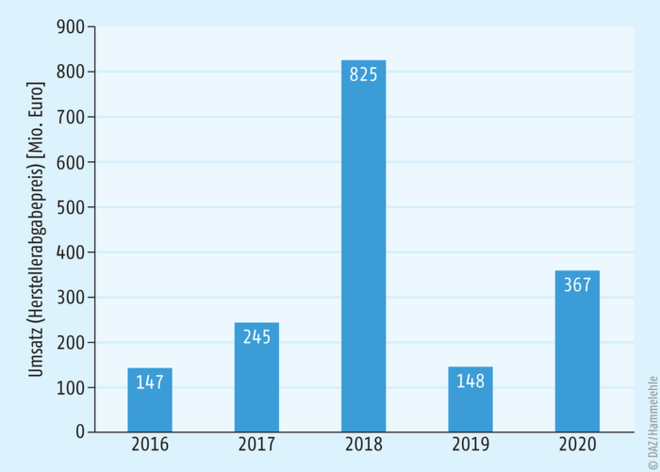
Dass dies für die Geschäftsleitungen und für Investoren der forschenden Arzneimittelhersteller ein ärgerlicher Umstand ist, ist verständlich, wenn man sich die Umsätze vor Augen hält, die mit Biologicals erzielt werden. Andererseits ist ebenso verständlich, dass Unternehmen, die sich auf das Kopieren von Erfolgsmodellen spezialisiert haben, ihre absolut legale Möglichkeit nutzen wollen, an einem lukrativen Geschäft zu partizipieren. Gerade natürlich dann, wenn man sich anschaut, welchen Umsatz Biologicals erzielen, deren Patent z. B. im Jahr 2018 ausläuft (Abb. 2) [2].
Die Attraktivität des Kopierens pharmazeutischer Wirkstoffe
Mehrere Anreize machen das Kopieren selbst komplexer pharmazeutischer Wirkstoffe, wie beispielsweise Biopharmazeutika, attraktiv, obwohl die Herstellung selbst extrem aufwendig und anspruchsvoll ist. Ein Anreiz ist sicherlich, dass das Zulassungsverfahren für das Nachahmerprodukt meist deutlich weniger aufwendig ist. Erheblich mehr reizt dagegen das nicht vorhandene Risiko, dass das Vorhaben wegen mangelnder klinischer Performance am Ende des Entwicklungsprozesses scheitern könnte, vorausgesetzt, man traut sich zu, eine makellose Kopie des Wirkstoffs herstellen zu können. Aber nicht nur der Biosimilar-Hersteller wittert seine Chance nach Ablauf eines Patents. Immer profitiert auch das Gesundheitssystem, da mit Einführung von Nachahmerprodukten nicht nur ein Wettbewerb auf dem Markt entsteht, sondern auch das Instrumentarium staatlicher Auflagen und Reglementierungen erweitert wird.
Die Reaktion der Innovatoren
Zu verständlich ist es daher, dass sich Innovator-Firmen gegen diese Entwicklung aufzulehnen versuchen. Hier bieten sich redliche und fragliche Methoden an, die je nach Firmenphilosophie gewählt werden.
Die fragliche Abwehrstrategie
Die fragliche, wenn nicht gar unredliche Methode besteht darin, biologische Nachahmerprodukte hinsichtlich Qualität, Wirksamkeit und Sicherheit zu diskreditieren. Das ist deshalb unredlich, da solche Strategien auf gezielten Fehlinformationen beruhen, die in der Regel von den Verordnern nicht oder nur schwer bewertet werden können. Irrelevant, wenn nicht sogar falsch, sind solche Informationen deshalb, weil alle im Markt befindlichen Biosimilars nach kritischer Überprüfung durch die EMA von der EU-Kommission zugelassen sind. Damit ist verbrieft, dass diese Produkte den regulatorisch festgelegten Kriterien der Biosimilarität unter dem Aspekt der totality of comparability entsprechen. Vermeintliche Unterschiede zwischen den Molekülpräparationen, die im Falle von Biologika immer relativ heterogen zusammengesetzt sind, existieren nicht oder besitzen keine klinische Relevanz. Diese Abwehrstrategie ist nicht zuletzt auch deshalb unredlich, da sie bei den Verordnern den Eindruck hinterlässt, dass Biosimilars Biopharmazeutika zweiter Klasse sein könnten. Ist das der Fall, werden dies auch die Patienten merken – mit potenziell verheerenden Folgen. Dies gilt besonders dann, wenn aufgrund von Abgabevorschriften Patienten gezwungen werden, ein in ihren Augen „Biologikum zweiter Klasse“ zu akzeptieren.
Die redliche Abwehrstrategie
Eine bessere Option zur Abwehr des Verlusts der Marktexklusivität bietet sich für die forschende Arzneimittelindustrie durch die Entwicklung von Innovationen in dem relevanten Indikationsfeld. Das ist möglich und das wird auch praktiziert. Beispielsweise kamen mit Ablauf des Patents für den Anti-CD20-Antikörper Rituximab zwei neue Anti-CD20-Antikörper in den Markt. Für eine ganze Reihe therapeutischer Antikörper wurden zudem subkutan zu applizierende Varianten zugelassen. Und es bietet sich die Möglichkeit, Antikörper mit Toxin-Molekülen zu konjugieren. Erweisen sich derartige Neuentwicklungen dem patentfreien Wirkstoff gegenüber als klinisch deutlich überlegen, können sie einen neuen medizinischen Standard etablieren und zumindest einen Teil des Exklusivitätsverlustes wieder ausgleichen. Dies ist eine attraktive Option, wobei Biosimilars zum Teil auch als Treiber für Innovation betrachtet werden können. |
Literatur
[1] So entsteht ein neues Medikament. In Labors und Kliniken – Wie ein neues Medikament entsteht. Verband Forschender Arzneimittelhersteller e. V., www.vfa.de/de/arzneimittel-forschung/so-funktioniert-pharmaforschung/so-entsteht-ein-medikament.html
[2] Probiosimilars: Biosimilars in Zahlen. Marktdaten 2017






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.