
- DAZ.online
- DAZ / AZ
- DAZ 28/2018
- Von innen heraus strahlen
Bildgebende Verfahren
Von innen heraus strahlen
Nuklearmedizinische Bildgebung: Szintigrafie, SPECT und PET
Anders als bei den in DAZ 2018, Nr. 16, S. 44, und DAZ 2018, Nr. 20, S. 44, beschriebenen radiologischen Modalitäten wie Röntgen oder Computertomografie kommen in der Nuklearmedizin keine Röntgenstrahlen zum Einsatz, die den Patienten von außen durchdringen. Vielmehr beruhen Verfahren wie die Szintigrafie oder SPECT (Single Photon Emission Computed Tomography) auf Gammastrahlen, die „aus dem Patienten herausstrahlen“ und von einem Scanner oder einer Gammakamera erfasst werden.
Auch Gammastrahlen gehören zu den ionisierenden Strahlen, sie zeigen eine Quantenenergie über etwa 200 keV. Da sich die Energiebereiche von Röntgen- und Gammastrahlung überlappen, sind die beiden Strahlenarten in ihren physikalischen Eigenschaften vergleichbar. Der Unterschied liegt im Entstehungsort: Während Röntgenstrahlen durch die Wechselwirkung zwischen schnellen Elektronen und Materie zustande kommen, entstehen Gammastrahlen durch Zerfallsprozesse im Atomkern.
Tracerprinzip als Voraussetzung
Um diesen Prozess in Gang zu bringen, wird dem Patienten ein Radiopharmakon als Marker für die Stoffwechselaktivität im Zielorgan verabreicht. Hierbei kann es sich um eine radioaktive Substanz als solche handeln oder um einen Carrier, an den die radioaktive Substanz (das Radionuklid) gekoppelt ist. Letztere bezeichnet man als Tracer (engl. trace = Spur), wobei der Begriff im klinischen Sprachgebrauch zunehmend für das Radiopharmakon als Ganzes verwendet wird. Über seine gezielte Anwendung entscheiden die pharmakologischen (Pharmakodynamik und -kinetik) sowie die radiochemischen Eigenschaften des Nuklids (Strahlungsart, Aktivität, Halbwertszeit). Die jeweils applizierte Substanzmenge ist vernachlässigbar gering, daher spielt ihre potenzielle Toxizität keine Rolle, und das zu untersuchende Gewebe nimmt keinen Schaden.
Als Tracer eignen sich vor allem mittelenergetische γ-Strahler wie das Technetium-Isotop 99mTc mit einer Halbwertszeit von sechs Stunden. Je nach Indikation ist das Radionuklid an unterschiedliche Trägermoleküle gekoppelt, so zum Beispiel
- als 99mTc-Mono- und Diphosphonate (DPD) bei knöchernen Läsionen oder
- als 99mTc-Pertechnetat zur Darstellung der Schilddrüsenfunktion.
Primär Funktionsdiagnostik
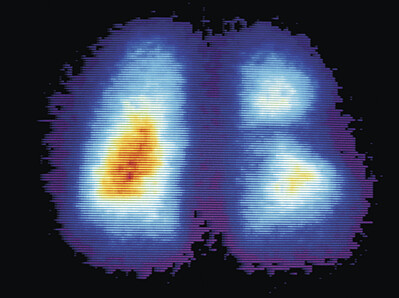
Nach seiner – zumeist intravenösen – Applikation reichert sich das Radionuklid verstärkt in Organen und Geweben mit einer erhöhten zellulären Stoffwechselrate an („hot spot“). Dies ermöglicht eine Differenzierung zwischen zum Zeitpunkt der Untersuchung funktionell aktiven und inaktiven Bereichen. Dies gilt vor allem für Karzinome und Metastasen oder Entzündungen; über die Darstellung der Organperfusion lassen sich beispielsweise auch eine Lungenembolie (s. Abb. 1) oder ischämisches bzw. infarziertes Myokard diagnostizieren. In den meisten Fällen ist jedoch eine morphologische Beurteilung nur grob möglich.
Die beim Zerfall der radioaktiven Substanzen frei werdende Energie in Form von ungeladenen Photonen lässt sich mit einer Gamma-Kamera als aus dem Körper austretende γ-Strahlung messen und in ein farbvisualisiertes Bild transformieren. Eine solche Darstellung der im Körper gemessenen zeitlichen und räumlichen Aktivitätsverteilung entspricht einem Szintigramm. Mit Schnittbildverfahren wie SPECT oder PET (Positronen-Emissions-Tomografie) lassen sich pathologische Verteilungsmuster anatomisch besser zuordnen.
Statische und dynamische Szintigrafie
Herzstück einer jeden Gamma-Kamera ist der sogenannte Szintillationskristall. Dieser wird durch die energiereichen Photonen des Radiopharmakons angeregt und gibt diese Energie in Form von sichtbarem Licht wieder ab. Hierbei entstehen Lichtblitze, weswegen der Vorgang als Szintillation bezeichnet wird (lateinisch scintillare = blitzen, funkeln). Ein Photomultiplier verstärkt die Menge des ausgesandten Lichts um den Faktor 105 und leitet sie als elektrischen Impuls in hoher zeitlicher Auflösung an einen Computer weiter.
Vor dem Szintillationsdetektor dient ein wabenartiges System von parallel angeordneten Bleilamellen (Kollimatoren) als Streustrahlenraster. Durch die Bleilamellen werden alle schräg eintreffenden Photonen absorbiert, sodass ausschließlich senkrecht auf die Detektoroberfläche treffende Photonen zur Signalentstehung beitragen. Somit lässt sich der Ursprung jedes γ-Quants bestimmen und die Aktivitätsverteilung in der diagnostischen Zielregion zu einem bestimmten Zeitpunkt abbilden.
Bei der konventionellen Szintigrafie entsteht aus den verarbeiteten Daten ein planares zweidimensionales Bild. Ein klinisch häufiges Beispiel für eine statische Aufnahme, bei der sich weder die Gamma-Kamera noch der Patient bewegen, ist das Schilddrüsenszintigramm, beispielsweise bei
- tastbaren und/oder sonografisch abgrenzbaren Herdbefunden (Knoten ≥ 1 cm),
- Verdacht auf fokale oder diffuse Autonomie bei manifester oder latenter Hyperthyreose,
- diagnostisch unklaren Fällen bei der Abklärung eines Morbus Basedow (Autoimmunhyperthreose).
Ebenso bewegen sich bei einer planaren dynamischen Szintigrafie weder die Kamera noch der Patient, jedoch entstehen hier im Verlauf bestimmter Zeitintervalle mehrere Aufnahmen.
Eine häufige Anwendung ist die Nierenfunktionsszintigrafie mit 99mTc-MAG3 (Mercapto-acetyltriglycerin) als Radiopharmakon. Nach dessen Applikation werden in definierten Abständen zur Aktivitätsbestimmung des Radionuklids Blut abgenommen sowie Aufnahmen mit der Gamma-Kamera erstellt, sodass sowohl die Anflutung als auch die Abflutung des Tracers ermittelt werden kann. Das Ergebnis kann in einer Nephrogrammkurve dokumentiert werden, welche die seitengetrennte Funktionsbeurteilung der Nieren erlaubt.
SPECT als Erweiterung der Szintigrafie
Als Ergänzung zur planaren, konventionellen Szintigrafie bietet sich bei bestimmten Fragestellungen eine (zeitlich statische oder dynamische) SPECT-Untersuchung an. Hierbei rotiert eine Gamma-Kamera auf einer elliptischen oder kreisförmigen Bahn schrittweise oder kontinuierlich um den Patienten, wodurch mehrere Aufnahmen aus verschiedenen Ansichtswinkeln um das Objekt akquiriert werden, die sogenannten Projektionen. Die Leitlinie für nuklearmedizinische Bildgebung empfiehlt für hochauflösende Aufnahmen 64 Ansichten für eine 180°-Abtastung bzw. 128 Ansichten für eine 360°-Abtastung bei einer typischen Aufnahmematrix von 64 × 64 bzw. 128 × 128 Pixeln.
Um die Aufnahmezeiten zu verkürzen oder Messraten zu erhöhen, arbeiten alle heutigen Systeme mit Mehrkopfkameras, welche die verschiedenen Projektionen gleichzeitig erfassen können. Die dadurch entstandenen Daten werden dann mithilfe verschiedener Rekonstruktionstechniken wie bei der Computertomografie durch eine räumliche Abfolge von Schichtbildern in ein dreidimensionales Bild der Aktivitätsverteilung verrechnet.
SPECT plus röntgenbasierte Computertomografie
Eine grundsätzliche Schwäche der rein nuklearmedizinischen Bildgebung liegt in der limitierten morphologischen Information, die eine exakte Zuordnung der Aktivitätsverteilung zu einer bestimmten anatomischen Struktur häufig erschwert. Um dieses Problem zu umgehen, lässt sich die hohe Spezifität und Sensibilität der SPECT mit der präzisen anatomischen Darstellung der röntgenbasierten Computertomografie kombinieren. Das SPECT/CT-Verfahren beruht daher auf einer Hybridtechnologie, bei der innerhalb einer Gantry die rotierende Gamma-Kamera in Reihe mit der rotierenden CT-Röhre installiert ist. Die Aufnahmen entstehen allerdings sequenziell (entweder zuerst SPECT oder CT), wobei die Patienten dank einer entsprechenden Tischbewegung nicht umgelagert werden müssen. Während ein SPECT meist einen Zeitaufwand von zehn bis 30 Minuten erfordert, dauert das CT häufig so kurz, dass es in nur einer Atemphase durchgeführt werden kann.
Benefit durch Hybridsystem
Der Vorteil der Hybridbildgebung lässt sich am Beispiel der Diagnostik von malignen Knochentumoren demonstrieren (von primären Tumoren wie dem Osteosarkom ebenso wie von Metastasen eines Mamma- oder Prostatakarzinoms). Das Ausmaß der Anreicherung von 99mTc-Mono- oder Diphosphonat hängt hierbei von der Knochenbeschaffenheit und regionalen bzw. kapillären Durchblutung ab, insbesondere jedoch von der Osteoblasten-Aktivität:
- Szintigrafie und SPECT: Dem malignen Knochenprozess entsprechend zeigt sich eine reaktiv erhöhte Osteoblasten-Aktivität und somit eine erhöhte Aufnahme des Radionuklids. Allerdings sind im planaren zweidimensionalen Szintigramm die pathologischen Verteilungsmuster aufgrund von Überlagerungen angrenzender Knochen oder Artefakte häufig nicht eindeutig erkennbar. Zwar ermöglicht die dreidimensionale SPECT-Bildgebung eine detailgetreuere Visualisierung der Aktivitätsverteilung, dennoch kann eine schwach ausgeprägte anatomische Orientierung eine präzise Lokalisierung der Befunde beeinträchtigen. Auch konnten in einer Studie Tracer-Akkumulationen in benignen Knochenläsionen wie z. B. degenerativen Gelenkveränderungen die an sich hohe Sensitivität der Methode von 80 bis 95% auf Werte von 62 bis 81% vermindern.
- SPECT/CT: In einer weiteren Studie mit 353 Patienten wies eine ossäre Ganzkörper-Szintigrafie eine Sensitivität von 93% und eine Spezifität von 78% auf. Durch die dank der computertomografischen Komponente genauere anatomische Lokalisierung ließ sich durch die SPECT/CT-Hybriddarstellung die Sensitivität auf 97% und die Spezifität auf 94% erhöhen. Dieses Resultat ermöglichte ein gezieltes Downstaging von Metastasen bei 32,1% der untersuchten Patienten.
Nicht nur onkologische Indikationen
Außerhalb der onkologischen Diagnostik ist zum Beispiel die Myokardperfusionsszintigrafie (MPI) mit SPECT eine valide Methode in der Diagnostik der koronaren Herzkrankheit:
- So kann der Untersucher die Ausdehnung des ischämiegefährdeten oder bereits infarzierten Myokards quantifizieren und die linksventrikuläre Pumpfunktion beurteilen. Dies ermöglicht die Selektion von Patienten, bei denen eine Revaskularisierung möglich ist, etwa durch eine Stent-Implantation oder Bypass-OP.
- Andererseits bestätigte sich der hohe negative prädiktive Wert einer unauffälligen Myokardszintigrafie über einen sehr langen Zeitraum in zahlreichen Studien: Die kumulative kardiale Ereignisrate (Todesfälle und nicht-tödliche Myokardinfarkte) lag unter einem Prozent pro Jahr, die untersuchten Patienten zeigten somit eine ausgezeichnete Prognose.
Obwohl die Magnetresonanztomografie heute den diagnostischen Goldstandard für benigne orthopädische Erkrankungen darstellt, kommt die Skelett-SPECT/CT hier immer noch zum Einsatz (s. Tab. 1). Hier ergibt sich gelegentlich auch eine pädiatrisch-forensische Indikation: Besteht der Verdacht auf Misshandlung („battered child syndrome“), so lassen sich zum Beispiel über eine erhöhte Knochenstoffwechselaktivität subperiostale Ossifikationen als Reparaturvorgang darstellen. Hierzu müssen die Knochen nicht gebrochen sein, bereits Prellungen können szintigrafisch nachgewiesen werden.
Wirbelsäule |
|
Extremitäten |
|
PET = Positron plus Paarvernichtung
Neben Tracern, die Gamma-Strahlung emittieren, werden in der Nuklearmedizin auch radioaktive Nuklide eingesetzt, die Beta-Strahlung emittieren, beispielsweise die β+-Strahler 18F (Halbwertszeit 109 min), 11C (HWZ 20 min) oder 68Ga (HWZ 68 min). Beim β+-Zerfall wiederum entstehen Positronen; ein Positron ist ein positiv geladenes Antiteilchen des Elektrons, das sich von diesem nur durch seine entgegengesetzte Ladung unterscheidet. Auf diesem Prinzip beruht die Positronen-Emissions-Tomografie (PET).
Das für PET-Untersuchungen am häufigsten verwendete Radiopharmakon ist der Zucker 18F-FDG (Fluordesoxyglucose), dessen Aktivitätsverteilung auf dem Glucosemechanismus beruht und der vor allem in der Diagnostik onkologischer, entzündlicher und kardialer Erkrankungen eingesetzt wird.
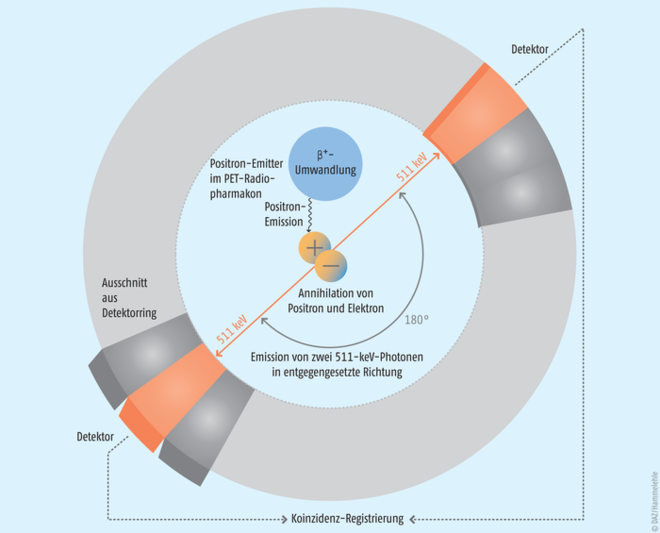
Nach Applikation des Radiopharmakons trifft das Positron nach einer seiner kinetischen Energie entsprechenden Reichweite im Gewebe auf ein Elektron. Dabei vernichten sich beide Teilchen (Annihilation). Als Folge dieses Vorgangs werden zwei hochenergetische Gamma-Photonen in genau entgegengesetzte Richtungen – also in einem Winkel von 180° – ausgesandt; beide Photonen zeigen hierbei eine genau definierte Energie von je 511 keV.
Der gewisse Kniff: Koinzidenzmessung
Die räumliche Zuordnung dieser sogenannten Vernichtungsstrahlung erfolgt durch eine sogenannte Koinzidenzmessung: Werden innerhalb eines Zeitfensters von 4,5 bis 15 Nanosekunden in zwei gegenüberliegenden Detektoren gleichzeitig Photonen dieser Energie gemessen („koinzident“), geht man davon aus, dass der Emissionsort des Positrons und somit des Tracers auf der Verbindungslinie der beiden Detektoren liegt (s. Abb. 2). Aus der zeitlichen und räumlichen Verteilung dieser registrierten Zerfallsereignisse kann auf die Verteilung des Radiopharmakons im Körperinneren geschlossen werden. Durch die Errechnung einer Serie von Schnittbildern lässt sich in einer dreidimensionalen Darstellung wie bei einer SPECT das radioaktive Verteilungsmuster in einem Organ oder Gewebe erkennen. Allerdings bietet die PET einen grundsätzlichen Vorteil gegenüber der SPECT:
- Eine höhere Anzahl von Szintillationszählern: Der Detektor eines heute erhältlichen PET-Scanners besteht aus mehreren Detektorringen, die jeweils aus 30 bis 40 Detektormodulen aufgebaut sind. In der Summe ergibt dies mehr als 10.000 ringförmig angeordnete Detektorkristalle (Szintillationszähler), die wiederum mit ca. 1000 Photomultipliern gekoppelt sind.
- Bei der Szintigrafie und SPECT muss – wie oben beschrieben – vor dem Detektor ein Kollimator platziert sein, um alle schräg eintreffenden Photonen zu absorbieren. Da dieser dadurch einen Großteil ausblendet, wird nur etwa ein von 10.000 emittierten Photonen nachgewiesen. Demgegenüber kann bei der PET aufgrund ihres Messprinzips des Koinzidenznachweises auf eine physikalische Kollimation verzichtet werden. Dies führt zu einer etwa hundertfach erhöhten Zählausbeute, was eine verbesserte Bildstatistik mit höherer Bildqualität und räumlicher Auflösung bedeutet.
Um wie bei der SPECT eine optimale Fusion aus funktioneller und morphologischer Information zu gewinnen, wurden auch für die PET Hybridsysteme entwickelt, PET/CT oder inzwischen auch PET/MRT (letzteres in Deutschland im Jahr 2015 an sechs Standorten verfügbar).
Hauptsächlich onkologische Indikationen
Die FDG-PET/CT-Untersuchung hat, wie bereits erwähnt, einen hohen Stellenwert in der Diagnostik maligner Erkrankungen. Im Organismus verhält sich die 18F-markierte Desoxyglucose analog zu Glucose, das heißt das Radiopharmakon wird physiologischerweise intrazellulär aufgenommen (vor allem in Herzmuskel-, Skelettmuskel-, Gehirn- und Fettzellen). Dort wird FDG in den Stoffwechselweg der Glykolyse eingeschleust und in einem ersten Schritt zu 18F-Desoxy-Glucose-6-Phosphat phosphoryliert. Da es sich hierbei jedoch um einen „falschen“ Metaboliten handelt, der an den weiteren Schritten der Glykolyse nicht teilnimmt, akkumuliert das Radiopharmakon mit der Zeit in den Zellen. Da Krebszellen aufgrund ihres unkontrollierten Wachstums ungleich mehr Nährstoffe verbrauchen als normales Gewebe, ist der Glucosestoffwechsel in malignen Tumoren oft um mehr als das Zehnfache gegenüber dem Normalgewebe gesteigert, was als erhöhte 18F-FDG-Aktivität im diagnostischen Zielbereich nachweisbar ist.
Aufgrund der hohen Kosten für eine PET/CT-Untersuchung (ca. 1400 Euro) spielen eine kritische Bewertung der klinischen Aussagekraft der PET und damit eine exakte Definition der Indikationen eine wichtige Rolle. Die von der Kassenärztlichen Bundesvereinigung und vom Spitzenverband Bund der Krankenkassen aktuell zugelassenen und detailliert formulierten Indikationen bei onkologischen Fragestellungen zeigt Tabelle 2. Weitere in Konsensuskonferenzen empfohlene PET- bzw. PET/CT-Anwendungen betreffen das Staging des Prostatakarzinoms, Ösophaguskarzinoms, kolorektalen Karzinoms und des entdifferenzierten Schilddrüsenkarzinoms.
Lungenkarzinom |
|
andere Karzinome |
|
PET in Kardiologie und Neurologie
Die bei der SPECT bereits genannte kardiale Diagnostik kann selbstverständlich auch mit einer PET-Untersuchung durchgeführt werden. Trotz eingeschränkter Durchblutung kann die Schädigung des Myokards noch reversibel sein und kein Narbengewebe ausgebildet haben. Anhand der Glucoseaufnahme kann die kardiale Gewebevitalität – ebenfalls mit einer 18F-FDG-PET – spezifisch beurteilt werden. Voraussetzung ist die Kenntnis der Myokarddurchblutung anhand eines zuvor erstellten Myokardszintigramms; die kardiale Zuckeraufnahme vor der PET kann durch die orale Gabe des Nicotinsäurederivats Apicimox erhöht werden.
In einer niederländischen Vergleichsstudie mit 208 KHK-Patienten aus dem Jahr 2017 zeigte die PET mit 85% die höchste diagnostische Genauigkeit in Bezug auf eine myokardiale Ischämie, gefolgt von der SPECT mit 77% und der Koronar-CT mit 74%. Überraschend allerdings war die Feststellung, dass die Kombination aus PET bzw. SPECT mit der Koronar-CT hier keinen echten Zusatznutzen brachte.
Eine weitere wichtige nichtonkologische Fragestellung ist die PET- bzw. PET/CT-Untersuchung des regionalen zerebralen Glucosestoffwechsels – ebenfalls mit 18F-FDG – in der Neurologie. Ziel ist die differenzialdiagnostische Abklärung verschiedener Demenzformen, vor allem der Demenz vom Alzheimer-Typ und der frontotemporalen Demenz. Dies ist möglich, weil die verschiedenen Demenzformen spezifische Muster der Beeinträchtigung des zerebralen Glucosemetabolismus zeigen. Auch die Verminderung des Stoffwechsels in der Progression von der leichten kognitiven Störung bis zu den ersten manifesten Demenzzuständen lässt sich mit der PET nachweisen.
Ebenso lassen sich seit einigen Jahren pathologische Beta-Amyloid-Plaques mit einer PET sichtbar machen. So lagert sich auch der seit 2014 zugelassene Tracer 18F-Florbetaben mit hoher Sensitivität und Spezifität an diesen für Morbus Alzheimer typischen zerebralen Eiweißablagerungen an. Einerseits wecken diese Befunde die Hoffnung, dass eine Frühdiagnostik der Alzheimer-Erkrankung mithilfe der Amyloid-Bildgebung schon im asymptomatischen Stadium möglich sein könnte. Andererseits gilt derzeit noch die Einschränkung, dass der individuelle prädiktive Wert eines positiven Amyloid-Scans im präklinischen Stadium in Bezug auf eine spätere klinische Manifestation der Alzheimer-Demenz noch nicht ausreichend geklärt ist. |
Literatur
[1] Haug A, Bartenstein P, Hünerbein R. Nuklearmedizin. In: Reiser M, Kuhn FP, Debus J (Hrsg.). Radiologie. 4. Aufl. 2017. Georg Thieme Verlag
[2] Stabsstelle Strahlenschutz und Abteilung Medizinische Physik der Medizinischen Hochschule Hannover. Bildgebende Verfahren in der Nuklearmedizin. Informationsbroschüre
[3] Ahmadzadehfar H, Muckle M, Essler M, et al. SPECT/CT: Vorteile und Indikationen der Hybridbildgebung. Dtsch Med Wochenschr 2015;140:434-438
[4] Ritt P, Hornegger J, Kuwert T, et al. Technik und physikalische Aspekte der SPECT/CT. Der Nuklearmediziner 2011;34:9-20
[5] Herzog H, Rösch F. PET- und SPECT-Technik. Chemie und Physik der Bildgebung. Pharm. Unserer Zeit 2005;6(34):468-473
[6] Krause BJ, Beyer T, Bockisch A, et al. (Arbeitsausschuss Positronenemissionstomografie der Deutschen Gesellschaft für Nuklearmedizin). Leitlinie FDG-PET/CT in der Onkologie. Nuklearmedizin 2007;46:291–301. doi: 10.3413/nukmed-282
[7] Kassenärztliche Bundesvereinigung. Änderungen der Vereinbarung von Qualitätssicherungsmaßnahmen nach § 135 Abs. 2 SGB V zur diagnostischen Positronenemissionstomografie, diagnostischen Positronenemissionstomografie mit Computertomografie (QS-Vereinbarung PET, PET/CT). Deutsches Ärzteblatt 2018;3(115):A103-A104
[8] Degenhardt C, Thon A. Blitzschnelle Einblicke. Funktionale Bildgebung mit der Positronen-Emissions-Tomografie entlarvt Krebs im Frühstadium. Physik Journal 2007;7:23-29
[9] Danad I, Raijmakers PG, Driessen RS, et al. Comparison of Coronary CT Angiography, SPECT, PET, and Hybrid Imaging for Diagnosis of Ischemic Heart Disease Determined by Fractional Flow Reserve. JAMA Cardiol. 2017;2(10):1100-1107. doi: 10.1001/jamacardio.2017.2471 (abstract)
[10] Herholz K, Heiss, WD. Frühdiagnostik neurodegenerativer Erkrankungen zur Bekämpfung der Demenz. Max-Planck-Institut für Stoffwechselforschung 2004
[11] Drzezga A, Sabri O, Fellgiebel A. Frühdiagnose des Morbus Alzheimer: Amyloid-Bildgebung – Reif für die Routine? Dtsch Arztebl 2014;111(26):A-1206/B-1042/C-984






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.