
- DAZ.online
- DAZ / AZ
- DAZ 6/2017
- Baricitinib besser als ...
Arzneimittel und Therapie
Baricitinib besser als Methotrexat?
Neue Januskinase-Inhibitoren werden Therapie der rheumatoiden Arthritis erweitern
Trotz zahlreicher medikamentöser Optionen gelingt es bei vielen Patienten mit rheumatoider Arthritis nicht, die Krankheitsaktivität ausreichend zu kontrollieren. Zudem reagiert etwa ein Drittel der mit Methotrexat (MTX) Behandelten mit Unverträglichkeiten, sodass diese Therapie häufig abgebrochen werden muss. Deshalb besteht weiterhin ein Bedarf an neuen wirksamen und verträglichen Therapien. Dazu könnten bald die Januskinase-Inhibitoren Baricitinib (Olumiant®) und Tofacitinib (Xeljanz®)gehören. Letzterer ist in den USA, Kanada und der Schweiz bereits zur Behandlung der rheumatoiden Arthritis zugelassen und hat im Januar vom Ausschuss für Humanarzneimittel (CHMP) nun auch für Europa grünes Licht erhalten. Baricitinib wurde bereits im Dezember 2016 für die EU-weite Zulassung empfohlen; seine Zulassung wird im ersten Quartal 2017 erwartet. In der EU wäre es der erste Vertreter dieser Arzneistoffklasse für die Indikation rheumatoide Arthritis. Zugelassen ist hierzulande bereits der JAK1/2-Inhibitor Ruxolitinib (Jakavi®), unter anderem zur Behandlung der primären Myelofibrose.
Wirkprinzip JAK-Inhibition
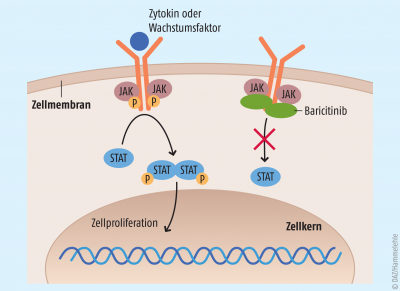
Bei den Januskinasen (JAK) handelt es sich um eine Gruppe von zytosolischen Tyrosinkinasen, die in die Signaltransduktion verschiedener proinflammatorischer Zytokine involviert sind. Sie phosphorylieren beispielsweise das Protein STAT (signal transducer and activator of transcription), das anschließend in den Zellkern wandert und dort die Transkription spezifischer Zielgene initiiert. Baricitinib ist ein selektiver Hemmer der JAK1 und 2, denn er besitzt eine 100-fach höhere Selektivität gegenüber diesen Kinasen im Vergleich zu JAK3 und TYK2. Indem er intrazellulär die Signalweiterleitung mehrerer Zytokine blockiert, kann er Entzündungsprozesse eindämmen (siehe Abb).
Baricitinib versus MTX
Die CHMP-Empfehlung von Baricitinib basiert auf den Ergebnissen von vier Phase-III-Studien mit erwachsenen Patienten mit mittelschwerer bis schwerer aktiver rheumatoider Arthritis. Geprüft wurde Baricitinib bei:
- Methotrexat-/cDMARD-naiven Patienten (Studie RA-BEGIN),
- Patienten, die inadäquat auf Methotrexat (RA-BEAM),
- andere cDMARDs (RA-BUILD) oder
- TNF-Inhibitoren (RA-BEACON) angesprochen hatten.
In der RA-BEGIN-Studie wurde der primäre Endpunkt der Studie, die Nichtunterlegenheit von Baricitinib in der Monotherapie gegenüber MTX nach 24 Wochen (basierend auf dem ACR20-Ansprechen) erreicht. In Woche 52 blieben diese Resultate erhalten: Unter der Baricitinib-Monotherapie verbesserte sich die Krankheitsaktivität nach den Kriterien des American College of Rheumatology (ACR20, ACR50 und ACR70) signifikant gegenüber der MTX-Monotherapie (je p ≤ 0,001).
Außerdem wurden in dieser Studie bezüglich der von Patienten berichteten Ergebnisse (patient related outcomes, PRO) bereits nach der ersten Behandlungswoche sowohl unter Baricitinib-Monotherapie als auch in der Kombination mit MTX signifikante Verbesserungen der Krankheitsaktivität (z. B. Schmerz, geschwollene und druckschmerzhafte Gelenke) und der körperlichen Funktionsfähigkeit im Vergleich zu MTX allein beobachtet. Die Rate unerwünschter Ereignisse war zwischen den Patientengruppen vergleichbar. Lediglich einige mit der Behandlung in Zusammenhang stehende Nebenwirkungen, darunter Infektionen, traten unter der Baricitinib-MTX-Kombinationstherapie häufiger auf.
In der RA-BUILD-Studie war Baricitinib in zwei Dosierungen (2 und 4 mg einmal täglich) gegen Placebo getestet worden. Unter 4 mg zeigte sich bereits in Woche 1 eine signifikante Überlegenheit der ACR20-Ansprechrate vs. Placebo, die bis Woche 24 anhielt. Auch bei den in dieser Studie erhobenen PROs zeigte sich eine signifikante Überlegenheit von Baricitinib im Vergleich mit Placebo: Unter 4 mg Baricitinib wurden schwere Gelenkschmerzen ab der ersten Woche bis Woche 12, starke Müdigkeit (in Woche 12) und die Schwere der morgendlichen Gelenksteifheit (in Woche 12) signifikant verbessert.
Auch in dieser Studie war die Rate unerwünschter Ereignisse in den Patientengruppen im Wesentlichen vergleichbar. Unter Baricitinib kam es zu einer Reduktion der Neutrophilenzahl und einem Anstieg der LDL- und HDL-Konzentrationen sowie zu einem Fall von Tuberkulose. Bei einem Patienten trat unter der Behandlung Hautkrebs auf. Zu Todesfällen kam es in RA-BEGIN und RA-BUILD nur in den MTX- bzw. Placebogruppen.
Um weitere Informationen über die Wirksamkeit und Langzeitsicherheit von Baricitinib zu erhalten, werden Patienten, die eine der genannten vier Phase-III-Studien beendet haben, derzeit in die randomisierte, doppelblinde Phase-III-Langzeitstudie RA-BEYOND eingeschlossen, in der die Behandlung mit Baricitinib im Vergleich mit Placebo geprüft wird. |
Quelle
Fleischmann R et al. Baricitinib, Methotrexate, or Combination in patients with rheumatoid arthritis and no or limited prior Disease-mModifying antirheumatic drug treatment. Arthritis & Rheumatology 2016, DOI: 10.1002/art.39953.
A study in moderate to severe rheumatoid arthritis (RA-BEAM), NCT01710358, www.clinicaltrials.gov, Abruf am 18.1.17 (Publikation in Kürze erwartet)
Dougados M, et al. Baricitinib in patients with inadequate response or intolerance to conventional synthetic DMARDs: results from the RA-BUILD study. Ann Rheum Dis 2017, 76(1):88–95
Smolen JS et al. Patient-reported outcomes from a randomised phase III study of baricitinib in patients with rheumatoid arthritis and an inadequate response to biological agents (RA-BEACON). Ann Rheum Dis 2016, doi: 10.1136/annrheumdis-2016-209821.
An extension study in participants with moderate to severe rheumatoid arthritis (RA-BEYOND). NCT01885078, www.clinicaltrials.gov, Abruf am 18.1.17
Zwei weitere Phase-III-Studien zu Baricitinib publiziert. Pressemitteilung der Lilly Deutschland GmbH vom 9.12.2016
CHMP empfiehlt EU-Zulassung von Baricitinib zur Behandlung von mittelschwerer bis schwerer aktiver rheumatoider Arthritis bei erwachsenen Patienten. Pressemitteilung der Lilly Deutschland GmbH vom 16.12.2016
Neue Arzneimittel in der Diskussion: Ruxolitinib. Arzneimitteltherapie 2014;32:292–296





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.