
- DAZ.online
- DAZ / AZ
- DAZ 32/2017
- Methadon gegen Schmerzen
Hintergrund
Methadon gegen Schmerzen
Zum Stellenwert von DL-Methadon und Levomethadon in der Palliativmedizin
Aufgrund der aktuellen Berichterstattung zum Einsatz von DL-Methadon als Komedikation bei bestimmten Tumorerkrankungen in Studien (siehe DAZ 2017, Nr. 26, S. 40 – 44) soll hier der anerkannte, evidenzbasierte Einsatz von Levomethadon als Schmerzmittel in der Therapie bei Palliativpatienten beschrieben werden.
Zuerst muss angemerkt werden, dass in sämtlichen anderen Ländern der Welt nur das Racemat DL-Methadon eingesetzt wird. Einzig in Deutschland ist das reine Enantiomer Levomethadon verfügbar. Interessanterweise ist in Deutschland nur das Fertigarzneimittel L-Polamidon® Tropfen zur Therapie von starken Schmerzen zugelassen. Alle weiteren Fertigarzneimittel, die Levomethadon oder DL-Methadon enthalten, haben in Deutschland ausschließlich die Zulassung zur Substitutionstherapie bei Opiatabhängigkeit. Auch die Leitlinienautoren der S3-Leitlinie „Palliativmedizin für Patienten mit einer nicht heilbaren Krebserkrankung“ haben ihre Empfehlungen der deutschen Praxis angepasst, sodass dort immer von Levomethadon die Rede ist. Zu beachten sind die daraus resultierenden unterschiedlichen Dosisangaben: Alle hier zitierten Angaben aus der Literatur beziehen sich auf das Racemat DL-Methadon, die Dosis aus dem unten berichteten Fallbeispiel auf das Enantiomer Levomethadon. Wird von Methadon gesprochen, ist immer das Racemat DL-Methadon gemeint.
5 mg Levomethadon = 10 mg DL-Methadon
Methadon wurde erstmals Ende der 1930er-Jahre in Deutschland hergestellt. Das Racemat wird seit den 1960er-Jahren vor allem in den USA als Substitutionsmittel bei Opiatabhängigkeit eingesetzt, in den letzten Jahren vermehrt auch als Schmerzmittel. Seit diesem Jahr findet sich auch Methadon zur Schmerztherapie bei Krebspatienten auf der WHO-Liste der essenziellen Medikamente [1]. Dies wird mit dem von Morphin abweichenden Wirkprofil und den geringeren Kosten von Methadon begründet [2, 3]. Wesentliche Unterschiede sind der langsamere Wirkungseintritt und die längere Wirkdauer des Methadons, kein „high“ auftritt und Fehlgebrauch somit seltener ist. Ein weiteres Argument für den Einsatz von Methadon ist dessen Antagonismus an NMDA-Rezeptoren insbesondere bei Patienten mit neuropathischer Schmerzkomponente, wobei die Datenlage hierzu spärlich ist [4]. Im aktuellen Cochrane-Review zur Schmerztherapie bei Krebspatienten [5] wird der Stellenwert des Methadons bei Unverträglichkeit von anderen Opioiden unterstrichen. Da aber die Dosisfindung und mögliche Nebenwirkungen wie die QT-Zeit-Verlängerung nicht unerheblich sind, sollte die Verordnung ausschließlich durch erfahrene Schmerztherapeuten erfolgen.
Deutsche S3-Leitlinie setzt nur auf Levomethadon
Die deutsche S3-Leitlinie „Palliativmedizin für Patienten mit einer nicht heilbaren Krebserkrankung“ [6] gibt eine offene Empfehlung für den Einsatz von Levomethadon. Wörtlich heißt es, dass „Levomethadon als Stufe-III-Opioid der ersten oder späteren Wahl bei Patienten mit mittleren bis starken Tumorschmerzen verwendet werden kann“. Allerdings soll der Wirkstoff wegen seines komplexen pharmakokinetischen Profils und der unvorhersehbaren Halbwertszeit nur von erfahrenen Ärzten eingesetzt werden. Als Stufe-III-Opioide der ersten Wahl werden für die orale Anwendung Morphin, Oxycodon und Hydromorphon, die gleiche klinische Effekte erzielen [7], als offene Empfehlung genannt („können eingesetzt werden“). (Zu Äquivalenzdosen der Klasse-III-Opioide siehe auch DAZ 2017, Nr. 25, S. 44.) Am häufigsten genutzt wird Morphin, allerdings eher, weil es lange bekannt ist, wegen guter Verfügbarkeit in vielen Ländern und der geringen Kosten als wegen einer tatsächlich vorhandenen Überlegenheit.
Neben den oralen Darreichungen diverser Opioide in retardierter und nicht retardierter Form sind Fentanyl und Buprenorphin als transdermale Systeme (TTS) eine wichtige Alternative in der Basistherapie. Eine Behandlung von Patienten mit Schluckbeschwerden kann daher mit TTS als klinisch gleichwertige, nicht invasive Alternative zur oralen Opioid-Therapie angezeigt sein [6].
EAPC: DL-Methadon Option bei Opioid-Wechsel
In der europäischen Leitlinie der EAPC (European Association for Palliative Care) [8] wird Methadon vor allem als Option bei Opioid-Wechsel genannt, meist aber erst, nachdem ein Wechsel innerhalb der gängigen Opioide nicht zufriedenstellend war. Dazu stehen im europäischen Ausland zur Schmerztherapie diverse Methadon-haltige Fertigarzneimittel zur Verfügung, z. B. in England Physeptone®, in Dänemark Methadone Alternova® und in Spanien Metasedine®. Insgesamt fehlen jedoch belastbare kontrollierte Studien, zum Wechsel auf Methadon gibt es nur Daten von rund 680 Patienten aus unkontrollierten Studien. Auch in der deutschen S3-Leitlinie wird die Studienlage zur Wirksamkeit von oralem Levomethadon wegen kleiner Fallzahlen oder methodischer Fehler kritisiert [9]. Diverse Arbeiten beleuchten den meist erfolgreichen Wechsel von diversen Opioiden auf Methadon [10, 11]. Allerdings ist andersherum ein Wechsel von Methadon auf ein anderes Opioid schwieriger und seltener erfolgreich, auch hier fehlt es an ausreichenden Daten [12].
Option: subtherapeutische Dosierung
Eine Option bei therapieresistenten Schmerzen kann die zusätzliche Gabe von Methadon in subtherapeutischen Dosierungen (5 bis 10 mg/d) sein. Wallace et al. berichten über dieses Vorgehen bei 20 Patienten mit neuropathischer Schmerzkomponente, bei denen auf diese Art eine deutliche Schmerzreduktion (> 2 Punkte gemäß ESAS [13]; siehe Kasten „Schmerzskalen“) nach wenigen Tagen erreicht werden konnte [14]. D-Methadon kann einer Morphin-induzierten Hyperalgesie entgegenwirken. Dies scheint insbesondere ein Effekt des D-Enantiomers zu sein, da das Racemat eine verminderte und das L-Enantiomer keine Wirkung aufwies [15]. In jedem Fall ist eine sorgfältige Anamnese unabdingbar. Psychische Faktoren müssen berücksichtigt und die Art der Schmerzen (viszeral, neuropathisch oder Nozizeptorschmerz) klar unterschieden werden. Nicht jede Schmerzart ist für eine Opioid-Therapie zugänglich, oft ist die richtige Komedikation für den Therapieerfolg entscheidend.
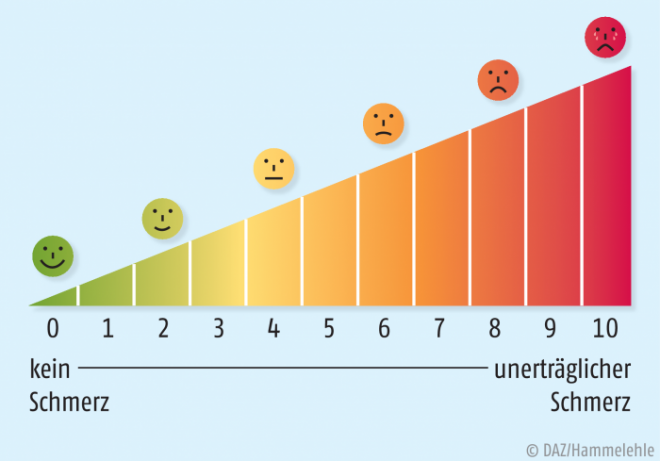
Schmerzskalen – eine Auswahl
Visuelle Analog-Skala (VAS) Auf einer 10 cm langen Linie von „kein Schmerz“ bis „stärkster vorstellbarer Schmerz“ wird vom Betroffenen ein Punkt auf dieser Linie gewählt. VAS eignet sich für ältere und kognitiv beeinträchtigte Personen (s. Abb. 1).
Numerische Analog-Skala (NAS) NAS hat einen Skalenraum von elf Zahlen, wobei „0“ keine Schmerzen und „10“ stärkster vorstellbarer Schmerz bedeutet (s. Abb. 1).
Smiley-Analog-Skala (SAS) Patienten wählen aus meist sechs Gesichtern, die unterschiedlich starke Schmerzen signalisieren, das für sie zutreffendste aus. Besonders geeignet für Demenzpatienten und Kinder (s. Abb. 1).
Edmonton Symptom Assessment System (ESAS) ESAS dient zur Erfassung der Symptome Schmerz, Müdigkeit, Übelkeit, Depression, Angst, Somnolenz, Appetit, Wohlbefinden und Dyspnoe. „0“ bedeutet jeweils die Abwesenheit eines Symptoms, „10“ die stärkste vorstellbare Ausprägung.
Nach wie vor ist Methadon in der Schmerztherapie also nicht Mittel der ersten Wahl, kann aber bei erforderlichem Opioid-Wechsel und in bestimmten Konstellationen, wie Verdacht auf Schmerzmittelmissbrauch oder bei neuropathischer Schmerzkomponente, eine gute Alternative sein.
In der Praxis zeigt sich dies auch an den geringen, aber steigenden Verordnungszahlen: Die Verordnung von Levomethadon in der Schmerztherapie betrug in Deutschland laut Arzneiverordnungs-Report im Jahr 2014 0,98 Millionen definierte Tagesdosen (DDD), das sind 7,7% mehr als im Vorjahr. Auch 2015 konnte ein weiterer Zuwachs bei Levomethadon von 3,3% beobachtet werden. Zum Vergleich waren es 2015 147,4 Millionen Tagesdosen Opioidanalgetika (alle Darreichungsformen außer Substitutionsmittel) [16].
Gründe für einen Opioid-Wechsel
Persistieren starke Schmerzen trotz maximal tolerierter Dosis des angewandten Opioids unter adäquater Komedikation, kann ein Wechsel des Opioids erfolgen, da sich wirkstoffspezifisch Toleranzen ausbilden können – man spricht von unvollständiger Kreuztoleranz. Die zugrunde liegenden Mechanismen sind noch nicht vollständig aufgeklärt, doch diskutiert man eine Beteiligung der Rezeptorreserve bei hochpotenten Opioiden wie Fentanyl und eine Bindung an verschiedene Subtypen [17].
Ebenfalls sinnvoll kann ein Wechsel sein, wenn intolerable Nebenwirkungen auftreten, wie z. B. eine therapieresistente Obstipation. Allerdings scheinen die meisten Opioide hinsichtlich ihrer gastrointestinalen Nebenwirkungen ähnlich [18], immerhin besteht so die Chance, durch Opioid-Wechsel eine Dosisreduktion und somit auch eine Minderung der unerwünschten Wirkungen zu erreichen.
Mangelnde Adhärenz und damit einhergehend mangelnde Wirksamkeit des angewandten Opioids kann auch ein Grund für einen Opioid-Wechsel sein. In diesem Fall ist die Anwendung von Pflastern mit Buprenorphin oder Fentanyl eine gute Option. Der Patient muss nicht (gegebenenfalls mehrmals täglich) an die Einnahme einer Tablette denken und Pflaster können auch von Angehörigen oder Pflegekräften gewechselt werden.
Auch wenn sich die Nieren- oder Leberfunktion signifikant verschlechtert, kann ein Opioid-Wechsel erforderlich sein. Bei eingeschränkter Nierenfunktion sind Hydromorphon, Buprenorphin oder Fentanyl, bei eingeschränkter Leberfunktion Hydromorphon zu bevorzugen [19].
Opioid-Wechsel in der Praxis
Beim Opioid-Wechsel wird zunächst die bisherige Tagesgesamtdosis ermittelt (Regeldosis plus Bedarfsdosis; s. a. Fallbeispiel) und dann immer erst auf die äquipotente Morphin-Dosis umgerechnet. Davon ausgehend kann die Dosis des Ziel-Opioids ermittelt werden. Da häufig für das neue Opioid eine geringere Toleranz („unvollständige Kreuztoleranz“) besteht, wird die neu ermittelte Tagesgesamtdosis um 30 – 50%, bei Methadon um 70% reduziert [19]. Ausgehend von dieser neuen Regeldosis wird mittels Bedarfsgaben bis zum gewünschten Effekt aufdosiert. Eine Bedarfsdosis sollte in etwa 1/6 der Tagesdosis betragen. Bei mehr als etwa drei bis fünf Bedarfsdosen pro Tag werden diese in die Berechnung der Regeldosis für die folgenden Tage einbezogen. Sind die zusätzlichen Gaben durch besondere Situationen wie z. B. schmerzhafter Verbandwechsel begründet, werden sie nicht in die Berechnung einbezogen. Die resultierende Dosis wird gemäß der Wirkdauer des neuen Opioids wieder auf mehrere Gaben am Tag verteilt.
Morphin Ausgangsdosis |
Verhältnis Morphin: Methadon (Protokoll) |
Finales Verhältnis Morphin: Methadon –Durchschnitt (min/max) nach 14 Tagen |
Finales Verhältnis Morphin: Levomethadon – Durchschnitt (min/max) nach 14 Tagen |
|---|---|---|---|
30 – 90 mg |
4:1 |
||
91 – 300 mg |
6:1 |
4:1 (3,3 – 4,7) |
8:1 (6,6 – 9,4) |
301 – 600 mg |
8:1 |
7,5:1 (4,4 – 10,0) |
15:1 (8,8 – -20,0) |
601 – 1000 mg |
10:1 |
11,7:1 (7,1 – 17,3) |
23,4:1 (14,2 – 34,6) |
>1000 mg |
12:1 |
14,2:1 (8,6 – 26,7) |
28,4:1 (17,2 – 53,4) |
Beim Wechsel auf Methadon werden in der Literatur verschiedene Strategien beschrieben: Bei der „Stop-and-go“-Vorgehensweise wird das Ausgangsopioid sofort komplett abgesetzt und mit der errechneten Methadon-Dosis begonnen (Tab. 1). Beim „switch over three days“ wird über drei Tage jeweils ein Drittel der Ausgangsdosis abgesetzt und durch die entsprechende Menge Methadon ersetzt. Bis zur endgültigen Dosis vergeht dann noch deutlich mehr Zeit, in der Arbeit von Moksnes et al. [20], aus der auch die Umrechnungstabelle stammt, wurde die Enddosis nach 14 Tagen ermittelt, im unten beschriebenen Fall aus der Praxis war nach elf Tagen ein stabiles Niveau erreicht. Als Vorteil der „Stop-and-go“-Methode wird das schnellere Nachlassen unerwünschter Wirkungen genannt, als Vorteil des langsameren „switch over three days“ die größere Sicherheit bei der Dosisfindung.
Fallbeispiel: Ein Patient erhält 900 mg Morphin pro Tag und soll auf Levomethadon umgestellt werden, da entweder inakzeptable Nebenwirkungen auftraten oder die Analgesie nicht ausreichte. Umrechnungsfaktoren entsprechend den Ergebnissen von Moksnes et al. könnten zwischen 14,2 und 34,6 betragen, dieser Patient könnte als endgültige Dosis nach 14 Tagen zwischen 26 mg und 63 mg Levomethadon pro Tag benötigen. Bei Patienten, die vorher eine ausreichende Analgesie aber zu viele Nebenwirkungen hatten, können die gefundenen Methadon-Dosierungen als äquianalgetisch zu den Morphin-Ausgangsdosierungen angesehen werden. Um nun eine sinnvolle Entscheidung für eine Startdosis treffen zu können, ist einiges an klinischer Erfahrung samt engmaschiger Kontrolle nötig.
Besondere Eigenschaften von Methadon
Pharmakodynamik: Levomethadon ist bekanntermaßen ein starker Agonist am µ-Rezeptor, hierbei hat das L-Enantiomer eine etwa fünfzigfach höhere Affinität als das D-Enantiomer. Relativ zu Morphin ist Levomethadon etwa viermal so potent, wobei die Dosis nicht linear umgerechnet werden kann. Beim Opioid-Wechsel wird bei höheren Morphin-Dosen im Verhältnis zu niedrigen Dosen weniger Methadon benötigt. Bei der Wirkung von Methadon ist es essenziell, zu unterscheiden, welches Enantiomer welche Wirkung hervorruft. In-vitro-Bindungsstudien haben gezeigt, dass beide Enantiomere einen nicht kompetitiven NMDA-Antagonismus aufweisen [22]. Zur Differenzierung der opioiden Wirkung der Enantiomere wurde in vivo an Ratten die analgetische Wirkung mit und ohne Naloxon untersucht. Dabei zeigte L-Methadon eine dosisabhängige Analgesie, die durch Naloxon-Komedikation wieder verschwand. D-Methadon hingegen zeigte analgetische Effekte bei der zentralen NMDA-vermittelten Sensibilisierung im Rückenmark. Diese Wirkung konnte nicht durch Naloxon abgeschwächt werden [23]. Andere Tierversuche haben gezeigt, dass D-Methadon keine direkten analgetischen Effekte aufweist, allerdings sehr potent ist, einer Morphin-Toleranzentwicklung entgegenzuwirken und diese sogar verhindern kann [24]. Ein diskutierter Mechanismus, der einer Toleranzentwicklung entgegenwirkt, ist die dem Methadon zugeschriebene Eigenschaft, µ-Rezeptoren zu desensibilisieren und zu internalisieren [25]. Präklinische Studien haben gezeigt, dass Methadon ebenfalls eine Affinität zum hERG-Kaliumkanal aufweist [26]. Eine Stereoselektivität wurde teilweise beschrieben, so wurde gezeigt, dass in mittleren Dosisbereichen D-Methadon eine signifikant höhere QTc-Zeit-Verlängerung hervorrief [27]. Geringere IC50-Werte wurden ebenfalls ermittelt, allerdings waren sowohl D- als auch L-Methadon stark mit dem Auftreten von Long-QT-Syndrom (LQTS) über einen breiten Konzentrationsbereich korreliert, sodass keine Differenzierung gemacht werden konnte [28]. Durch die daraus resultierende Verlängerung des QTc-Intervalls steigt das Risiko für Torsade-de-pointes-Arrhythmien (TdP). QTc-Zeit-Verlängerungen wurden bereits bei Dosen von 20 bis 30mg/d beobachtet, wohingegen TdP tendenziell im Hochdosisbereich auftraten [27, 28] – als signifikanter Risikofaktor konnte jedoch nur die Komedikation identifiziert werden [29]. Da eine in dieser Hinsicht „sichere“ Methadon-Dosis noch nicht definiert werden konnte, ist die Kontrolle per EKG höchst empfehlenswert.
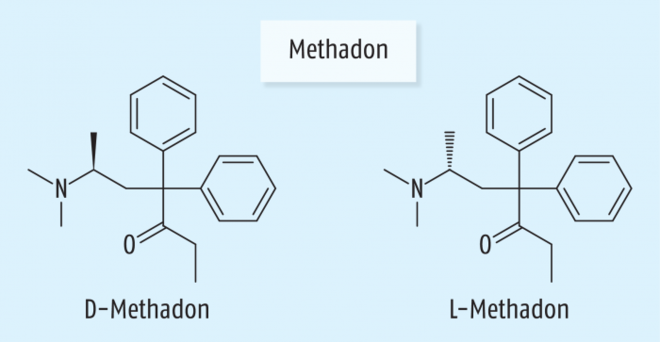
Pharmakokinetik: Methadon ist ein racemisches Gemisch aus DL-Methadon und zeichnet sich durch einen stark lipophilen Charakter aus (Abb. 2). Nach oraler Applikation von Methadon-Lösung oder -Tabletten werden maximale Plasmakonzentrationen nach knapp drei Stunden erreicht. Alternativ kann Methadon auch erfolgreich buccal appliziert werden [30]. Die Bioverfügbarkeit liegt bei 67 – 95%. Als lipophile Substanz besitzt Methadon eine hohe Gewebebindung und folglich ein großes Verteilungsvolumen.
Zu den Faktoren, die die Pharmakokinetik von Methadon beeinflussen können, gehören u. a. Gewicht und Geschlecht, Plasmaproteinbindung, Urin-pH-Wert und die Beeinflussung von CYP-Enzymen.
Die Metabolisierung des Methadons verläuft hauptsächlich über CYP3A4, CYP2B6 und CYP2C19 sowie in geringerem Ausmaß über CYP2D6 und CYP2C9. Praktisch alle Metaboliten sind inaktiv. Nicht zuletzt ist Methadon ein Substrat des P-Glykoprotein-Transporters, sämtliche genannten Wege weisen erhebliche genetische Polymorphismen auf oder können durch Interaktionen stark in ihrer Funktion beeinflusst werden [21, 31].
Einen Überblick ausgewählter CYP-Induktoren, die zu einer verminderten Methadon-Wirkung, und CYP-Inhibitoren, die zu einer verstärkten Methadon-Wirkung führen, gibt Tabelle 2.
Induktion |
Inhibition |
||
|---|---|---|---|
CYP3A4 |
CYP2B6 |
CYP3A4 |
CYP2B6 |
Methadon |
Rifampicin |
Antimykotika: Fluconazol, Ketoconazol |
Haloperidol |
Antikonvulsiva: Carbamazepin, Phenobarbital, Phenytoin |
Hyperforin |
SSRIs: Fluvoxaminmaleat, Fluoxetin |
SSRIs: Paroxetin, Sertralin |
Antibiotika: Rifampicin, Rifabutin |
Carbamazepin |
Antibiotika: Erythromycin |
Nelfinavir |
Antiretrovirale Stoffe: Abacavir, Amprenavir, Nevirapin |
Ritonavir |
Einige HIV-Protease-Inhibitoren: Ritonavir, Indinavir, Saquinavir |
Ritonavir |
Johanniskraut |
Efavirenz |
Grapefruitsaft |
Ticlopidin |
Phenytoin |
Clopidogrel |
||
Artemisin | |||
Quelle: Trafton, Ramani 2009 [21] | |||
Außerdem kann die Wirksamkeit von Methadon durch die Plasmaproteinbindung (PPB), insbesondere durch das α1-saure Glycoprotein, beeinflusst werden. Einerseits kann Methadon aus der PPB durch Arzneistoffe wie Propranolol, Phenothiazine und Imipramin sowie Carmustin und Mechlorethamin verdrängt werden, wodurch es zur vorübergehenden Wirkungssteigerung kommt, andererseits kann die Methadon-Wirkung durch die verstärkte Produktion von α1-saurem-Glycoprotein im Zuge einer Krebserkrankung oder bei Opiat-Abhängigkeit abnehmen [31]. Ein Urin-pH <6 sowie Schwangerschaft sind ebenfalls Faktoren, die sich negativ auf die Methadon-Wirkung auswirken können [21].
Tipps für das Medikationsmanagement
Durch die sehr lange und zugleich stark variable Halbwertszeit, die zwischen 24 und 36 Stunden liegt, kann die Methadon-Titration zum Steady-State bis zu zehn Tage dauern und so die Dosisfindung erschweren. Der Patient sollte in den ersten Stunden und Tagen bei jeglicher Dosisänderung engmaschig auf sowohl fehlende als auch unerwünschte Wirkungen, insbesondere übermäßige Sedierung, beobachtet werden. Anzumerken ist, dass die atemdepressive Wirkung später auftritt und länger anhält als der analgetische Effekt. Sämtliche Leitlinien empfehlen deshalb, Methadon nur von erfahrenen Ärzten wie Anästhesiologen, Schmerzmedizinern oder Palliativmedizinern einzusetzen. In manchen Ländern benötigen Allgemeinmediziner für die Verordnung von Methadon als Schmerzmittel sogar eine besondere Zulassung [32], in Frankreich ist Methadon nur verordnungsfähig, wenn mit anderen Opioiden keine ausreichende Wirkung erzielt werden konnte [33].
Außerdem muss das LQTS in der Therapie bedacht werden. Risikofaktoren wie Alter, weibliches Geschlecht, Elektrolytstörung, bestehende Herzerkrankungen, diverse Komedikation und speziell in diesem Fall die Pharmakokinetik des Arzneistoffes selbst erhöhen die Wahrscheinlichkeit des Auftretens eines LQTS. Daher sollte vor und während der Therapie eine EKG-Überwachung stattfinden [5]. Wie bei allen Opioiden ist eine Beeinflussung der Darmmotilität sehr wahrscheinlich und muss bei der (dann vermehrten) Resorption der Komedikationen bedacht werden. Um einer Potenzierung der sedierenden UAW vorzubeugen, sollte unbedingt darauf geachtet werden, dass kein Alkohol konsumiert wird oder gleichzeitig sedierende Arzneimittel wie Benzodiazepine oder Z-Substanzen eingenommen werden.
Die Lipophilie des Methadons ist günstig für eine buccale Anwendung bei Palliativpatienten, die nicht mehr schlucken können. Hierbei wurden erfolgreich Dosen von bis zu 15 mg Methadon (in 1,5 ml Lösung) buccal appliziert [30].
Highlights
- In Deutschland ist für die Schmerztherapie nur L-Polamidon® (Levomethadon) zugelassen.
- L-Polamidon sollte nur von in der Schmerztherapie erfahrenen Ärzten eingesetzt werden.
- Dosierungsangaben sollten sorgfältig beachtet werden: Ein Milliliter L-Polamidon®-Lösung enthält 5 mg Levomethadon.
- 5 mg Levomethadon entsprechen 10 mg DL-Methadon.
- Eine stationäre Dosiseinstellung ist sehr empfehlenswert.
- Auch das Pflegepersonal soll für Überdosierungssymptome und Dosiergenauigkeit sensibilisiert werden.
Eine 25-jährige Patientin mit Rektumkarzinom
Anamnese
- 03/2014 Erstdiagnose: tiefsitzendes, stenosierendes Rektumkarzinom bei 8 cm ab ano
- Rektumresektion mit protektivem doppelläufigem Ileostoma
- Compliance für eine adjuvante Therapie konnte nicht erreicht werden
- 08/2016 ausgedehntes Rezidiv im kleinen Becken mit Infiltration der Blasenhinterwand, Fistelung zum Dünndarm; diverse chirurgische Interventionen
Symptomlast 05/2017
- Schmerzexazerbation nozizeptiv und neuropathisch bei pathologischer Fraktur im Bereich des Kreuzbeines und Infiltration des Plexus lumbosacralis. Zusätzlich viszerale Schmerzen bei Nierenbeckenkelchaufstau
- Auf der numerischen Analogskala (NAS) betrug der angegebene Schmerz der Patientin maximal 10 und durchschnittlich 8. (0 = kein Schmerz, 10 = schlimmster vorstellbarer Schmerz)
- Übelkeit und Erbrechen bei erosiver Gastritis mit Störung der gastrointestinalen Motilität
- Obstipation, teilweise paralytischer Subileus
- Demoralisierung
Vorbestehende Medikation bis 06/2017:
- Pantoprazol 40 mg 1-0-1
- Pregabalin 225 mg 1-0-1
- Hydromorphon 24 mg retard 4-0-4
- Hydromorphon 8 mg retard 1-0-1
- Amitriptylin 50 mg 0-0-1
- Macrogol 1 – 2 Beutel täglich gegen Obstipation
Bedarfsmedikation:
- Metamizol bis 4 × 1 g bei Schmerzen
- Fentanyl nasal 400 µg/Hub gegen starke Schmerzen, Sperrzeit 20 min; diese Bedarfsmedikation wurde alle zwei bis drei Stunden abgefordert
- Alternativ: Hydromorphon akut 10,8 mg (4 à 2,6 mg), Sperrzeit 4 h
- Metoclopramid bis 3 × 10 mg gegen Übelkeit
- Natriumpicosulfat 21 Tropfen, wenn zwei Tage kein Stuhlgang erfolgt ist
Stationäre Palliativbehandlung 06/2017
Wegen der komplexen Symptomlast und unzureichender Linderung unter der seit acht Wochen exorbitant gestiegenen Opioid-Dosierung und zur Anpassung der antineuropathischen Medikation wurde der Entschluss zur stationären Aufnahme der Patientin gefasst. So konnte der Opioid-Wechsel auf Levomethadon unter engmaschiger Kontrolle durchgeführt werden.
Die erhebliche Dosissteigerung der nicht retardierten Opioide legte zum einen den Verdacht auf Fehlgebrauch nahe, möglicherweise um Ängste und Spannungen angesichts des massiven Krankheitsfortschrittes zu reduzieren, zum anderen manifestierte sich ein zunehmendes Craving – ein Verhalten beim Abfluten der schnellwirksamen Substanzen mit typischen Unruhezuständen, Schwitzen und weiteren vegetativen Begleiterscheinungen im Sinne eines Entzugssyndroms. Dies stellte eine weitere Indikation zur Umstellung auf Levomethadon dar.
Für die Opioid-Umstellung auf Levomethadon gibt es keine evidenzbasierten Verfahrensanweisungen, sondern nur Erfahrungswerte und Fallberichte. Interindividuell stark unterschiedliche Plasmaspiegel erfordern eine engmaschige Überwachung der Vigilanz der Patienten.
Nicht zu unterschätzen ist auch das Risiko von Fehldosierungen durch Verwechslung von Millilitern und Milligramm. Insofern sollte die Dosisangabe immer in derselben Dosiseinheit, aus anästhesiologischer Sicht in Milligramm, erfolgen.
Die Bedarfsmedikation ließ sich wegen der wenig konkreten Angaben der Patientin und dem starken Verdacht auf Missbrauch nicht zweifelsfrei beziffern. Die Ermittlung anhand der Sperrzeiten und Packungsfüllung des Fentanylsprays ließ auf etwa 7 × 400 µg Fentanyl pro Tag schließen. In die Berechnung der Levomethadon-Startdosis wurden 208 mg Hydromorphon (entsprechend 1450 mg Morphin) und 2800 µg Fentanyl (entsprechend etwa 350 mg Morphin) einbezogen. Die rechnerische Ausgangsdosis beträgt also etwa 1800 mg Morphin.
Es wird nochmal darauf hingewiesen, dass wegen der komplizierten Pharmakokinetik eine Umrechnung nicht unüberlegt nach Schema erfolgen sollte, jeder Patient sollte individuell betrachtet werden. Ein sehr sensibler Hinweis auf Überdosierung ist eine verwaschene Sprache, dann ist sofort eine Dosisreduktion vorzunehmen.
Bei stationärer Aufnahme wurde auch wegen der Komedikation mit Amitriptylin, das auch QTc-Zeit-verlängernd ist, zunächst ein Kontroll-EKG aufgenommen, dann nach der „Stop-and-go“-Methode Hydromorphon und Fentanyl sofort komplett abgesetzt und mit einer Startdosis von 30 mg/d Levomethadon begonnen. Die Patientin bekam sechsmal täglich 5 mg p.o. und konnte zusätzlich 5 mg bei Bedarf abfordern, bei einer Sperrfrist von 60 Minuten.
Zum Schutz vor sympathoadrenergen Entzugserscheinungen wurde unter Beachtung der kardiovaskulären Verträglichkeit die Therapie mit 150 µg Clonidin dreimal täglich ergänzt.
Am zweiten Tag wurde die Levomethadon-Dosis wie folgt angepasst: Summierung aller benötigten Dosen von Tag 1 (Regeldosis + Bedarfsdosis), die Gesamtmenge wurde erneut auf sechs Einzeldosen verteilt, die Bedarfsdosierung blieb unverändert mit bis zu stündlich abforderbaren 5 mg Levomethadon.
Am dritten Tag erfolgte eine erneute Ermittlung der Gesamttagesdosis vom zweiten Tag (Regeldosis + Bedarfsdosis), dann wurde aber wegen der Kumulation der Substanz (s. Pharmakokinetik) die so ermittelte Gesamtdosis halbiert und auf drei Tagesdosen (alle acht Stunden) verteilt. Die Möglichkeit der Bedarfsabforderung blieb unverändert mit bis zu stündlich 5 mg bestehen, wurde aber nur noch zwei- bis dreimal täglich abgefordert.
Die antineuropathische Medikation wurde mit zweimal täglich 150 mg Oxcarbazepin ergänzt und Clonidin im Verlauf des stationären Aufenthaltes komplett ausgeschlichen.
Die Patientin verließ mit folgender Medikation bei deutlich gelinderter Symptomlast die Klinik:
Entlassmedikation:
- Levomethadon 25 mg 1-0-1
- Pregabalin 225 mg 1-0-1
- Oxcarbazepin 150 mg 1-0-1
- Amitriptylin 50 mg 0-0-1
- Natriumpicosulfat 20 Tropfen alle ein bis zwei Tage
Bedarfsmedikation:
- Metamizol 1 g bis zu 1-1-1-1
- Macrogol Beutel 1-0-0
- Levomethadon 5 mg/Sperrzeit 4 h
- Schmerz max NAS 5, min 2, durchschnittlich 3
Die gastrointestinale Motilität hatte sich deutlich gebessert, Stuhlgang erfolgte regelmäßig alle zwei bis drei Tage, keine Subileussymptomatik mehr, der Nierenaufstau war durch eine Harnleiterschiene kupiert und das Demoralisierungssyndrom durch engmaschige psychoonkologische Mitbetreuung gelindert.
An diesem Fallbeispiel wird deutlich, dass Levomethadon durchaus eine Daseinsberechtigung für besondere Situationen in der Schmerztherapie bei Palliativpatienten hat und die Risiken bei der Dosisfindung durch engmaschige ärztliche und pflegerische Überwachung beherrschbar sind. Ein Off-label-Use von Methadon-haltigen Fertigarzneimitteln oder der Einsatz von Methadon-Rezepturen scheint angesichts der noch spärlichen Datenlage zu möglichen Vor- oder Nachteilen der einzelnen Enantiomere zurzeit nicht vertretbar, da mit L-Polamidon® schließlich ein zugelassenes Fertigarzneimittel in Deutschland zur Verfügung steht. |
Literatur
[1] WHO. Model List of Essential Medicines 20th Edition. 2017;(March).
[2] Ripamonti CI, Giusti R. EML Opioids for cancer pain; a comparative overview. 2017.
[3] World Health Organization. The Selection and Use of Essential Medicines 2017. Sel Use Essent Med 2017. 2017;(March).
[4] McNicol ED, Ferguson MC, Schumann R. Methadone for neuropathic pain in adults. In: McNicol ED, editor. Cochrane Database of Systematic Reviews [Internet]. Chichester, UK: John Wiley & Sons, Ltd; 2017 [cited 2017 Jul 20]. p. CD012499. Available from: http://www.ncbi.nlm.nih.gov/pubmed/28514508
[5] Nicholson A, Watson G, Derry S, Wiffen P. Methadone for cancer pain ( Review ). 2017;(2).
[6] Deutsche Gesellschaft für Palliativmedizin. S3-Leitlinie Palliativmedizin für Patienten mit einer nicht heilbaren Krebserkrankung. Awmf. 2015;1–268.
[7] Wiffen P, Wee B, Moore R. Oral morphine for cancer pain. 2016;(4).
[8] Caraceni A, Hanks G, Kaas S, Bennett M, Brunelli C. Use of Opioid Analgesics in the Treatment of Cancer Pain : Evidence-based Recommendations from the EAPC Web version of the article published in Lancet Oncology. Lancet Oncol. 2012;13(February):58–68.
[9] Dale O, Moksnes K, Kaasa S. European Palliative Care Research Collaborative pain guidelines: opioid switching to improve analgesia or reduce side effects. A systematic review. Palliat Med. 2011;25(5):494–503.
[10] Mercadante S. Original Research Article Switching Methadone : A 10-Year Experience of 345 Patients in an Acute Palliative Care Unit. 2012;399–404.
[11] Mercadante S, Porzio G, Ferrera P, Fulfaro F, Aielli F, Verna L, et al. Sustained-release oral morphine versus transdermal fentanyl and oral methadone in cancer pain management. Eur J Pain. 2008;12(8):1040–6.
[12] Moryl N, Santiago-Palma J, Kornick C, Derby S, Fischberg D, Payne R, et al. Pitfalls of opioid rotation: substituting another opioid for methadone in patients with cancer pain. [cited 2017 Jul 23]; Available from: http://ac.els-cdn.com/S0304395901004651/1-s2.0-S0304395901004651-main.pdf?_tid=105c1470-6f9d-11e7-8228-00000aacb360&acdnat=1500810783_90d9e9a6c47a9cf392a6ffc097eab902
[13] Edmonton Symptom Assessment System. 2005; Available from: https://www.cancercare.on.ca/common/pages/UserFile.aspx?fileId=13262
[14] Wallace E, Ridley J, Bryson J, Mak E, Zimmermann C. Addition of methadone to another opioid in the management of moderate to severe cancer pain: a case series. J Palliat Med [Internet]. 2013;16(3):305–9. Available from: http://www.ncbi.nlm.nih.gov/pubmed/23391350
[15] Holtman JR, Wala EP. Characterization of the antinociceptive and pronociceptive effects of methadone in rats. Anesthesiology. 2007;106(3):563–71.
[16] Schwabe U, Paffrath D, Hrsg. Arzneiverordnungs-Report 2016.
[17] Boje KMK, Pollack GM, Dumas EO. Opioid Tolerance Development: A Pharmacokinetic/Pharmacodynamic Perspective. 2008 [cited 2017 Jul 26]; Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2628209/pdf/12248_2008_Article_9056.pdf
[18] Wirz S, Wittmann M, Schenk M, Schroeck A, Schaefer N, Mueller M, et al. Gastrointestinal symptoms under opioid therapy: A prospective comparison of oral sustained-release hydromorphone, transdermal fentanyl, and transdermal buprenorphine. Eur J Pain [Internet]. 2009;13(7):737–43. Available from: http://dx.doi.org/10.1016/j.ejpain.2008.09.005
[19] Preston B, Imfeld P. Umrechnungsfaktoren zur Opioidrotation. Univ Basel Spit [Internet]. 2015;V4:9. Available from: http://www.spitalpharmazie-basel.ch/dienstleistungen/
[20] Moksnes K, Dale O, Rosland JH, Paulsen Ø, Klepstad P, Kaasa S. How to switch from morphine or oxycodone to methadone in cancer patients? A randomised clinical phase II trial. 2011 [cited 2017 Jul 24]; Available from: http://ac.els-cdn.com/S0959804911004758/1-s2.0-S0959804911004758-main.pdf?_tid=d972677c-70a8-11e7-a787-00000aacb361&acdnat=1500925796_74e08176d6cc1bd333018adf99245fdc
[21] Trafton JA, Ramani A. Methadone : A New Old Drug With Promises and Pitfalls. 2009;
[22] Gorman AL, Elliott KJ, Inturrisi CE. The d- and l-isomers of methadone bind to the non-competitive site on the N-methyl-D-aspartate (NMDA) receptor in rat forebrain and spinal cord. Neurosci Lett. 1997;223(1):5–8.
[23] Shimoyama N, Shimoyama M, Elliott KJ, Inturrisi CE. d-Methadone Is Antinociceptive in the Rat Formalin Test. J Pharmacol Exp Ther [Internet]. 1997 [cited 2017 Jul 24];283(2):648–52. Available from: https://pdfs.semanticscholar.org/6758/597b87708ff8e37f39d412ac5041f2d26ef5.pdf
[24] Davis AM, Inturrisi CE. d-Methadone Blocks Morphine Tolerance and N-Methyl-D- Aspartate-Induced Hyperalgesia. J Pharmacol Exp Ther [Internet]. 1999 [cited 2017 Jul 24];289(2):1048–53. Available from: http://www.jpet.org
[25] Kim JA, Bartlett S, He L, Nielsen CK, Chang AM, Kharazia V, et al. Morphine-induced endocytosis of the mu opioid receptor in a novel knock in mouse enhances analgesia and reduces tolerance and dependence. [cited 2017 Jul 21]; Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2997702/pdf/nihms38997.pdf
[26] Katchman AN, Mcgroary KA, Kilborn MJ, Kornick CA, Manfredi PL, Woosley RL, et al. Influence of Opioid Agonists on Cardiac Human Ether-a-go-go- related Gene K+ Currents. J Pharmacol Exp Ther [Internet]. 2002 [cited 2017 Jul 23];303(2):688–94. Available from: http://jpet.aspetjournals.org/content/jpet/303/2/688.full.pdf
[27] Wedam EF, Bigelow GE, Johnson RE, Nuzzo PA, P Haigney MC. QT-Interval Effects of Methadone, Levomethadyl, and Buprenorphine in a Randomized Trial. ARCH INTERN MED [Internet]. 2007 [cited 2017 Jul 23];167(22):2469–75. Available from: https://pdfs.semanticscholar.org/eed8/693690362c177066d8dd1dfbbc9e4993ca09.pdf
[28] Anchersen K, Clausen T, Gossop M, Hansteen V, Waal H. Prevalence and clinical relevance of corrected QT interval prolongation during methadone and buprenorphine treatment: A mortality assessment study. Addiction. 2009;104(6):993–9.
[29] Ehret GB, Voide C, Gex-Fabry M, Chabert J, Shah D, Broers B, et al. Drug-Induced Long QT Syndrome in Injection Drug Users Receiving Methadone. ARCH INTERN MED [Internet]. 2006 [cited 2017 Jul 23];166:1280–7. Available from: http://citeseerx.ist.psu.edu/viewdoc/download?doi=10.1.1.523.5350&rep=rep1&type=pdf
[30] Spaner D. Effectiveness of the buccal mucosa route for methadone administration at the end of life. J Palliat Med [Internet]. 2014;17(11):1262–5. Available from: http://www.ncbi.nlm.nih.gov/pubmed/24922462
[31] Garrido MJ, Trocóniz IF. Methadone: a review of its pharmacokinetic/pharmacodynamic properties. J Pharmacol Toxicol [Internet]. 1999 [cited 2017 Jul 21];42:61–6. Available from: http://ac.els-cdn.com/S1056871900000435/1-s2.0-S1056871900000435-main.pdf?_tid=1a41582c-6e32-11e7-8d66-00000aab0f02&acdnat=1500654892_8faaae21f305f06d5aa1e3ff25289f28
[32] Hawley P. Methadone for pain in palliative care. B C Med J [Internet]. 2012;54(6):298–301. Available from: http://www.scopus.com/inward/record.url?eid=2-s2.0-84863453931&partnerID=40&md5=57bf51b097ca660162b142b53a699e2d
[33] Rhondali W, Tremellat F, Ledoux M, Ciais J-F, Bruera E, Filbet M. Methadone rotation for cancer patients with refractory pain in a palliative care unit: an observational study. J Palliat Med [Internet]. 2013;16(11):1382–7. Available from: http://www.ncbi.nlm.nih.gov/pubmed/24116946

























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.