
- DAZ.online
- DAZ / AZ
- DAZ 26/2017
- Mit Methadon gegen Krebs
Hintergrund
Mit Methadon gegen Krebs?
Experimenteller Therapieansatz lässt Patienten hoffen und stößt auf Kritik
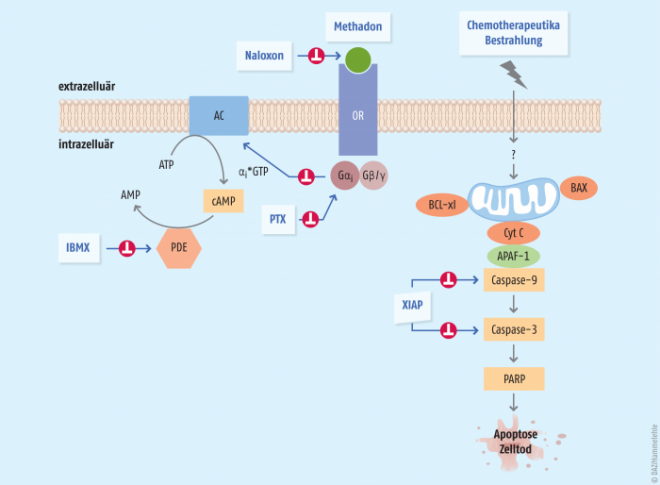
DL-Methadon ist ein chirales Molekül und liegt als Racemat von D-Methadon und L-Methadon vor. Methadon ist ein Agonist an µ- und κ-Opioid-Rezeptoren. Davon ausgehend, dass die Aktivierung des Opioid-Rezeptors über verschiedene Stufen zur Apoptose führen kann, kam der Gedanke auf, ob durch eine forcierte Aktivierung der Opioid-Rezeptoren mithilfe von Methadon eine verstärkte Apoptose von Tumorzellen herbeigeführt werden kann. Da Tumorzellen im Vergleich zu gesunden Zellen vermehrt Opioid-Rezeptoren aufweisen – man spricht in diesem Fall von einer hohen Rezeptordichte – könnten sie durch entsprechende Stimuli relativ selektiv in die Apoptose überführt werden. Untersucht wurde nun, ob Methadon diesen Vorgang verstärken kann. Die Aktivierung des Opioid-Rezeptors erfolgt am stärksten durch das Racemat, da der D-Anteil den Opioid-Rezeptor stabilisiert und die Bindung von L-Methadon erleichtert.
Methadon plus Zytostatika: doppelter Synergismus
Die Einleitung des programmierten Zelltods mithilfe von Methadon (Abb.) hängt von der Rezeptorzahl auf den Tumorzellen ab. Sie ist jedoch bei den meisten Tumorzellen – trotz erhöhter Rezeptordichte im Vergleich zu gesunden Zellen – immer noch zu gering für eine ausreichende antitumorale Methadon-Wirkung. Durch Strahlen und Zytostatika kann jedoch die Rezeptordichte weiter erhöht werden, so dass diese als Wirkverstärker für Methadon dienen können.
Allerdings muss bei einer Chemotherapie mit einer Resistenzbildung gerechnet werden. Einer der grundlegenden Mechanismen, durch die Krebszellen einer Chemotherapie entgehen können, ist das Herausschleusen von Chemotherapeutika aus der Zelle durch P-Glycoprotein. Da die Bindung von Methadon an die Tumorzelle wie ein Türöffner für Zytostatika wirkt, kann es die Aufnahme von Chemotherapeutika in die Krebszelle erhöhen. Zudem hemmt Methadon das P-Glycoprotein-abhängige Ausschleusen von Zytostatika aus der Krebszelle. So verstärken sich Zytostatikum und Methadon gegenseitig. Man spricht von einem doppelten Synergismus: Das Zytostatikum erhöht die Rezeptorendichte und bietet Methadon mehr Andockstellen, Methadon lässt mehr Zytostatika in die Zelle eindringen und verhindert deren Ausschleusung. Dieses gegenseitige Aufschaukeln konnte für einige Zytostatika-Methadon-Kombinationen gezeigt werden, unter anderem für Anthrazykline (Doxorubicin) und Platinkomplexe.
Experimentelle Untersuchungen
Seit rund zehn Jahren wird in Deutschland verstärkt die anti-tumorale Wirksamkeit von Methadon untersucht. Versuche von Dr. Claudia Friesen, Diplom-Chemikerin und Leiterin des molekularbiologischen Forschungslabors am Institut für Rechtsmedizin in Ulm, zeigten 2008 die wachstumshemmende Wirkung von Methadon auf Leukämiezellen. Dem folgten weitere Experimente, die darauf hinwiesen, dass Methadon in Kombination mit dem Zytostatikum Doxorubicin zu einem Absterben von Glioblastomzellen führte.
Meldungen aus der Praxis und den Medien
In den Medien (z. B. im NDR am 11.4.17, 17.8.2016 in der Tagesschau24 oder am 21.6.2017 in Stern TV) wurde u. a. berichtet, dass eine Behandlung mit Methadon bei Patienten mit Tumoren (insbesondere mit Glioblastomen und Leukämien) die Wirkung von Chemotherapien verstärkt und zu einer fast vollständigen Zerstörung der Tumoren führen kann. Dieses Therapiekonzept habe sich insbesondere bei Patienten mit weit fortgeschrittener Erkrankung bewährt. Insgesamt 80 Patienten seien erfolgreich behandelt worden.
Der Palliativmediziner Dr. Hans-Jörg Hilscher (Iserlohn) beobachtete in dem von ihm betreuten Hospiz positive Wirkungen bei Palliativpatienten, die unter Methadon länger als erwartet überlebten (s. Interview „Eine Chance“).
Methadon in klinischen Studien
In einer 2017 von Onken, Friesen und Mitarbeitern publizierten retrospektiven Untersuchung von 27 Glioblastom-Patienten hatten die Betroffenen zu einer unterschiedlich gestalteten Chemotherapie Methadon erhalten. Ziel war es, Daten zur Sicherheit und zur Verträglichkeit dieser Kombinationstherapie zu erhalten. Die Autoren stellten fest, dass die zusätzliche Methadon-Behandlung weder das Toxizitätsrisiko erhöht noch zu vegetativen Nebenwirkungen wie Tachykardie oder Unruhe geführt hat. Hervorzuheben ist die Übelkeit, die zu Beginn der Methadontherapie auftrat und bei vier Patienten länger als drei Tage anhielt. Auch mit einer Verstopfung muss gerechnet werden. Sie wurde bei drei Patienten beschrieben. Die Autoren betonen, dass aufgrund der begrenzten Patientenzahl und des retrospektiven Studiendesigns keine Aussage zum Einfluss der Methadon-Therapie auf den Therapieerfolg gemacht werden kann. Trotz vielversprechender Laborergebnisse würden nach wie vor belastbare klinische Daten fehlen, die die Antitumorwirkung von Methadon belegen. Diese Frage könne nur in einer prospektiven, randomisierten klinischen Studie geklärt werden. Auch in einer Fallserie mit etwa 20 Patienten zum Einsatz von Methadon in der Glioblastomtherapie (Leiter Dr. Martin Misch, Charité Berlin), konnte gezeigt werden, dass Methadon mit den Krebstherapien ohne erhöhte Toxizität kombiniert werden kann.
In Ulm wurde unter Leitung von Mediziner Prof. Thomas Seufferlein eine Phase-I/II-Studie zum Effekt von Methadon in der Behandlung von Patienten mit histologisch gesicherten, chemorefraktären kolorektalen Karzinomen konzipiert. Allerdings wurde sie nach Auskunft von Seufferlein noch nicht zur Förderung eingereicht, da Vordaten fehlten. Ungeachtet dessen ist Seufferlein davon überzeugt, dass Daten aus prospektiven randomisierten kontrollierten Studien bei unterschiedlichen Tumorentitäten notwendig sind, um das potenzielle antitumorale Potenzial von Methadon beurteilen zu können.
Stellungnahmen von Fachgesellschaften
Fachgesellschaften äußerten sich zu den bislang bekannten Daten zurückhaltend. So ist etwa in einer gemeinsamen Stellungnahme der Medizinischen Fakultät der Universität Ulm, des Universitätsklinikums Ulm und des Comprehensive Cancer Center Ulm zur Tumortherapie mit Methadon zu lesen: „Die wissenschaftlichen Erkenntnisse, die von der Arbeitsgruppe der Molekularbiologin Frau Dr. Friesen am Institut für Rechtsmedizin der Universität Ulm erhoben wurden, beziehen sich ausschließlich auf vorklinische Experimente entweder mit Zellkulturen oder tierexperimentelle Studien. Diese Daten lassen sich nicht automatisch auf die Situation beim Patienten übertragen. Es gibt zahlreiche interessante wissenschaftliche Konzepte zur Verstärkung der Wirkung von Chemotherapie oder zur Resensitivierung von Tumoren gegenüber chemotherapeutischen Protokollen. Viele dieser Konzepte zeigen leider beim Einsatz am Patienten nicht den gewünschten Effekt. Um die Wirksamkeit eines solchen Konzeptes, wie des Einsatzes von Methadon zur Therapie von Tumoren, zu beurteilen, ist es daher unbedingt notwendig, prospektive, kontrollierte, randomisierte Studien bei Patienten durchzuführen.
In dem oben zitierten Beitrag [Anmerkung: Bezug auf den Beitrag vom 17.08.2016 auf Tagesschau24] wird von 80 erfolgreich behandelten Patienten berichtet. Uns ist wichtig festzustellen, dass diese Patienten nicht am Universitätsklinikum Ulm und nicht im Rahmen von klinischen Studien behandelt wurden, sondern Methadon entweder als Schmerztherapeutikum bei Tumorschmerzen oder im Rahmen eines ‚Off-label‘-Einsatzes des Medikaments erhielten. Die Angaben zum Erfolg der Behandlung beruhen nicht auf wissenschaftlichen Publikationen und sind für uns nicht überprüfbar. Es lässt sich daher nicht beurteilen, ob bei diesen Patienten ein möglicher Therapieerfolg aufgrund der Einnahme von Methadon eingetreten ist. Daher halten wir den unkritischen Einsatz von Methadon außerhalb klinischer Studien für nicht gerechtfertigt [...].“
Eine ähnliche Aussage findet sich in einer gemeinsamen Stellungnahme der Neuroonkologischen Arbeitsgemeinschaft in der Deutschen Krebsgesellschaft (NOA) und der Deutschen Gesellschaft für Neurologie (DGN).
Tipps für die Praxis
Substitutions- versus Schmerztherapie: Methadon kann im Rahmen der Substitutionstherapie oder der Schmerzbehandlung verordnet werden. Wird es im Rahmen der Schmerzbehandlung verordnet, gelten die Regeln für eine normale BtM-Verordnung, nicht die Regeln der Substitutionsverordnung.
Off-label-Verordnung. Verordnen Ärzten ihren Tumorpatienten Methadon nicht zur Schmerzbehandlung, sondern zur Tumorbekämpfung, dann erfolgt diese Therapie off label unter der Verantwortung des Arztes. Der Apotheker muss jedoch bei Rezeptvorlage die Indikation nicht hinterfragen.
Verluste bei der Herstellung. Bei der Herstellung, Verarbeitung und Portionierung der Methadonlösung kann mit einem Schwund von bis zu 3% gerechnet werden. Höhere Verluste müssen dokumentiert und begründet werden (s. Kommentar „Keine Angst vor BtM-Rezepten“)
Rezepturbesonderheiten. Anders als bei der Herstellung von Methadon zur Substitutionstherapie kann bei Rezepturen zur Schmerzbehandlung auf eine Viskositätserhöhung verzichtet werden (s. NRF-Rezeptur Methadon HCl 1%-Lösung zur Schmerztherapie).
L-Polamidon – eine Alternative? Für die antineoplastische Wirkung von Methadon muss Methadon als Racemat vorliegen. Levomethadon (L-Polamidon) ist keine Alternative.
Methaliq® – eine Alternative? Ist Methadon als Rezeptur verordnet, ist die Abgabe eines Fertigarzneimittels nicht zulässig. Zudem ist Methaliq® nur für die Substitutionstherapie zugelassen.
Übrigens: Für die Apotheke besteht auch bei Vorlage einer BtM-Rezeptur Kontrahierungszwang. Für BtM ist der Versand nicht erlaubt. |
Literatur
Güthle, M. et al.: Eine Phase I/II-Studie zur Therapie mit D,L-Methadon in der Behandlung von Patienten mit histologisch gesicherten chemorefraktären kolorektalen Karzinomen, Z Gastroenterol 2015;53-KG214, DOI:10.1055/s-0035-1559240.
Friesen, C. et al.: Methadone, commonly used as maintenance medication for outpatient treatment of opioid dependance, kills leukemia cells and overcomes chemoresistance. Cancer Research 2008,68,6059-6064.
Friesen, C. et al.: Cell death sensitization of leukemia cells by opioid receptor activation. Oncotarget 2013,4,655-690.
Friesen, C. et al.: Opioidrezeptoraktivierung verstärkt Effektivität von Chemotherapeutika. Ärztliches Journal Onkologie 2013,4,26-27.
Friesen, C. et al.: Opioid receptor activation triggering downregulation of cAMP improves effectiveness of anti-cancer drugs in treatment of glioblastoma. Cell Cycle 2014,13(10),1560–1570.
Onken J et a. Safety and Tolerance of D,L-Methadone in Combination with Chemotherapy in Patients with Glioma. Anticancer Research 2017;37:1227-1236.
Riemer T et al. Methadon und Levomethadon – Dosierung und Nebenwirkungen. Psychiat Prax 2014;41(02):82-87;DOI:10.1055/s-0033-1349627.
Deutsche Krebshilfe: Methadon: Allroundtalent gegen Hirntumoren, Pressemitteilung vom 30.09.2014.
Kneifel G. Methadon: Ein verkanntes Analgetikum – vielleicht sogar mit Anti-Tumor-Wirkung? Veröffentlicht auf medscape am 15.03. 2016. http://deutsch.medscape.com/artikelansicht/4904685#vp_1
Gemeinsame Stellungnahme der Neuroonkologischen Arbeitsgemeinschaft in der Deutschen Krebsgesellschaft (NOA) und der Deutschen Gesellschaft für Neurologie (DGN), vom 26. 3. 2015: Gliomtherapie mit Methadon: bisher nur experimentell getestet – Wirkung beim Menschen völlig unklar. http://www.dgn.org/images/red_pressemitteilungen/2015/150326_Stellungnahme_NOA_DGN_Methadon_bei_Glioblastom_final.pdf)
Stellungnahme zur Tumortherapie mit Methadon; vom 23.08.2016. http://www.uniklinik-ulm.de/news/article/1119/stellungnahme-zur-tumortherapie-mit-methadon-1.html
https://www.tagesschau.de/inland/krebstherapie-methadon-101.html (17.08.2016)
http://www.br.de/mediathek/video/sendungen/nachrichten/methadon-krebsmittel-klinikum-ulm-100.html (19.08.2016)
https://www.ndr.de/ratgeber/gesundheit/Methadon-gegen-Krebs-Kaum-Nebenwirkungen,methadon132.html (11.04.2017)
Lesen Sie hierzu auch folgende Artikel in dieser DAZ:























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.