
- DAZ.online
- DAZ / AZ
- DAZ 48/2016
- Für eine Welt ohne AIDS
Infektiologie
Für eine Welt ohne AIDS
„BIS 2030“: Traum oder realistisches Ziel?
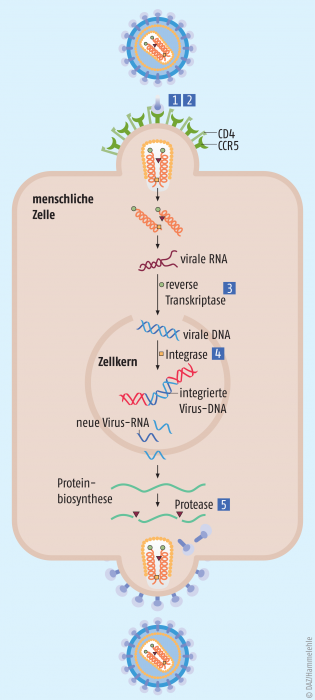
Als im Jahr 1981 die ersten AIDS-Fälle beschrieben wurden, war das HI-Virus noch unbekannt. Die Häufung von Kaposi-Sarkomen und Fällen von Pneumocystis-Pneumonien – Indikatorerkrankungen für Immundefekte – bei ansonsten gesunden jungen Männern war rätselhaft. Zwei Jahre später gelang den beiden französischen Forschern Françoise Barré-Sinoussi und Luc Montagnier die Entdeckung von HIV als auslösenden Erreger; 2008 erhielten sie dafür den Medizin-Nobelpreis. Den ersten AIDS-Patienten konnte niemand helfen. Sie verstarben bereits kurze Zeit nach Ausbruch ihrer Erkrankung an opportunistischen Infektionen. Nur 29 Jahre nach Zulassung des ersten antiretroviralen Medikaments (1987: Zidovudin, Retrovir®) steht eine breite und stetig wachsende Palette an effektiven antiretroviralen Wirkstoffen zur Verfügung. Bei konsequenter lebenslanger Behandlung und engmaschiger medizinischer Betreuung (Menschen mit HIV haben ein deutlich erhöhtes Risiko für Krebs-, Herz- und Gefäßkrankheiten) lässt sich die Erkrankung heute in ein chronisches Stadium überführen, sodass HIV-Patienten annähernd die Lebenserwartung nicht infizierter Menschen erreichen können.
Wirkstoffe |
Mono- und Kombipräparate |
Unternehmen |
|---|---|---|
Nukleosidische Reverse-Transkriptase-Inhibitoren (NRTI) | ||
Abacavir |
Ziagen®, Kivexa®, Trizivir®,Triumeq®
|
ViiV Healthcare |
Didanosin |
Videx®
|
Bristol-Myers Squibb |
Emtricitabin |
Emtriva®, Descovy®, Atripla®, Truvada®, Eviplera®, Odefsey®, Stribild®, Genvoya®
|
Gilead Sciences (Atripla® zusammen mit Bristol-Myers Squibb)
|
Lamivudin |
Epivir®, Kivexa®, Combivir®, Trizivir®, Triumeq®
|
ViiV Healthcare |
Stavudin |
Zerit®
|
Bristol-Myers Squibb |
Zidovudin |
Retrovir®, Combivir®, Trizivir®
|
ViiV Healthcare |
Nukleotid-analoge Reverse-Transkriptase-Inhibitoren (NTRTI) | ||
Tenofovirdisoproxil |
Viread®, Atripla®, Truvada®, Eviplera®, Stribild®
|
Gilead Sciences (Atripla® zusammen mit Bristol-Myers Squibb)
|
Tenofoviralafenamid |
Descovy®, Odefsey®, Genvoya®
|
Gilead Sciences |
Nicht-nukleosidische Reverse-Transkriptase-Inhibitoren (NNRTI) | ||
Efavirenz |
Sustiva®, Atripla®
|
Bristol-Myers Squibb
(Atripla® zusammen mit Gilead Sciences)
|
Etravirin |
Intelence®
|
Janssen |
Nevirapin |
Viramune®
|
Boehringer Ingelheim |
Rilpivirin |
Edurant®
Eviplera®, Odefsey®
|
Janssen
Gilead Sciences
|
HIV-Proteasehemmer (PI) | ||
Atazanavir |
Reyataz®
|
Bristol-Myers Squibb |
Darunavir |
Prezista®
|
Janssen |
Fosamprenavir |
Telzir®
|
ViiV Healthcare |
Indinavir |
Crixivan®
|
MSD |
Lopinavir |
Kaletra®
|
AbbVie |
Nelfinavir |
Viracept®
|
Roche |
Ritonavir |
Norvir®
Kaletra®
|
AbbVieAbbVie |
Saquinavir |
Invirase®
|
Roche |
Tipranavir |
Aptivus®
|
Boehringer Ingelheim |
Integraseinhibitoren (INI) | ||
Raltegravir |
Isentress®
|
MSD |
Elvitegravir |
Stribild®, Genvoya®
|
Gilead Sciences |
Dolutegravir |
Tivicay®, Triumeq®
|
ViiV Healthcare |
Entry-Inhibitoren (EI): Fusionsinhibitoren | ||
Enfuvirtid |
Fuzeon®
|
Roche |
Entry-Inhibitoren (EI): CCR5-Antagonisten | ||
Maraviroc |
Celsentri®
|
ViiV Healthcare |
Booster (CYP-Hemmer) | ||
Cobicistat |
Tybost®, Stribild®, Genvoya®
|
Gilead Sciences |
Status quo in der Behandlung
Einen Überblick über die derzeit zugelassenen Wirkstoffe und Arzneimittel gibt die Tabelle 1. Zahlreiche weitere Substanzen befinden sich derzeit in der klinischen Prüfung (Tab. 2). Relativ weit fortgeschritten sind Attachment-Inhibitoren, die die Bindung des HI-Virus über sein extrazelluläres Glykoprotein (gp120) an den CD4-Rezeptor blockieren. Maturations-Inhibitoren dagegen unterbinden den letzten Schritt der Virusreifung, sodass es zur Freisetzung unreifer, nicht infektiöser HIV-Partikel kommt.
Wirkstoff |
Wirkstoffklasse |
Status |
Unternehmen |
|---|---|---|---|
Ibalizumab (TNX-355, Hu-5A8) |
monoklonaler Antikörper, vermutlich Entry-Inhibitor |
Phase III |
TaiMed Biologics (Taiwan), Theratechnologies (Canada) |
Apricitabine |
Nukleosidischer Reverse-Transkriptase-Inhibitor |
Phase III |
Avexa |
PRO-140 (PA-14) |
monoklonaler Antikörper, anti-CCR5 |
Phase III |
CytoDyn (USA) |
Albuvirtid |
Fusions-Inhibitor
(GP41-Antagonist)
|
Phase III |
Frontier Biotechnologies (China) |
VM-1500 in oraler Formulierung |
Nicht-nukleosidischer Reverse-Transkriptase-Inhibitor |
Phase III |
Viriom (Russland) |
Fostemsavir |
Attachment-Inhibitor;
oral, Prodrug zu Temsavir
|
Phase III |
GlaxoSmithKline/ViiV Healthcare |
Doravirine |
Nicht-nukleosidischer Reverse-Transkriptase-Inhibitor |
Phase III |
MSD |
|
Bictegravir
(in fixer Kombination mit Emtricitabin und Tenofoviralafenamid)
|
Integrase-Hemmer (nicht geboostet) |
Phase III (als Monopräparat in Phase II) |
Gilead Sciences |
BMS-955176 |
Maturations-Inhibitor |
Phase IIb |
GlaxoSmithKline/ViiV Healthcare |
Derzeit befindet sich kein HIV-Medikament im Zulassungsverfahren. In der Tabelle nicht enthalten: Medikamente mit neuen Fixkombinationen auf Basis bekannter Wirkstoffe. | |||
Eine HIV-Monotherapie hatte in der Vergangenheit eine rasche Resistenzentwicklung und damit ein Therapieversagen zur Folge. Daher ermöglichte die Einführung der HIV-Kombinationstherapie (Highly Active Antiretroviral Therapy, HAART) Mitte der 1990er Jahre eine deutlich effektivere Behandlung. Heute bestehen die Standard-Therapieschemata aus drei nukleosidischen Reverse-Transkriptase-Inhibitoren (NRTI) oder jeweils zwei NRTI, kombiniert mit einem nichtnukleosidischen Reverse-Transkriptase-Inhibitor (NNRTI), einem Proteaseinhibitor (PI) oder einem Integrase-Inhibitor (INI). CYP3A4-Hemmstoffe wie Ritonavir (z. B. in Kaletra®) oder Cobicistat (z. B. in Stribild®, Genvoya®) verstärken die Wirkung, indem sie den Abbau der Substanzen durch CYP3A4 hemmen. Die Entwicklung fixer Kombinationen aus zwei oder drei antiretroviralen Wirkstoffen (plus ggf. einem Booster-Wirkstoff) hat einen wichtigen Beitrag zur Förderung der Adhärenz geleistet.
Therapiebeginn: sofort starten oder abwarten?
Zur HIV-Therapie existiert eine Vielzahl nationaler und internationaler Leitlinien, die in kurzen Zeitabständen aktualisiert werden. Die aktuellsten Empfehlungen enthält die im Juli dieses Jahres publizierte Leitlinie der IAS-USA (International Antiviral Society–USA Panel). Diese basieren auf den Ergebnissen der START-Studie, die gezeigt hatte, dass sich das Erkrankungsrisiko bei sehr frühem Therapiebeginn (noch > 500 CD4-Zellen/µl Blut) verringern lässt im Vergleich mit Patienten, bei denen erst später (< 350 CD4-Zellen/µl) begonnen wird. Daher plädiert die IAS-USA-Leitlinie für einen sofortigen Beginn der antiretroviralen Therapie bei nachgewiesener Virämie, auch bei asymptomatischen Patienten und unabhängig von der Zahl der noch vorhandenen CD4-Zellen. Dagegen empfehlen deutsche und europäische Leitlinien gegenwärtig (noch), den Therapiestart von der CD4-Zellzahl, AIDS-assoziierten Symptomen und Zusatzkriterien abhängig zu machen.
Was bringt eine medikamentöse Prophylaxe?
Eine Prophylaxe der HIV-Infektion ist heute sowohl prä- als auch postexpositionell möglich. Das erste Medikament zur HIV-Präexpositionsprophylaxe (PrEP) wurde 2012 in den USA zugelassen. Es handelt sich dabei um die Kombination aus Emtricitabin und Tenofovirdisoproxilfumarat, die als Truvada® bereits seit einigen Jahren zur antiretroviralen Therapie auf dem Markt ist (in Europa seit 2005). Seit August 2016 ist Truvada® auch in Europa zur PrEP zugelassen, darüber hinaus in Australien, Kanada, Kenia, Peru und Südafrika. Die PrEP soll nichtinfizierte Menschen mit hohem Risikoprofil in Kombination mit Safer Sex vor einer Infektion schützen.
Eine weitere Option zur HIV-Präexpositionsprophylaxe ist ein Dapivirin-freisetzender Vaginalring. Er wurde bereits in Studien mit afrikanischen Frauen getestet, die einem hohen Risiko einer potenziellen HIV-Infektion ausgesetzt sind. Er muss regelmäßig getragen und alle vier Wochen ausgetauscht werden. Kritiker der PrEP befürchten, dass damit allgemeine und wirksame Schutzmaßnahmen wie Kondome vernachlässigt werden. Kondome können das Risiko einer HIV-Übertragung um 95% reduzieren.
Konsequente Behandlung bietet Schutz
Die PrEP könnte beispielsweise für serodiskordante Paare (ein Partner HIV-negativ, der andere HIV-positiv), die auf Kondome verzichten möchten, von Interesse sein. Jedoch haben beispielsweise die vielbeachteten Zwischenergebnisse der PARTNER-Studie gezeigt, dass bei konsequenter antiretroviraler Therapie HIV-Infizierter das Infektionsrisiko für deren nicht infizierte Partner bei kondomlosem Sex sehr gering ist. In dieser Untersuchung wurde während der Follow-up-Phase von 1,3 Jahren keine Virusübertragung vom HIV-positiven, behandelten Partner mit einer Viruslast unter 200 RNA-Kopien pro Milliliter Serum auf den HIV-negativen Partner festgestellt – sowohl bei homo- als auch bei heterosexuellen Partnerschaften. Ob sich diese Ergebnisse bestätigen lassen, müssen weitere Untersuchungen zeigen.
Kostengünstigere Therapien durch Generika
Bei der Entscheidung für eine PrEP müssen außerdem die Notwendigkeit der Dauermedikation sowie die hohen Kosten des Medikaments von etwa 800 Euro monatlich bedacht werden. Diese könnten sich jedoch in naher Zukunft durch die Zulassung von Generika verringern. Für ein Truvada®-Generikum hat der Humanarzneimittelausschuss der EMA bereits ein positives Votum erteilt, das jedoch noch nicht für die HIV-Prophylaxe gilt. Da zahlreiche weitere HIV-Therapeutika in naher Zukunft ihren Patentschutz verlieren und nach und nach Generika auf den Markt kommen werden, ist eine Reduktion der Therapiekosten zu erwarten.
Notfallmaßnahme PEP
Eine Postexpositionsprophylaxe (PEP) sollte innerhalb von 24 Stunden, idealerweise jedoch bereits zwei Stunden nach einer beruflichen (z. B. Verletzung mit HIV-kontaminierten Instrumenten bzw. Injektionsbestecken), nicht beruflichen (z. B. ungeschütztem Geschlechtsverkehr mit einer HIV-infizierten Person) oder anderweitigen (z. B. Transfusion von HIV-kontaminiertem Blut oder Blutprodukten) eingeleitet werden. Für einen raschen Zugang zur dieser Behandlung bietet die Deutsche AIDS-Hilfe auf ihrer Website eine Liste mit Kliniken an, die rund um die Uhr eine Beratung leisten und eine HIV-PEP anbieten können. Der Schutzeffekt einer PEP wird auf ca. 80% geschätzt. Als Standard werden Raltegravir (Isentress®, zweimal täglich eine Tablette) in Kombination mit Tenofovir plus Emtricitabin (Truvada®, einmal täglich eine Tablette) empfohlen. Als Alternative zu Raltegravir kann Lopinavir eingesetzt werden.
Globale Ausbreitung der HIV-Epidemie
Aktuelle Zahlen zur globalen Inzidenz, Prävalenz und Mortalität von HIV/AIDS finden sich im Global AIDS Update 2016 der UNAIDS sowie in den Aktualisierungen der Global Burden of Disease-Studie, die alle zwei Jahre erscheinen. Nach dieser Erhebung war 1997 das Jahr mit rund 3,3 Mio. Neuinfektionen mit der bisher höchsten HIV-Inzidenz. Zwischen 1997 und 2005 sank die Inzidenzrate und liegt seitdem relativ konstant bei 2,6 Mio. pro Jahr. In einigen Regionen stieg die Neuinfektionsrate jedoch wieder. Die Zahl der HIV-Infizierten bzw. an AIDS Erkrankten wurde 2015 auf 38,8 Mio. beziffert. Zur gleichen Zeit reduzierte sich die Mortalitätsrate von 1,8 Mio. Todesfällen in 2005 auf 1,2 Mio. in 2015. Das GLOBAL AIDS Update 2016 der UNAIDS, das Daten in 160 Ländern erhoben hat, beschreibt unter anderem die große Heterogenität in der AIDS-Morbidität und -Mortalität. Von den in dieser Erhebung genannten 36,7 Mio. HIV-Infizierten weltweit leben die meisten (19 Mio.) in ost- und südafrikanischen Ländern, dagegen in West-und Zentraleuropa sowie Nordamerika nur 2,4 Millionen.
Die Zahl der HIV-Neuinfektionen in Deutschland wird in jedem Jahr vom RKI geschätzt. Nach den Mitte November 2016 veröffentlichten Zahlen lebten Ende 2015 rund 84.700 Menschen in Deutschland mit HIV. Etwa 3200 Menschen haben sich neu mit HIV-infiziert, die Zahl ist gegenüber den Vorjahren unverändert. Unter den geschätzt 84.700 HIV-Positiven sind etwa 11.750 Personen mit einer Herkunft aus dem Ausland, die sich auch im Ausland mit HIV infiziert haben. Diese geschätzten Zahlen sind nicht zu verwechseln mit den an das RKI gemeldeten HIV-Neudiagnosen.
Zugang zur Behandlung muss verbessert werden
Der Anteil der HIV-Infizierten, die antiretroviral behandelt werden, hat sich in den letzten Jahren deutlich erhöht, insbesondere in den am meisten betroffenen Regionen. So stieg er beispielsweise in den ost- und südafrikanischen Ländern von 24% in 2010 auf 54% in 2015. Die größten Behandlungsprogramme finden sich derzeit in Südafrika und Kenia. Dennoch haben derzeit weltweit über 21 Mio. Menschen, die mit HIV leben, keinen Zugang zu antiretroviralen Medikamenten. Damit wurden die im September 2000 auf einem Gipfeltreffen der Vereinten Nationen in der sogenannten Milleniumserklärung verabschiedeten Entwicklungsziele weit verfehlt. Als eines dieser acht Ziele (Millennium Development Goals, MDGs) war die Bekämpfung von HIV/AIDS, Malaria und anderen schweren Krankheiten formuliert worden. Die Zielvorgaben besagten, die Ausbreitung von HIV/AIDS bis 2015 zum Stillstand zu bringen und allmählich umzukehren. Bis zum Jahr 2010 sollten alle Behandlungsbedürftigen Zugang zu den notwendigen Medikamenten erhalten.
Hilfe kommt nur unzureichend an
Das größte Hemmnis bei der Eliminierung der HIV-Epidemie ist also nicht der Mangel an Therapieoptionen, sondern der für viele Patienten beschränkte Zugang zu ihnen. Selbst in gut ausgestatteten Gesundheitssystemen ist die Versorgung nicht optimal. Beispielsweise erzielten von den 1,2 Mio. HIV-Infizierten in den USA im Jahre 2011 nur knapp 30% eine Virussuppression, das heißt eine Viruslast unter der Nachweisgrenze von ca. 50 RNA-Kopien/ml. In Deutschland erfolgt die HIV-Diagnose bei einem Drittel der Betroffenen erst in einem späten Stadium. Knapp 15% der infizierten Menschen in Deutschland wissen nichts von ihrer Infektion, in den USA wird dieser Anteil auf 14% geschätzt. Expertengremien wie die US Preventive Services Task Force (USPSTF) sprechen sich daher für ein routinemäßiges HIV-Screening für alle Menschen zwischen 15 und 65 Jahren sowie außerdem für Hochrisikogruppen außerhalb dieser Altersgrenzen aus. Große Hoffnung setzt man auch auf HIV-Impfstoffe. Derzeit befinden sich acht in der klinischen Entwicklung.
Mikrobiologische Eradikation ist nicht das Ziel
Das AIDS-Projekt der Vereinten Nationen (UNAIDS) hat mit der 95-95-95-Strategie ambitionierte Ziele formuliert, um die HIV-Epidemie bis zum Jahr 2030 zu besiegen. Lesen Sie dazu im nachfolgenden Interview die Einschätzung von Dr. med. Annette Haberl vom HIVCENTER am Universitätsklinikum Frankfurt (siehe S. 73).
Preeti N. Malani, Professorin an der University of Michigan (USA), hält in einem Meinungsbeitrag in der amerikanischen Fachzeitschrift JAMA ein Ende der HIV-Epidemie für möglich, aber nicht im Sinne einer mikrobiologischen Eradikation. Es könnte erreicht werden, indem systematisch getestet wird, die positiv Getesteten eine effektive Behandlung erhalten und Anstrengungen unternommen werden, dass sie in der Therapie verbleiben. Auch Präventionsmaßnahmen einschließlich PrEP hält sie für außerordentlich wichtig. In jedem Fall müsste zunächst dafür gesorgt werden, dass die verfügbaren Mittel auch diejenigen erreichen, die bisher nicht davon profitieren konnten.
Was es zu HIV-Heimtests zu sagen gibt
rr | Im Internet werden HIV-Tests für den Hausgebrauch angeboten, die ein schnelles Ergebnis innerhalb von Minuten versprechen. Grundsätzlich dürfen HIV-Tests in Deutschland laut Medizinprodukte-Abgabeverordnung nicht an Privatpersonen abgegeben werden, deshalb sitzen die Anbieter in der Regel im Ausland. Allerdings macht man sich nicht strafbar, wenn man welche für den Eigengebrauch im Internet bestellt. Einige Anbieter werben mit einer CE-Zertifizierung, die lediglich garantiert, dass der Test die europäischen Mindeststandards für Genauigkeit und Benutzerfreundlichkeit erfüllt, jedoch nicht aussagt, wie zuverlässig dieser Test ist. Urintests sind grundsätzlich nicht aussagekräftig, da im Urin zu wenig HIV-Antikörper sind. Die Bundeszentrale für gesundheitliche Aufklärung und das Robert Koch-Institut warnen vor den Risiken, die HIV-Heimtests mit sich bringen: Die fehlerhafte Anwendung kann zu falschen Ergebnissen führen. Zudem fehlt die fachliche Betreuung vor bzw. nach dem Test, die vor allem bei einem positiven Ergebnis dringend erforderlich ist. HIV-Tests sollten deshalb grundsätzlich nur unter ärztlicher Anleitung und mit persönlicher Beratung stattfinden.
Quelle: FAQ zum HIV-Heimtest, Deutsche AIDS-Hilfe
Maßnahmen der BIS 2030-Strategie
Die Bundesregierung hat nach eigenen Angaben erfolgreich die Grundlagen dafür gelegt, dass sich die HIV-Infektionen in Deutschland auf einem niedrigen Niveau befinden. Durch ihr internationales Engagement will sie auch weiterhin dazu beitragen, die HIV-Neuinfektionen weltweit zu senken. Zu den Maßnahmen, die in der BIS 2030-Strategie festgeschrieben wurden, zählen beispielsweise die Finanzierung von Fonds für HIV-Behandlungsprogramme, die Unterstützung von Entwicklungsländern beim Aufbau lokaler Pharmaindustrien über Treuhandprogramme der Vereinten Nationen (UNIDO und UNCTAD) sowie Maßnahmen zur Förderung der HIV-Forschung. |
Quellen
BIS 2030 – Strategie zur Eindämmung von HIV, Hepatitis B und C und anderen sexuell übertragbaren Infektionen. Erstellt durch das Bundesministerium für Gesundheit und das Bundesministerium für wirtschaftliche Zusammenarbeit und Entwicklung, 1. Auflage 2016
Schätzung der Zahl der HIV-Neuinfektionen und der Gesamtzahl von Menschen mit HIV in Deutschland. Epidemiologisches Bulletin vom 14. November 2016; doi: 10.17886/EpiBull-2016-066
Rockstroh JK. Behandlung von HIV-Infektionen und AIDS. Drug Res 2016;66(1):S15-S16
Lundgren JD, et al. ( INSIGHT START Study Group) Initiation of antiretroviral therapy in early asymptomatic HIV infection. N Engl J Med 2015;373(9):795-807
Deutsch-Österreichische Leitlinien zur antiretroviralen Therapie der HIV-Infektion (Klassifikation: S2k), AWMF-Register-Nr.: 055-001, Version 1.0 vom 13.5.2014 (in Überarbeitung), gültig bis 05/2019
Deutsch-Österreichische Leitlinie zur Postexpositionellen Prophylaxe der HIV-Infektion (Klassifikation: S2k), AWMF-Register-Nr.: 055/004, Stand: 31.05.2013, gültig bis 31.12.2017
Leitlinie der European AIDS Clinical Society (EACS), Version 8.0 (Oktober 2015)
Malani PN. Visions for an AIDS-free generation. Red ribbons of hope. JAMA 2016;316(2):154–155
Wang H, et al. (GBD 2015 HIV Collaborators): Estimates of global, regional, and national incidence, prevalence, and mortality of HIV, 1980–2015: the Global Burden of Disease Study 2015. Lancet HIV 2016;3: e361–87; doi: 10.1016/S2352-3018(16)30087-X
http://unmillenniumproject.org/goals/
HIV-Therapeutika – Grundlagen und Arzneistoffe Pharmakon. Arzneimittel in Wissenschaft und Praxis, 2. Jg., 4/2014, GOVI-Verlag
HIV-Therapeutika – Klinische Anwendung. Pharmakon. Arzneimittel in Wissenschaft und Praxis, 2. Jg., 5/2014, GOVI-Verlag
www.rote-liste.de, Stand 21. September 2016
Noch keine HIV-Präexpositionsprophylaxe für deutsche Patienten. DAZ.online, Meldung vom 25. August 2016
European Commission grants marketing authorization for Gilead’s Once-Daily Truvada® for reducing the risk of sexually acquired HIV-1. Pressemitteilung der Firma GILEAD vom 22. August 2016, www.gilead.com
Postexpositionsprophylaxe: https://aidshilfe.beranet.info/info/postexpositionsprophylaxe.html
90–90–90—an ambitious treatment target to help end the AIDS epidemic. publiziert am 8. Oktober 2014, http://www.unaids.org/en/resources/documents/2014/90-90-90 (Abruf am 21. September 2016)
Rodger AM, et al. Sexual activity without condoms and risk of HIV transmission in serodifferent couples when the HIV-positive partner is using suppressive antiretroviral therapy. JAMA 2016;316(2):171–181
Daar ES, Corado K. Condomless Sex with virologicallysuppressed HIV-infected individuals. How safe is it? JAMA 2016;316(2):149–150
Mayer KH, Krakower DS. Antiretrovirals for HIV treatment and prevention. The challenges of success. JAMA 2016;316(2):151–153
http://www.unaids.org/en/resources/documents/2016/Global-AIDS-update-2016 (Abruf am 26.9.2016)
HIV Screening. Hrsg. von der US Preventive Services Task Force (USPSTF), Stand 30. April 2013
Günthard HF, et al. Antiretroviral drugs for treatment and prevention of HIV infection in adults. 2016 Recommendations of the International Antiviral Society–USA Panel. JAMA 2016;316(2):191–210
Fauci AS. An HIV Vaccine. Mapping uncharted territory. JAMA 2016;316(2):143–144
Friedland G. Marking Time in the Global HIV/AIDS Pandemic. JAMA 2016;316(2):145–146
Steinbrook R. HIV/AIDS in 2016 and Beyond. JAMA 2016;316(11):1139–1140
Welt-AIDS-Konferenz 2016 in Südafrika. Meldung unter http://www.vfa-bio.de/vb-de/aktuelle-themen/forschung/welt-aids-konferenz-2016-in-suedafrika.html#comment6 (Abruf am 28.9.2016)
Das könnte Sie auch interessieren:
Ist AIDS bald Geschichte? Eine (gute) Frage zum Welt-AIDS-Tag. Interview mit Dr. Annette Haberl vom HIVCENTER am Universitätsklinikum Frankfurt
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.