
- DAZ.online
- DAZ / AZ
- DAZ 45/2016
- Die Schwindsucht will ...
Infektiologie
Die Schwindsucht will nicht schwinden
Warum eine Tuberkulose-Eradikation so schwierig ist
Die Entdeckung des stäbchenförmigen Bakteriums Mycobacterium tuberculosis gelang 1882 dem Bakteriologen Robert Koch, 1905 erhielt er dafür den Nobelpreis für Medizin. Die Übertragung dieses bzw. eines anderen zum M.-tuberculosis-Komplex gehörenden Erregers erfolgt über Tröpfchen in der Atemluft. Voraussetzung dafür ist ein enger und mehrstündiger Kontakt mit einem Erkrankten mit offener Lungentuberkulose. Menschen mit schwacher Immunkompetenz sind besonders leicht infizierbar. Deshalb erhöht eine HIV-Infektion sowohl die Ansteckungsgefahr als auch die Aktivierung einer latenten Tuberkulose. Weltweit sind derzeit ca. 11% der neu diagnostizierten Tuberkulose-Patienten HIV-positiv. Unter AIDS-Patienten ist die Tuberkulose die häufigste Todesursache. Während bei der offenen Lungen-Tuberkulose die Erreger im Sputum nachweisbar sind, ist dies bei latenter Erkrankung nicht der Fall. Diese Patienten sind auch nicht ansteckend, da die Mykobakterien in Makrophagen verkapselt und von Abwehrzellen umgeben sind. Ein Haut- oder Bluttest ist bei diesen Menschen positiv. Je nach Immunstatus kann eine latente Erkrankung auch Jahrzehnte nach der Infektion noch ausbrechen. Außer der Lunge können beispielsweise die Haut, die Lymphknoten oder mehrere Organe gleichzeitig (Miliartuberkulose) betroffen sein.
Unspezifische Symptome erschweren Diagnose
Eine Tuberkulose entwickelt sich langsam (Inkubationszeit sechs bis acht Wochen), und die ersten Symptome wie hartnäckiger Husten und leichtes Fieber sind relativ unspezifisch. Weitere hinweisende Beschwerden sind starke Abgeschlagenheit, Nachtschweiß und eine Gewichtsabnahme von mehr als 10% im Laufe eines halben Jahres. Da die Erkrankung in Deutschland relativ selten (Inzidenz 7/100.000 Einwohner) auftritt, sind Ärzte meistens gering sensibilisiert. An Tuberkulose sollte insbesondere auch gedacht werden, wenn die beschriebenen Symptome einige Zeit nach Rückkehr von einer Fernreise auftreten. Durch gezielte Fragen im Beratungsgespräch können auch Apotheker dazu beitragen, die Diagnosestellung zu beschleunigen. Unter einer Therapie mit monoklonalen TNF-alpha-Antikörpern (Infliximab, Adalimumab) besteht das Risiko für die Aktivierung einer latenten Tuberkulose. Deshalb sind vor Therapiebeginn entsprechende Tests vorgeschrieben.
Ansteckungsgefahr gering eingeschätzt
Durch den Zustrom von Flüchtlingen ist bei vielen Menschen in Deutschland die Sorge gewachsen, dass Infektionskrankheiten, die bei uns an Bedeutung verloren haben, wieder verstärkt auftreten könnten – darunter auch die Tuberkulose. Da die Übertragung in Gemeinschaftsunterkünften tatsächlich eine Gefahr darstellen kann, schreibt das Infektionsschutzgesetz bei allen Asylsuchenden über 15 Jahren (mit Ausnahme von Schwangeren) vor der Aufnahme in die Einrichtung eine Röntgenuntersuchung vor. Menschen mit offener Lungentuberkulose können dadurch identifiziert, isoliert und einer Behandlung zugeführt werden. Das Ansteckungsrisiko für Tuberkulose in der Allgemeinbevölkerung schätzt das Robert Koch-Institut in Berlin (RKI) als sehr gering ein. Der Anstieg der Fallzahlen in Deutschland wird auch auf die umfangreichen Kontrolluntersuchungen der Gesundheitsämter zurückgeführt. In Deutschland sind die Fallzahlen durch die Migration von Menschen aus Ländern mit hoher Tuberkulose-Inzidenz von 2014 auf 2015 um circa 30% gestiegen.
Status quo in der Behandlung
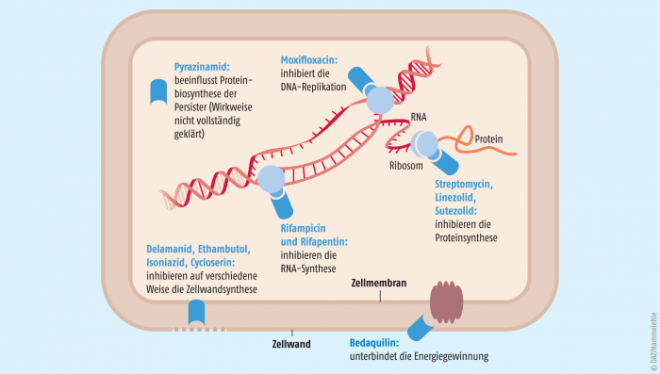
Die Behandlung der Tuberkulose erfolgt heute ausschließlich mit einer Kombinationstherapie von mindestens vier Arzneimittel unterschiedlicher Angriffsorte und Wirkprinzipien. Dadurch können die Erreger auf unterschiedlichen Vermehrungsstufen gestoppt bzw. abgetötet und der Selektion resistenter Keime vorgebeugt werden (siehe Abbildung 1). Die Behandlung soll durchgängig über mindestens sechs Monate erfolgen. Eine intermittierende Behandlung wird in Deutschland nicht empfohlen. Patienten, deren Erreger gegen alle vier Erstrang-Arzneimittel (siehe Tabelle 1) sensibel sind, behandelt man zunächst zwei Monate lang (Initialphase) mit einer Kombinationstherapie aus diesen vier Wirkstoffen (in einigen Fällen, z. B. bei Kindern, nur drei). Daran schließt sich eine viermonatige Stabilisierungsphase mit zwei Wirkstoffen (Rifampicin und Isoniazid) an. Die Arzneimittel sollen morgens zusammen in einer Dosis eingenommen werden, da dann die beste Resorption erwartet werden kann. Zur Erhöhung der Adhärenz stehen Kombinationspräparate zur Verfügung.
Wirkstoffe |
Wirkmechanismus |
Präparate (Beispiele) |
|---|---|---|
Erstrang-Antituberkulotika (WHO-Gruppe 1) | ||
Isoniazid (INH) |
Störung des Zellwand- und Nukleinsäurestoffwechsels |
Isozid®, Iso-Eremfat® (Kombination mit Rifampicin) |
Rifampicin (RMP) |
Hemmung der Proteinsynthese |
Eremfat® (auch als Sirup, besonders für Kinder ab drei Monaten bis sechs Jahre) |
Ethambutol (EMB) |
Hemmung der Lipidsynthese |
EMB-Fatol®
|
Pyrazinamid (PZA) |
nicht genau geklärt, eventuell Störung der Mykolsäuresynthese |
Pyrafat®, Pyrazinamid® Jenapharm |
Zweitrang-Antituberkulotika | ||
injizierbare Wirkstoffe (WHO-Gruppe 2) | ||
|
Streptomycin1
Amikacin
Capreomycin2, Kanamycin2
|
Hemmung der Proteinsynthese |
Strepto-Fatol®
Amikacin B. Braun®
|
Fluorochinolone neuerer Generation (WHO-Gruppe 3) | ||
|
Levofloxacin
Moxifloxacin
Gatifloxacin2
|
Hemmung der DNA-Synthese durch Gyrase-Hemmung |
Tavanic®, Generika
Avalox®, Generika
|
neue Antituberkulotika mit gesicherter Wirkung gegen M. tuberculosis | ||
Bedaquilin |
Beeinträchtigung der Energiegewinnung durch spezifische Hemmung der mykobakteriellen ATP-Synthase |
Sirturo®
|
Delamanid |
Hemmung der Zellwand-Synthese |
Deltyba®
|
orale Zweitrang-Antituberkulotika mit gesicherter Wirkung gegen M. tuberculosis (WHO-Gruppe 4) | ||
Rifabutin (Mycobutin®), Protionamid (Peteha®), Terizidon (Terizidon® Riemser), 4-Aminosalicylsäure (PAS-Fatol® N), Ethionamid2, Rifapentin2
| ||
orale Zweitrang-Antituberkulotika mit unklarer Wirkung gegen M. tuberculosis (WHO-Gruppe 5, Auswahl) | ||
Amoxicillin / Clavulansäure, Clarithromycin, Imipenem, Linezolid | ||
1 In Deutschland auch Firstline; die WHO zählt Streptomycin zu den Zweitrang-Arzneimitteln, unter anderem da es nicht oral verabreicht werden kann und in vielen Ländern zur Behandlung einer unkomplizierten Tuberkulose nicht mehr verwendet wird. 2 in Deutschland nicht zugelassen | ||
Therapie erfordert Durchhaltevermögen
Die lange Behandlungsdauer ist deshalb notwendig, weil sich die Mykobakterien sehr langsam vermehren sowie eine Zellwand mit hohem Lipidanteil besitzen, die das Eindringen der Wirkstoffe behindert. Bei kompliziertem Erkrankungsverlauf (z. B. bei Befall mehrerer Organe) sowie bei HIV-positiven Patienten muss die Therapiedauer häufig noch weiter verlängert werden. Bei Resistenzen (siehe Tabelle 2) oder Unverträglichkeiten werden Zweitrang-Arzneimittel (siehe Tabelle 1) eingesetzt. Für die Therapie der multiresistenten Tuberkulose (MDR-Tuberkulose) werden vier Zweitrang-Arzneimittel (zusätzlich gegebenenfalls Pyrazinamid) empfohlen. Die Behandlungsdauer sollte mindestens bei 20 Monaten liegen, wobei ein injizierbares Arzneimittel (Initialphase) mindestens über acht Monate verabreicht werden sollte. Das kann sich negativ auf die Adhärenz auswirken, insbesondere bei ambulanter Therapie. Viele Patienten brechen sie wegen Nebenwirkungen oder weil sie sich nach einigen Therapiewochen bereits besser fühlen, vorzeitig ab. Die Apotheke kann hier unterstützend wirken (siehe Kasten „Beratungshinweise bei ambulanter Tuberkulose-Behandlung“).
sensible Tuberkulose |
pan susceptible Tuberkulose |
sensibel auf alle Erstrang-Medikamente |
Monoresistenz |
single drug resistance (SDR) |
Resistenz gegenüber einem Erstrang-Medikament |
Polyresistenz |
poly drug resistance (PDR) |
Resistenz gegenüber mindestens zwei Erstrang-Medikamenten, jedoch nicht gleichzeitig gegenüber Isoniazid und Rifampicin |
Multiresistenz |
multidrug resistance (MDR) |
Resistenz mindestens gegenüber Isoniazid und Rifampicin |
extensive Resistenz |
extensive drug resistance (XDR) |
Resistenz mindestens gegenüber Isoniazid und Rifampicin plus einem Fluorchinolon plus einem der injizierbaren Wirkstoffe Amikacin, Capreomycin oder Kanamycin |
Beratungshinweise bei ambulanter Tuberkulose-Behandlung
Eine unkomplizierte Tuberkulose (keine schweren Begleiterkrankungen, keine resistenten Erreger, Möglichkeit der häuslichen Isolation) kann ambulant erfolgen. Häufig wird eine stationäre Therapie nach Sputumkonversion (nach ca. drei bis vier Wochen) ambulant weitergeführt.
- Für eine optimale Resorption sollten alle Erstrang-Arzneimittel morgens in einer Dosis eingenommen werden (möglichst nüchtern, zur besseren Verträglichkeit gegebenenfalls mit einer leichten Mahlzeit).
- Isoniazid hemmt die Mono- und Diaminooxidasen; zur Vermeidung von Histamin-Intoxikationen sollte während der gesamten Behandlung möglichst auf Lebensmittel wie Käse oder Thunfisch verzichtet werden.
- Unter einer Isoniazid-haltigen Kombinationstherapie sollte auf Alkohol verzichtet werden, da ansonsten mit einer verminderten Alkohol-Toleranz, mit gehäuftem Auftreten von ZNS-Nebenwirkungen von Isoniazid und mit einer additiven Hepatotoxizität gerechnet werden muss.
- Fluorchinolone dürfen wegen einer möglichen Komplexbildung nicht zusammen mit Milchprodukten sowie Calcium-, Magnesium- und Eisenpräparaten eingenommen werden.
- Rifampicin interagiert als CYP3A4-Induktor mit zahlreichen Wirkstoffen (Interaktionscheck!), darunter auch mit hormonellen Kontrazeptiva (beschleunigter Abbau). Zur Empfängnisverhütung müssen daher andere Methoden angewendet werden.
- Isoniazid verringert die Clearance von Paracetamol. Da toxische Wirkstoffspiegel auch nach sonst unschädlichen Paracetamol-Dosen auftreten können, sollten in der Selbstmedikation alternative Analgetika empfohlen werden.
- Unter Ethambutol sind regelmäßige augenärztliche Kontrolluntersuchungen wichtig, da eine (reversible) Sehnerv-Entzündung entstehen kann.
Fortschritte und neue Herausforderungen
Nach Angaben der Weltgesundheitsorganisation (WHO) im Global Tuberculosis Report 2016 sanken die Prävalenzraten zwischen 1990 und 2013 um 41%, die Zahl der Todesfälle um 45%. Zwischen 2000 und 2015 war es durch Präventions- und Behandlungsmaßnahmen gelungen, weltweit etwa 45 Millionen Menschenleben zu retten. Dennoch zählt die Tuberkulose weiterhin zu den zehn häufigsten Todesursachen weltweit mit 1,8 Millionen Todesfällen in 2015. Die Zahl der Neuerkrankungen betrug 2015 10,4 Millionen, das sind 28.500 jeden Tag. 1,2 Millionen Betroffene waren HIV-positiv. Insbesondere bei Kindern sind die Erkrankungszahlen und Todesfälle dramatisch angestiegen. 2014 erkrankten weltweit eine Million Kinder an Tuberkulose. Während in jenem Jahr 140.000 daran verstarben, waren es 2015 bereits 210.000. In Deutschland hat es nach dem historischen Tiefpunkt im Jahre 2012 (n = 4255) wieder einen leichten Anstieg bei den an das RKI gemeldeten Fällen gegeben (2013: 4325, 2014: 4533, 2015: 5865).
Eine der größten Herausforderungen bei der Bekämpfung der Tuberkulose ist die Ausbreitung multiresistenter Erregerstämme (MDR-Tuberkulose bzw. XDR-Tuberkulose, siehe Tabelle 2). 2015 sind schätzungsweise 480.000 neue Fälle mit MDR-Tuberkulose und zusätzlich rund 100.000 Rifampicin-resistente Fälle aufgetreten. Davon wurden 45% in China und in der Russischen Föderation registriert. Aktuelle Erhebungen haben gezeigt, dass Menschen aus bestimmten Regionen Osteuropas (Moldawien, Tschetschenien) im Falle einer Infektion mit M. tuberculosis ein teilweise mehr als 50%iges Risiko besitzen, Träger eines multiresistenten Stammes zu sein.
Ist die Ausrottung bis 2030 möglich?
Um die Tuberkulose-Epidemie zu beenden, haben sich die Vereinten Nationen und die WHO klare Ziele gesetzt. Bis 2030 soll im Vergleich mit 2015 eine 90%ige Reduktion bei den Todesfällen und eine 80%ige Reduktion bei den Neuerkrankungen erzielt werden. Als Zwischenstand will man bis 2020 eine 35%ige Reduktion der Todesfallzahlen und eine 20%ige Verringerung der Inzidenzrate, jeweils bezogen auf 2015, erreichen. Ob das gelingen kann, ist ungewiss. Denn um dieses Ziel zu erreichen, müsste sich die Inzidenzrate zunächst bis 2020 jährlich um 4 bis 5% verringern. Zwischen 2014 und 2015 ist sie jedoch nur um 1,5% gesunken. Nur sechs Länder – Indien, Indonesien, China, Nigeria, Pakistan und Südafrika – tragen zu 60% der Neuerkrankungen bei. Daher wird das Erreichen von Eradikationszielen vor allem davon abhängen, wie gut es gelingt, die Prävention und Behandlung in diesen Ländern zu verbessern. Die WHO beklagt, dass große Finanzierungslücken sowohl in den Tuberkulose-Präventions- und Behandlungsprogrammen weltweit als auch bei den Kosten für Forschung und Entwicklung bestehen.
Umwelt und Lebensweise müssen die Pharmakotherapie unterstützen
cae ⅼ So wichtig Arzneimittel für die Therapie der Tuberkulose auch sind – ohne bestimmte Lebensumstände kann der Patient nicht gesund werden. Hier ist in erster Linie eine quantitativ und qualitativ ausreichende Ernährung zu nennen, die in Entwicklungsländern oft die Ausnahme und nicht die Regel ist. Wichtig ist zudem ein hygienischer Mindeststandard in den Wohnungen, z. B. die sichere Beseitigung des Auswurfs der Patienten, damit sich Mitbewohner nicht damit infizieren können. Ein schwerwiegendes, scheinbar unüberwindliches Problem stellt oft die Luftverschmutzung in und vor den Wohnungen durch offene Feuerstellen dar, denn die traditionelle „Küche“ ist zum Beispiel in afrikanischen Ländern ein Teil der persönlichen Identität, selbst wenn sie noch so gesundheitsschädlich ist. Tuberkulose-Patienten brauchen jedoch möglichst reine, staub- und allergenarme sowie trockene Luft zum Atmen, und diese Luftqualität ist in Entwicklungsländern Mangelware.
Intensivierung der Tuberkulose-Prophylaxe
Die WHO plädiert außerdem dafür, die präventive Behandlung der Tuberkulose zu intensivieren. Bei präventiver Arzneimittelgabe muss unterschieden werden zwischen der Behandlung infizierter und nicht infizierter Personen. Patienten mit latenter Tuberkulose können eine Chemoprävention erhalten, beispielsweise Isoniazid über neun Monate, bei Isoniazid-Resistenz Rifampicin über drei bis vier Monate. Unter Chemoprophylaxe wird dagegen die vorbeugende Behandlung exponierter Personen verstanden, die sich nicht infiziert haben bzw. deren Infektion noch nicht nachweisbar ist.
Gemeinsame Anstrengungen sind notwendig
Nach Einschätzung der WHO sind jährlich zwei Milliarden US-Dollar für die Tuberkulose-Erforschung und die Entwicklung neuer Präventions- und Behandlungsstrategien notwendig. In der Dekade 2005 bis 2014 konnten jedoch nie mehr als 0,7 Milliarden US-Dollar jährlich bereitgestellt werden. Diese Finanzierungslücke gilt es zu schließen, so die WHO.
Die forschenden Pharmafirmen haben seit den frühen 2000er-Jahren ihre Aktivitäten zur Entwicklung neuer Antituberkulotika deutlich verstärkt. Den größten Teil der Projekte betreiben die Unternehmen im Rahmen von Produktentwicklungspartnerschaften (Product Development Partnerships, PDP), das heißt gemeinsam mit anderen Unternehmen sowie Stiftungen, Forschungseinrichtungen, regierungsnahen und anderen Organisationen. Beispiele sind die TB Alliance und die Tuberculosis Vaccine Initiative (TBVI). Im Rahmen solcher Partnerschaften tragen die Pharmafirmen den finanziellen Entwicklungsaufwand nicht allein; sie verpflichten sich im Gegenzug, jedes aus dieser Zusammenarbeit hervorgehende Arzneimittel an einkommensschwache Länder zu Sonderkonditionen zu liefern. Wirkstoffe, die sich derzeit in der klinischen Entwicklung befinden, zeigt Tabelle 3. Die Impfung gegen Tuberkulose (BCG-Impfung) wird von der STIKO seit 1998 nicht mehr empfohlen. Dies entspricht der WHO-Empfehlung, in Bevölkerungsgruppen mit einem Tbc-Infektionsrisiko unter 0,1% keine generelle BCG-Impfung durchzuführen. Weitere Gründe für die Nicht-Empfehlung der STIKO ist eine nicht sicher belegbare Wirksamkeit der Impfung – in Metaanalysen lag der Impfschutz lediglich bei ca. 50% bezogen auf eine pulmonale Erkrankung – und die zahlreichen Nebenwirkungen. Derzeit ist in Deutschland kein Tuberkulose-Impfstoff zugelassen; international ist ein BCG-Impfstoff verfügbar (BCG: Bacille Calmette-Guérin, nach den Franzosen Albert Calmette und Camille Guérin benannter attenuierter Erreger, den sie aus dem Wildtyp von Mycobacterium bovis gezüchtet haben). Zurzeit wird im Rahmen zahlreicher Projekte (siehe Tabelle 4) an neuen Tuberkulose-Vakzinen gearbeitet. Besondere Bedeutung besitzt die rechtzeitige Identifizierung von Patienten mit resistenten Erregern. 2016 wurden von der WHO vier neue diagnostische Tests geprüft und empfohlen, mit deren Hilfe Resistenzen gegen Erstrang- und Zweitrang-Antituberkulotika identifiziert werden können; für 2017 werden weitere erwartet. |
Projekt |
Status |
Unternehmen |
Partner |
|---|---|---|---|
Pretomanid |
Phase III |
2 |
TB Alliance |
SQ-109 |
Phase II |
Sequella |
National Institutes of Health (NIH) |
Sutezolid (Oxazolidinon-Verbindung) |
Phase II |
Sequella |
– |
PBTZ 169 (DprE1-Inhibitor)3
|
Phase I |
Nearmedic |
Ecole Polytechnique Fédérale de Lausanne |
BTZ 043 (DprE1-Inhibitor) |
Phase I |
– |
Universität München, Hans-Knöll-Institut (HKI), DZIF |
Q203 (Imidazopyridin) |
Präklinik |
Qurient Therapeutics |
– |
|
Cyclohexylgriselimycin
(DnaN-Inhibitor)
|
Präklinik |
Sanofi |
Helmholtz-Institut für Pharmazeutische Forschung Saarland |
TBA-7371 (DprE1-Inhibitor) |
Präklinik |
TB Alliance |
|
SQ-609 |
Präklinik |
Sequella |
|
1 Alle Wirkstoffe werden nicht als Monotherapie, sondern stets in freien Kombinationen mit anderen Antituberkulotika geprüft. Nicht in der Tabelle enthalten sind Antibiotika, die gegen Tuberkulose erprobt werden, aber bereits gegen andere bakterielle Infektionen zugelassen sind (z. B. Moxifloxacin, Linezolid). 2 von Novartis an die TB Alliance übergeben, 3 DprE1 = Decaprenyl-Phosphoribose-2‘-Epimerase | |||
Projekt |
Status |
Unternehmen |
Partner |
|---|---|---|---|
rekombinanter intradermaler Impfstoff (ESAT6-CFP10-Allergene) |
Phase III |
Chongqing Zhifei Biological (China) |
– |
VPM1002 |
Phase II |
Serum Institute of India1
|
Vakzine Projekt Management GmbH, TBVI2 u. a. |
H56:IC31 (Ag85B, ESAT-6, Rv2660c + IC31) -Subunit-Impfstoff mit Fusionsprotein |
Phase II |
Valneva |
Statens Serum Institute, Dänemark SSI, Aeras |
Impfstoff (M72 / AS01, AS02; gentechnisch hergestelltes Antigen) |
Phase II |
GlaxoSmithKline |
Aeras |
+ RUTI – Postinfektionsimpfstoff |
Phase II |
Archivel Farma |
– |
H4:IC31 (Subunit-Impfstoff mit Fusionsprotein) |
Phase II |
Sanofi / Valneva |
SSI, Aeras |
ID93/GLA-SE (Subunit-Impfstoff) |
Phase II |
– |
Aeras und Infectious Disease Research Institute (IDRI), Seattle (USA) |
MTBVAC (attenuierter Lebendimpfstoff) |
Phase I |
Biofabri (Spanien) |
TBVI2, Zaragoza University, South African Tuberculosis Vaccine Initiative |
Ad5Ag85A (rekombinanter Impfstoff auf Adenoviren-Basis) |
Phase I |
Tianjin CanSino Biotechnology |
McMaster Univ.3 |
MVA85A (Aerosol, auf Basis von „recombinant modified Vaccinia Ankara“-Virus |
Phase I |
- |
Oxford University, TBVI |
DAR-901 (Totimpfstoff) |
Phase I |
– |
Aeras, Dartmouth University |
TB/FLU-04L |
– |
Research Institute for Biological Safety Problems (Kasachstan) |
|
intranasaler Impfstoff mit Parainfluenza-Virus als Vektor |
Präklinik |
SumitomoDainipponPharma |
Aeras |
MTbuVax (multivalenter Subunit-Impfstoff) |
Präklinik |
Vaxil BioTherapeutics (Israel) |
– |
Ch Ad63 (Impfstoff auf Basis von Chimp-Adenovirus) |
Präklinik |
Okairos |
Aeras |
rCMV-Impfstoff (auf Basis von rekombinanten Cytomegalo-Viren) |
Präklinik |
– |
Aeras, Oregon Health and Science University (OHSU) |
MVA85A (Lebendimpfstoff auf Basis von „modified Vaccinia Ankara“-Viren) |
Präklinik |
– | Aeras |
GI-19000 (rekombinanter Impfstoff) |
Präklinik |
GlobeImmune (USA) |
– |
Ab-02 Impfstoff (OMV-basiert) |
Präklinik |
Abera Bioscience (Schweden) |
ADITEC research consortium |
H64–CAF01 |
Präklinik |
– |
SSI, TBVI |
rBCGΔais1/zmp1 |
Präklinik |
– | Zürich University, TBVI |
ChAdOxPPE15 |
Präklinik |
– | Oxford University, TBVI |
MTBVAC+ |
Präklinik |
Biofabri (Spanien) |
TBVI, Zaragoza University |
therapeutischer Impfstoff, rekombinant |
Präklinik |
FIT Biotech (Finnland), Beijing Minhai Biotechnology |
– |
therapeutic vaccine – MVA Platform |
Präklinik |
Transgene SA |
TBVI |
1 heißt „Institute“, ist aber ein Pharmaunternehmen, 2 TVBI: Tuberculosis Vaccine Initiative, 3 zuvor zeitweilig von Aeras gefördert | |||
Literatur
Global Tuberculosis Report 2016, www.who.int/tb/publications/global_report/en/
Husten als unspezifisches Leitsymptom – vom unklaren Beschwerdebild zur Diagnose einer offenen Lungentuberkulose, Epidemiologisches Bulletin Nr. 33/2016 vom 22. August 2016, www.rki.de
Geldmacher C et al. Interaction between HIV and Mycobacterium tuberculosis: HIV-1-induced CD4 T-cell depletion and the development of active tuberculosis. Curr Opin HIV AIDS. 2012;7(3):268-275, doi: 10.1097/COH.0b013e3283524e32
Welttuberkulosetag 2016: Gemeinsam gegen Tuberkulose. Epidemiologisches Bulletin Nr. 10/2011 vom 14. März 2016, www.rki.de
Lange C. M/XDR-Tuberculosis: Therapy as Prevention. Drug Res 2014;64(Suppl.1):24-24, doi: http://dx.doi.org/10.1055/s-0033-1358038
Migliori GB et al. Review of multidrug-resistant and extensively drug-resistant TB: global perspectives with a focus on sub-Saharan Africa. Trop Med Int Health 2010;15:1052-1066, doi: 10.1111/j.1365-3156.2010.02581.x
Better Global Data Shows that TB Kills More Kids. Statement from TB Alliance on WHO Global TB Report 2016 vom 12. Oktober 2016, www.tballiance.org/news/statement-tballiance-who-global-tb-report-2016
Bruhn C. Hoffnung für Patienten mit resistenter Tuberkulose. DAZ 2013;13:90f
Bilharz C. Die Schwindsucht schwindet nicht. DAZ 2014;51:38f
Tuberkulose. RKI-Ratgeber für Ärzte, Stand 21. Februar 2013, www.rki.de
Schönfeld N. Tuberkulose bei Geflüchteten – was Sie beachten sollten. www.pneumologie.de/dzk/files/Fortbildung-Tuberkulose-bei-Asylsuche.pdf?cntmark, Abruf am 26. Oktober 2016
Verband forschender Arzneimittelhersteller (vfa), www.vfa.de
Schaberg T et al. Latente tuberkulöse Infektion: Empfehlungen zur präventiven Therapie bei Erwachsenen in Deutschland. Pneumologie 2004;58:255-2570, http://pneumologie.de/fileadmin/pneumologie/downloads/Empfehlungen/LTBI.pdf?cntmark
Schaberg T et al. Empfehlungen zur Therapie, Chemoprävention und Chemoprophylaxe der Tuberkulose im Erwachsenen- und Kindesalter. Deutsches Zentralkomitee zur Bekämpfung der Tuberkulose (DZK), Deutsche Gesellschaft für Pneumologie und Beatmungsmedizin (DGP). Pneumologie 2012;66:133-171
Lungenkrebs (Bronchialkarzinom). Zentrum für krebsregisterdaten, www.krebsdaten.de/Krebs/DE/Content/Krebsarten/Lungenkrebs/lungenkrebs_node.html, Stand 17. Dezember 2015, Abruf am 1. November 2016
Empfehlungen der Ständigen Impfkommission (STIKO) am Robert Koch-Institut 2016/2017, Stand: August 2016, Epid Bull 2016;34:302-337, DOI 10.17886/EpiBull-2016-051.3 www.rki.de
Lohde HM, Stahlmann R. Aktuelle Therapie der Tuberkulose. AMT 2015;33:47-53
Die Autorin dankt Dr. Rolf Hömke, Senior Referent Wissenschaftspresse beim Verband forschender Arzneimittelhersteller (vfa), für die Unterstützung bei den Tabellen 3 und 4.
„Ein völlig unrealistisches Ziel!“
Interview mit Prof. Dr. Christoph Lange
DAZ: Für wie realistisch halten Sie das Ziel der WHO, die Tuberkulose weltweit bis 2030 zu eliminieren?
Prof. Dr. Dr. Christoph Lange: Ich halte dieses Ziel zum jetzigen Zeitpunkt für völlig unrealistisch. Es wird von der WHO eine hohe Erwartung geschürt, obwohl es angesichts der Inzidenzzahlen und der demografischen Entwicklung überhaupt nicht möglich ist, diese zu erfüllen. Ziele sollten erreichbar sein. Wenn man eine Kontrolle der Tuberkulose als Ziel anstreben würde, wäre das schon völlig ausreichend.
DAZ: Welches sind aus Ihrer Sicht die größten Schwierigkeiten bei der Bekämpfung der Tuberkulose-Epidemie?
Lange: Eines der zentralen Probleme ist die rasche Ausbreitung resistenter Erreger. Beispielsweise haben wir in China, wo die Rate der MDR-TB derzeit am höchsten ist, zwischen 2014 und 2015 einen 20%igen Anstieg der Erkrankungsfälle mit multiresistenten Erregern verzeichnet. Dazu kommt, dass die Behandlung sehr lange dauert, was durch die geringe Teilungsrate der Mykobakterien bedingt ist. Während sich beispielsweise Staphylokokken etwa 70-mal pro Tag teilen, machen das die Tuberkulose-Erreger nur einmal pro Tag oder sogar noch seltener, wenn sie sich verkapselt haben. Es gibt leider derzeit keine Strategie, mit der es gelingt, die Teilungsrate der Bakterien anzukurbeln und sie gleichzeitig abzutöten. Das wäre ja theoretisch eine gute Möglichkeit, die Therapiedauer zu verkürzen.
DAZ: Haben denn die beiden neu zugelassenen Wirkstoffe Bedaquilin und Delamanid eine Verbesserung in der Behandlung der Tuberkulose gebracht?
Lange: Auf jeden Fall. Mit den neuen Arzneimitteln können wir fast alle Patienten heilen. Wir haben ja hier in Borstel seit Anfang 2015 mehr als 40 Patienten stationär behandelt und keinen einzigen Therapieversager. Dass ist sehr erfreulich. Dennoch muss man auch sehen, dass eine Behandlung mit den neuen Arzneimitteln sehr kostenintensiv ist. Während eine Standard-Therapie unter 400 Euro kostet, schlägt eine MDR-TB-Therapie mit etwa 25.000 Euro und eine XDR-TB-Therapie sogar mit über 90.000 Euro zu Buche, und das sind nur die Arzneimittelkosten. Bei so hohen Investitionen ist natürlich die Adhärenz besonders wichtig.
Leider ist es auch Realität, dass die Entwicklung antibiotikaresistenter Stämme derzeit viel schneller verläuft als die Entwicklung neuer Arzneimittel. Gerade in den letzten zehn Jahren gab es eine starke Zunahme multiresistenter Stämme, die zuvor weltweit überhaupt keine Rolle gespielt haben. Und Mitte 2015 wurde der erste Bericht über einen Tuberkulose-Stamm veröffentlicht, der gegen die beiden neuen Wirkstoffe resistent ist. Es ist daher utopisch, anzunehmen, dass man mit den aktuell verfügbaren Arzneimitteln die Entwicklung und Ausbreitung multiresistenter Stämme hemmen kann.
DAZ: Sie haben 2006 gemeinsam mit Kollegen das TBNET gegründet. Welche Ziele verfolgt dieses Netzwerk?
Lange: TBNET ist eine Gruppe von wissenschaftlich tätigen Ärzten und Wissenschaftlern, die meist in Europa leben. Sie arbeiten gemeinsam an der Erforschung solcher Fragen, die man an einer Tuberkulose-Klinik allein nicht bearbeiten kann. Sie sammeln gemeinsam Daten, werten sie gemeinsam aus. Seit seiner Gründung hat sich der wissenschaftliche Output des Netzwerkes enorm erhöht. Es sind inzwischen knapp 50 peer reviewed Artikel erschienen, darunter auch hochrangige Zeitschriften wie das New England Journal of Medicine, Lancet oder American Journal of Respiratory and Critical Care Medicine. Alle diese Aktivitäten erfolgen mit einem vergleichsweise geringen finanziellen Aufwand, dafür aber mit sehr hohem Engagement der Beteiligten.
Wir verfolgen im TBNET aber nicht nur gemeinsame wissenschaftliche Projekte, sondern sind auch im sogenannten Capacity Building aktiv. Dies beinhaltet beispielsweise Projekte für die Nachwuchsentwicklung. So veranstalten wir seit einigen Jahren eine TBNET-Academy. Absolventen und Nachwuchswissenschaftler treffen sich drei Tage lang zu Workshops, deren Programm sie unter Anleitung von Mentoren überwiegend selbst gestalten. Ziel ist die Bildung eines Juniornetzwerkes in Europa, in das vor allem auch osteuropäische Kollegen eingebunden werden sollen, die keine Möglichkeit haben, an internationalen Kongressen teilzunehmen. Wir haben solche Akademien in den vergangenen zwei Jahren in Moldawien und in der Ukraine durchgeführt, verbunden mit Lehrvisiten in den Krankenhäusern vor Ort und Besichtigungen von Tuberkulose-Laboren. Die jungen Kollegen haben dadurch die Möglichkeit, sich gegenseitig kennenzulernen, sich in das Netzwerk einzubringen, ohne dass ihnen ein finanzieller Aufwand entsteht.
DAZ: Was müsste aus Ihrer Sicht unternommen werden, um die Behandlung der multiresistenten Tuberkulose zu verbessern? Wie können Apotheker einen Beitrag leisten?
Lange: Es gibt einige vielversprechende Ergebnisse aus Regionen mit geringen Resistenzraten wie Bangladesh, Kamerun oder Niger. Dort ist es gelungen, über 80% der Erkrankten mit einer Therapie über neun bis zwölf Monate zu heilen. In Europa wäre das nicht möglich, hier gibt es zu viele multiresistente Erreger. Die wirksamste Hilfe wäre eine Vakzine, die verhindert, dass Menschen, die exponiert sind, sich anstecken bzw. die, die sich angesteckt haben, erkranken. Ein solcher Impfstoff ist jedoch in absehbarer Zeit wahrscheinlich nicht verfügbar.
Apotheker können helfen, die Adhärenz zu stärken, denn der längste Abschnitt einer Tuberkulose-Behandlung findet ja in der Regel ambulant statt. Der Apotheker kann die Botschaft vermitteln, dass eine Heilung möglich ist, wenn der Patient die Behandlung durchhält. Bei der MDR-Tuberkulose sind das ja annähernd zwei Jahre – eine lange Zeit, zumal unerwünschte Wirkungen leicht zum Abbruch der Behandlung führen können. Es ist daher auch wichtig, das Nebenwirkungsspektrum der Medikamente zu kennen, um die Patienten beim Umgang damit unterstützen zu können.
DAZ: Herr Professor Lange, herzlichen Dank für das Gespräch! |
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.