
- DAZ.online
- DAZ / AZ
- DAZ 15/2016
- Wenn Psoriasis die ...
Psoriasis
Wenn Psoriasis die Gelenke angreift
Ein großes Arsenal von Arzneimitteln hemmt die Entzündungsprozesse
Rund jeder fünfte Psoriasispatient leidet neben Haut- auch unter Gelenksymptomen. Bei 80 Prozent der Betroffenen zeigen sich zunächst über viele Jahre Hautveränderungen, bevor sich die Psoriasis-Arthritis entwickelt. Allerdings kann sie sich auch vor oder ohne psoriatische Hautsymptome ausbilden (zu je 10%). Die Beschwerden der PsA äußern sich in Schmerzen, Gelenkergüssen, Rötungen und Schwellungen über einem Gelenk, Morgensteifigkeit, Funktionseinbußen und Verformungen der Gelenke. Der Schwerpunkt des erstmaligen Auftretens liegt zwischen dem 35. und dem 45. Lebensjahr [1].
Vielfältige Manifestationen der PsA
Eine Besonderheit der PsA ist ihr heterogenes klinisches Spektrum, das von der Beteiligung peripherer Gelenke und der Wirbelsäule bis zu extraartikulären Manifestationen wie Enthesitis (Entzündung der Sehnenansätze) und Uveitis (Entzündung der mittleren Augenhaut) reicht.
Häufig bildet sich auch eine Daktylitis aus, eine als „Wurstfinger“ oder „Wurstzehe“ bezeichnete Schwellung. Anders als bei einer rheumatoiden Arthritis (RA) treten die Gelenkbeschwerden meistens asymmetrisch auf (nur links oder nur rechts). Charakteristisch ist ein „Befall im Strahl“, d. h. dass jeweils Grund-, Mittel- und Endgelenk eines Fingers oder einer Zehe betroffen sind. Im schlimmsten Fall kann es im Verlauf der Erkrankung zur Deformation der Gelenke und zu Umbauvorgängen der Knochen kommen [1].
Nach Moll und Wright lassen sich fünf Subtypen der PsA unterscheiden [2]:
- asymmetrische Oligoarthritis (ca. 70%),
- symmetrische Polyarthritis (20%),
- distale interphalangeale Arthritis (Befall der Finger- und Zehengelenke; 5 – 10%),
- mutilierende Arthritis (mit schwerer Schädigung der Gelenke; 5%),
- ankylosierende Spondylitis mit oder ohne Beteiligung peripherer Gelenke (5 – 40%).
Die ankylosierende Spondylitis wird jedoch im Allgemeinen als eine eigenständige Krankheit aufgefasst (s. Tab. 1). Die unterschiedlichen Ausprägungen der PsA können nacheinander oder parallel auftreten. Daher erlaubt das initiale Befallsmuster meist keine Voraussage für den weiteren Verlauf der Erkrankung.
Befund |
Psoriasis-Arthritis (PsA) |
rheumatoide Arthritis (RA) |
ankylosierende Spondylitis |
|---|---|---|---|
Gelenkbefall: Musterund Lokalisation |
oligo- bis polyartikulär, peripher oder axial |
polyartikulär, peripher |
axial plus große periphere Gelenke, mehr axial als peripher |
Befall symmetrisch? |
meistens nein |
ja |
ja |
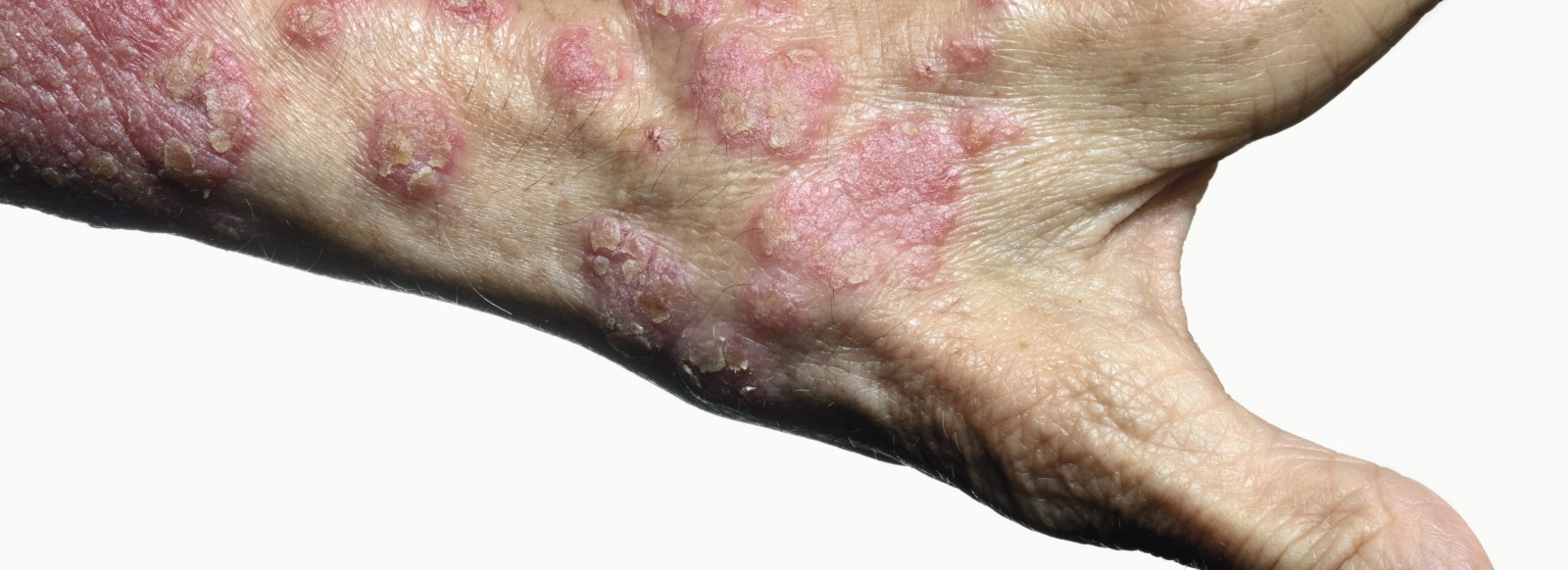
Schwellungen und Erytheme? |
ja (s. Abb. 2) |
ja |
nein |
Synovitis? |
ja |
ja |
selten |
Daktylitis? |
ja |
nein |
ja |
Enthesitis? |
ja |
nein |
ja |
Krankheitsursachen: TNF-α und Interleukine
Bei der Auslösung von Entzündungsschüben an Haut und Gelenken spielen der Tumornekrosefaktor alpha (TNF-α) und weitere Zytokine (vor allem Interleukine) eine zentrale Rolle. Die überschießende Produktion von Zytokinen fördert Entzündungsmechanismen, die entscheidend zur klinischen Manifestation der Psoriasis beitragen.
TNF-α führt darüber hinaus zu einer verstärkten Bildung von Osteoklasten sowie deren Einwanderung in betroffene Gelenke, wo dann erosive Knochenveränderungen sowie Knorpeldestruktionen auftreten können [1].
Diagnose
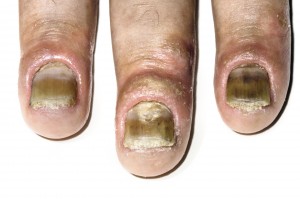
In der Praxis wird die Diagnose PsA oft erst verzögert gestellt, z. B. wenn nur minimale Hautstellen am Bauchnabel, hinter dem Ohr oder in der Pofalte betroffen sind, während zugleich starke Gelenkschmerzen bestehen. Weil bei den meisten Patienten jedoch zunächst typische Hautsymptome auftreten, sollte insbesondere der Dermatologe auf Gelenkbeschwerden achten. Zudem ist ein Blick auf die Nägel zu werfen, da rund 70 Prozent der PsA-Patienten eine Nagelpsoriasis aufweisen (Abb. 1) [3, 4]. Die Frage nach einer positiven Familienanamnese und einer stationären Behandlung einer Psoriasis während der vorangegangenen fünf Jahre sind weitere wichtige Kriterien.
Abb. 1: Eine Nagelpsoriasis tritt bei etwa 70 Prozent der PsA-Patienten auf.
Die klinische Untersuchung der Gelenke hilft bei der Differenzialdiagnose (Tab. 1). Im Vergleich zur ankylosierenden Spondylitis findet sich bei der PsA häufig ein segmentaler, einseitiger entzündlicher Befall der unteren Wirbelsäule. Wichtig zur Abgrenzung gegen eine RA ist das gleichzeitige Auftreten von Knochenerosionen und -proliferationen im Röntgenbild. Mittels Sonografie und Magnetresonanztomografie lassen sich zudem Entzündungen an Gelenken und Weichteilen frühzeitig erkennen.
PsA-spezifische Labormarker existieren nicht. Die Entzündungsparameter (BSG, CRP) sind nur leicht bis mittelgradig erhöht, Rheumafaktoren meist negativ. Bei etwa zehn bis 20 Prozent der Betroffenen liegen erhöhte Harnsäurewerte im Blut vor, die jedoch kein eindeutiges Indiz für die Psoriasis-Arthritis sind, sondern häufiger auf eine Gicht hinweisen [1, 5].
Therapieziele
Die Behandlung der PsA richtet sich normalerweise nach einem Stufenschema. Sie beginnt mit einem nichtsteroidalen Antirheumatikum (NSAR), dem Basistherapeutika und schließlich Biologicals folgen. Zu beachten ist, dass viele Patienten mit PsA auch unter einer ausgeprägten Hautbeteiligung leiden. Zur Therapie sollten dann Medikamente ausgewählt werden, die sowohl die Gelenk- als auch die Hautsymptome lindern können. Darüber hinaus sind andere extraartikuläre Manifestationen sowie eventuelle Komorbiditäten (z. B. metabolisches Syndrom, kardiovaskuläre Erkrankung) zu berücksichtigen [7]. Die TICOPA-Studie (Trial comparing tight control of early psoriatic arthritis) hat gezeigt, dass eine konsequent an die Krankheitsaktivität angepasste Therapie (Treat-to-target-Prinzip) bessere Ergebnisse an Haut, Gelenken und Knochen erzielt als eine konventionelle Therapie [8].
EULAR-Richtlinien
Zur Behandlung der PsA sind in den letzten Jahren weitere Arzneistoffe mit neuen Therapieprinzipien eingeführt worden. Daher haben die Expertengruppen der EULAR (European League against Rheumatism) und GRAPPA (Group for Research and Assessment of Psoriasis and Psoriatric Arthritis) ihre Empfehlungen zur Pharmakotherapie aktualisiert. Die EULAR-Empfehlungen umfassen auch nach dem Update von 2015 zehn Richtlinien [7]:
1. – 2. NSAR und Glucocorticoide
NSAR (z. B. Diclofenac 50 – 150 mg, Ibuprofen 800 – 2400 mg, Naproxen 500 – 750 mg) können unter Berücksichtigung von kardiovaskulären und gastrointestinalen Risiken bei mildem Verlauf muskuloskelettaler Symptome eingesetzt werden. Sie sorgen für eine Schmerzkontrolle und ein Abschwellen der Gelenke, haben aber keine direkt krankheitsmodifizierende Wirkung.
Ergänzend sollten Glucocorticoide nur in der niedrigst effektiven Dosis bei mono- oder oligoartikulären Formen oder bei Daktylitis und Enthesitis in das Gelenk (intraartikulär, i. a.) injiziert werden. Orale Glucocorticoide sind wegen möglicher Hautexazerbationen mit Vorsicht anzuwenden.
3. Basistherapeutika (DMARDs)
Disease modifying antirheumatic drugs (DMARDs) wie Methotrexat, Leflunomid oder Sulfasalazin sollten frühzeitig zur Anwendung kommen, wenn keine Reduktion der Symptome durch NSAR erreicht werden kann bzw. aktive Entzündungsprozesse oder schlechte prognostische Faktoren vorliegen. Allerdings sind DMARDs nicht wirksam bei Enthesitis und werden bei Achsenskelettbeteiligung nicht empfohlen. Zudem konnte für keines der Präparate nachgewiesen werden, dass es die strukturelle Knochenschädigung bei PsA aufhält.
Methotrexat (MTX, Metex®, Lantarel®) ist bei einer relevanten Hautbeteiligung weiterhin das Mittel der ersten Wahl, auch wenn die Studienlage zu Gelenkeffekten weniger überzeugend ausfällt. Die Dosis hängt generell von der Verträglichkeit und der individuellen Wirksamkeit sowie von der Schwere des Krankheitsbildes ab. Die empfohlene Initialdosis beträgt 7,5 mg (subkutan oder oral) einmal wöchentlich. Schrittweise wird die Dosis auf maximal 30 mg gesteigert.
Bei der MTX-Abgabe in der Apotheke sollte ausdrücklich auf die einmal wöchentliche Applikation hingewiesen werden. Am Tag der Applikation soll der Patient weder NSAR einnehmen noch Alkohol konsumieren. 24 bis 48 Stunden danach ist eine Substitution mit 5 mg Folsäure anzuraten.
Kontrolluntersuchungen (Blutbild, Atem-, Leber- und Nierenfunktion, Mundschleimhaut und Rachen) sind vor Therapiebeginn und dann in regelmäßigen Abständen erforderlich. Während der Therapie und bis zu sechs Monate nach Behandlungsende müssen Frauen im gebärfähigen Alter auf eine sichere Kontrazeption achten.
Sulfasalazin (Azulfidine® RA, Pleon® RA) ist nicht für die PsA-Behandlung zugelassen. Es bessert die Hautsymptomatik nicht, hat jedoch in mehreren Untersuchungen bei peripherer Arthritis eine Wirksamkeit gezeigt, sodass es zur Therapie leichterer Formen empfohlen werden kann [1].
Die Dosis wird über vier Wochen langsam von 500 mg auf 2 g/d (maximal 3 g) gesteigert, um mögliche Nebenwirkungen zu minimieren. Sulfasalazin kann bei strenger Indikationsstellung in Schwangerschaft und Stillzeit eingenommen werden, dann ist jedoch besonders auf eine ausreichende Folsäure-Zufuhr zu achten. Unter der Therapie müssen das vollständige Blutbild sowie die Leber- und Nierenfunktion engmaschig kontrolliert werden.
Der Pyrimidinantagonist Leflunomid (Arava®) ist an den Gelenken gut wirksam, zeigt jedoch an der Haut nur eine begrenzte Effektivität. Aufgrund der Nebenwirkungen wird heute meist nicht mehr eine initiale Hochdosis von 100 mg/d über drei Tage empfohlen, sondern mit der Dauerdosis von 20 mg einmal täglich begonnen.
Während und bis zu 48 Monate nach der letzten Einnahme müssen Frauen im gebärfähigen Alter eine ausreichende Kontrazeption einhalten. Blutdruck, Leberfunktionswerte und Differenzialblutbild sind regelmäßig zu kontrollieren.
Das Immunsuppressivum Ciclosporin (Sandimmun Optoral®) ist zur Therapie der schweren Psoriasis vulgaris zugelassen, jedoch nicht ausdrücklich zur Therapie der PsA. Die Dosierung liegt bei 2,5 (–5) mg/kg KG täglich. Während es gegen die Hauterscheinungen gut wirksam ist, zeigt Ciclosporin nur eine mäßige Besserung der Gelenkbeschwerden. Zudem wird der Einsatz durch zahlreiche Nebenwirkungen und Interaktionen limitiert.
4. – 5. Biologicals
Biologicals sind bei peripherer und axialer PsA wirksam, halten auch strukturelle Knochenveränderungen auf und bessern zudem die Hautsymptomatik. Ein Therapieversuch mit einem TNF-α-Antagonisten sollte bei Patienten mit peripherer Arthritis unternommen werden, die nicht ausreichend auf ein DMARD ansprechen. Wenn allerdings Kontraindikationen für TNF-α-Inhibitoren vorliegen, kann auf einen Interleukin (IL)-12/23-Inhibitor (Ustekinumab) oder IL‑17A-Inhibitor (Secukinumab) ausgewichen werden. Derzeit sind fünf TNF-α-Antagonisten zur Therapie der PsA in Deutschland zugelassen.
Infliximab (Remicade®) ist ein chimärer monoklonaler Antikörper, der spezifisch gelöstes sowie rezeptorgebundenes TNF-α bindet. Infliximab ist der einzige TNF-α-Inhibitor, der als intravenöse Infusion verabreicht wird. Der Arzt infundiert die Dosis von 5 mg pro kg Körpergewicht in den Wochen 0, 2 und 6 und danach alle acht Wochen.
Bei Adalimumab (Humira®) handelt es sich um einen humanen monoklonalen TNF-α-Antikörper. Die empfohlene Dosis von 40 mg wird alle zwei Wochen subkutan injiziert.
Das Fusionsprotein Etanercept (Enbrel®) ist zusammengesetzt aus zwei p75-Anteilen des TNF-α-Rezeptors, die an den Fc-Teil eines humanen Immunglobulins G1 (IgG1) gekoppelt sind. Die Initialtherapie erfolgt bei Plaque-Psoriasis als zweimal wöchentliche subkutane Injektion von 50 mg über die Dauer von zwölf Wochen. Die Erhaltungsdosis beträgt 50 mg pro Woche (zweimal wöchentlich 25 mg oder einmal wöchentlich 50 mg).
Der humane monoklonale TNF-α-Antikörper Golimumab (Simponi®) wurde von der europäischen Arzneimittelbehörde für die Behandlung der PsA zugelassen, nicht aber für die Psoriasis vulgaris. Golimumab wird einmal monatlich subkutan injiziert (50 mg). Bei Patienten mit einem Körpergewicht über 100 kg kann die Dosis auf 100 mg erhöht werden.
Certolizumab (Cimzia®), ein pegyliertes humanisiertes Antikörperfragment gegen TNF-α, besitzt im Gegensatz zu konventionellen Antikörpern keinen Fc-Teil. Ausreichende Stabilität wird durch zwei verknüpfte Polyethylenketten erreicht. Die Anfangsdosis beträgt 400 mg (zwei s.c. Injektionen zu je 200 mg) in Woche 0, 2 und 4, gefolgt von einer Erhaltungsdosis von 200 mg alle zwei Wochen. Soweit möglich sollte MTX während der Behandlung mit Certolizumab weiter verabreicht werden.
Generelle Kontraindikationen für TNF-α-Antagonisten sind akute oder chronische Infektionskrankheiten (insbesondere Tuberkulose), Herzinsuffizienz der Stadien NYHA III und IV sowie Schwangerschaft und Stillzeit.
Ustekinumab (Stelara®) ist ein humaner monoklonaler Antikörper, der sich mit hoher Affinität an zwei für die Pathogenese der Psoriasis zentrale Signalstoffe bindet, die Interleukine 12 und 23. Die Dosis von 45 mg wird zunächst in den Wochen 0 und 4, dann alle zwölf Wochen subkutan injiziert. Bei Patienten mit einem Körpergewicht über 100 kg kann die Dosis auf 90 mg verdoppelt werden.
Der Interleukin-17A-Inhibitor Secukinumab (Cosentyx®) wird in den Wochen 0, 1, 2 und 3, dann ab der vierten Woche einmal pro Monat subkutan injiziert. Bei Patienten mit PsA und gleichzeitiger mittelschwerer bis schwerer Plaque-Psoriasis oder Patienten, die auf TNF-α-Inhibitoren unzureichend ansprechen, liegt die Dosis bei 300 mg (= 2 Pens bzw. Spritzen), bei allen anderen Patienten mit PsA bei 150 mg.
6. PDE-4-Hemmer
Der Phosphodiesterase-4-Hemmer Apremilast ist zugelassen für die Behandlung von Erwachsenen mit mittelschwerer bis schwerer chronischer Plaque-Psoriasis, bei denen eine andere systemische Therapie nicht wirksam oder kontraindiziert ist oder nicht vertragen wurde. Außerdem kann Apremilast zur Behandlung der PsA eingesetzt werden, wenn eine vorangegangene DMARD-Therapie nicht erfolgreich war. Die Anfangsdosis beträgt einmal täglich 10 mg (oral) und wird innerhalb einer Woche schrittweise auf die empfohlene Dosis von zweimal täglich 30 mg gesteigert.
Frauen im gebärfähigen Alter müssen vor Behandlungsbeginn eine Schwangerschaft ausschließen sowie eine zuverlässige Verhütungsmethode während der Therapie anwenden. Da unter der Behandlung mit Apremilast mit einer Gewichtsabnahme zu rechnen ist, sollten besonders untergewichtige Personen regelmäßig kontrolliert werden. Ansonsten entfallen bei dem neuen Therapieansatz notwendige Überprüfungen der Laborwerte, die bei Biologicals und Basistherapeutika wie MTX und Leflunomid erforderlich sind.
7. – 10. Weitere EULAR-Empfehlungen
Bei Enthesitis oder Beteiligung des Achsenskeletts können TNF-α-Inhibitoren oder IL-Inhibitoren auch als First-Line-Therapie angewendet werden, wenn NSAR nicht ausreichend wirksam sind (7, 8).
Bei Versagen eines Biologicals sollte die Behandlung mit einem anderen Biological oder Apremilast fortgesetzt werden (9).
Bei der Therapieanpassung müssen außer der Krankheitsaktivität auch Begleiterkrankungen sowie die Sicherheit der Behandlung miteinbezogen werden (10).
GRAPPA-Empfehlungen zur Therapie der PsA
Die GRAPPA-Empfehlungen zur Therapie der PsA unterscheiden sich von den EULAR-Richtlinien durch eine praxisgerechtere Herangehensweise [9, 10]. Sie umfassen Behandlungsrichtlinien für alle Manifestationen der PsA: neben Arthritis, Spondylitis, Enthesitis und Daktylitis auch Haut- und Nagelbefall (s. Tab. 2). Weiterhin geben sie eine Evidenz-basierte Hilfestellung für die Auswahl eines adäquaten Medikaments.
Indikation |
starke Empfehlung |
schwache Empfehlung |
nicht empfohlen |
|---|---|---|---|
PsA, peripherer Befall, bei Ansprechen auf DMARDs |
DMARDs (MTX, Sulfasalazin, Leflunomid), TNF-α-Inhibitoren |
NSAR, Corticoide oral / i.a., Apremilast |
Ustekinumab*,
Secukinumab*
|
|
TNF-α-Inhibitoren, Ustekinumab, Apremilast |
NSAR, Corticoide oral / i.a., Secukinumab |
|
|
TNF-α-Inhibitoren |
NSAR, Corticoide oral / i.a., Ustekinumab, Secukinumab, Apremilast |
|
PsA mit Achsenskelettbeteiligung** |
NSAR, Physiotherapie, TNF-α-Inhibitoren |
Secukinumab, Cortison i.a. (Iliosakralgelenk), Bisphosphonate, (evtl. Ustekinumab) |
DMARDs, IL-6-Inhibitoren, CD20-Antikörper (z. B. Rituximab) |
|
NSAR, Physiotherapie |
TNF-α-Inhibitoren, Ustekinumab, Secukinumab |
|
Enthesitis |
TNF-α-Inhibitoren, Ustekinumab |
NSAR, Physiotherapie, Cortison i.a. (unter Vorsicht), Apremilast, Secukinumab |
DMARDs* |
Daktylitis |
TNF-α-Inhibitoren (Infliximab, Adalimumab, Golimumab, Certolizumab) |
Cortison i.a., DMARDs, Etanercept, Ustekinumab, Secukinumab, Apremilast |
|
Plaque-Psoriasis |
Topika, Phototherapie, DMARDs, TNF-α-Inhibitoren, Ustekinumab, Secukinumab, Apremilast |
||
Nagel-Psoriasis |
TNF-α-Inhibitoren, Ustekinumab |
Topika, DMARDs (Ciclosporin, Leflunomid, Acitretin, MTX), Secukinumab, Apremilast |
|
* keine Empfehlung aufgrund fehlender Evidenz ** basierend auf Daten von Patienten mit ankylosierender Spondylitis | |||
So liegt laut GRAPPA-Empfehlung bei vorherrschender peripherer Arthritis ohne vorangegangene DMARD-Therapie die beste Evidenz für DMARDs und TNF-α-Inhibitoren vor. Zur Gabe von NSAR, oralen oder intraartikulären (i. a.) Glucocorticoiden sowie Apremilast wird erst in zweiter Linie geraten, und von den IL-Inhibitoren Ustekinumab und Secukinumab wird wegen der derzeit fehlenden Evidenz abgeraten.
Sind DMARDs bei einer peripheren Arthritis allerdings nicht ausreichend wirksam, sollten TNF-α-Inhibitoren, Ustekinumab oder Apremilast zum Einsatz kommen. Hintenan stehen in diesem Fall NSAR, Glucocorticoide und Secukinumab.
Bei nicht ausreichendem Ansprechen auf einen TNF-α-Inhibitor wird der Wechsel auf einen anderen TNF-α-Inhibitor nahegelegt, und wiederum nur als zweite Wahl werden NSAR, Glucocorticoide, IL-Inhibitoren oder PDE‑4-Hemmer empfohlen.
Bei Enthesitis zeigen DMARDs keine ausreichende Wirkung. Hier werden bevorzugt TNF-α-Inhibitoren und Ustekinumab angeraten. Nur bedingt eingesetzt werden sollten NSAR, Physiotherapie, intraartikuläre Glucocorticoide, Apremilast und Secukinumab.
Bei Daktylitis richtet sich die Empfehlung primär auf die TNF-α-Inhibitoren Infliximab, Adalimumab, Golimumab oder Certolizumab, erst danach kann ein Therapieversuch mit DMARDs, Etanercept, IL-Inhibitoren oder Apremilast angeraten werden. |
Literatur
[1] Augustin M, Radtke M. Psoriasis – eine interdisziplinäre Herausforderung. Hautarzt 2011;62:779-792
[2] Moll JM, Wright V. Psoriatic arthritis. Semin Arthritis Rheum 1973;3(1):55-78
[3] Kahl C, Hansen B, Reich K. „Stiefkind“ Nagelpsoriasis – Pathogenese, Diagnostik, Therapie. Hautarzt 2012;63:184-191
[4] Langenbruch A et al. Nail involvement as a predictor of concomitant psoriatic arthritis in patients with psoriasis. Br J Dermatol 2014;171:1123-1128
[5] Herold M, et al. Rheumatoide Arthritis, Psoriasisarthritis, Spondylarthritis. Kurzfassung, 2013. www.rheumatologie.at/pdf/OeGR_Pocket_Guide_Rheuma.pdf
[6] Boehncke W et al. Psoriasis-Arthritis – eine interdisziplinäre Herausforderung. Dtsch Ärztebl 2006;103(21):1455-1461
[7] Gossec L et al. European League Against Rheumatism (EULAR) recommendations for the management of psoriatic arthritis with pharmacological therapies: 2015 update. Ann Rheum Dis 2016;75:499-510
[8] Coates LC et al. Effect of tight control of inflammation in early psoriatic arthritis (TICOPA): a UK multicentre, open-label, randomised controlled trial. Lancet 2015;386:2489-2498
[9] Coates LC et al. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis Treatment Recommendations for Psoriatic Arthritis. Arthritis Rheumatol; Epub 8.1.2016
[10] Kathmann W. Zielgerichtetes Vorgehen: GRAPPA-Empfehlungen zur Therapie der Psoriasis-Arthritis vorgestellt. www.springermedizin.de, 3.12.2015
[11] Fachinformationen der Hersteller





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.