
- DAZ.online
- DAZ / AZ
- DAZ 15/2016
- Biologicals richtig ...
Psoriasis
Biologicals richtig anwenden
Beratungstipps für Patienten mit schwerer Psoriasis
Biologicals sind biotechnologisch hergestellte, rekombinante Proteine, die parenteral (subkutan oder intravenös) appliziert werden müssen, da sie bei einer oralen Einnahme durch Proteasen im Gastrointestinaltrakt abgebaut werden. Bei der Psoriasis kommen TNF-α-Inhibitoren und Interleukin (IL)-Inhibitoren zum Einsatz, um die Fehlregulierung des Immunsystems an Haut und Gelenken zu stoppen. Zurzeit sind vier Biologicals für die Zweit-Linien-Therapie von Erwachsenen – teilweise auch von Kindern – mit mittelschwerer bis schwerer chronischer Psoriasis vulgaris (Schuppenflechte) oder Psoriasis-Arthritis (PsA) zugelassen: die drei TNF-α-Inhibitoren Adalimumab, Etanercept und Infliximab sowie der IL-12/23-Inhibitor Ustekinumab. Sie werden angewendet, wenn andere systemische Therapien keinen ausreichenden Erfolg gezeigt haben oder unverträglich bzw. kontraindiziert sind. Zudem kann Secukinumab, ein IL-17A-Inhibitor, zur Erstlinientherapie bei mittelschwerer bis schwerer Psoriasis vulgaris verabreicht werden, zur Therapie der PsA hingegen nur, wenn andere systemische Behandlungsoptionen zuvor ausgeschöpft wurden.
Der Einsatz der TNF-α-Inhibitoren Certolizumab pegol und Golimumab erfolgt bei schweren Gelenkentzündungen; sie sind nicht zur Therapie psoriatischer Hautveränderungen zugelassen.
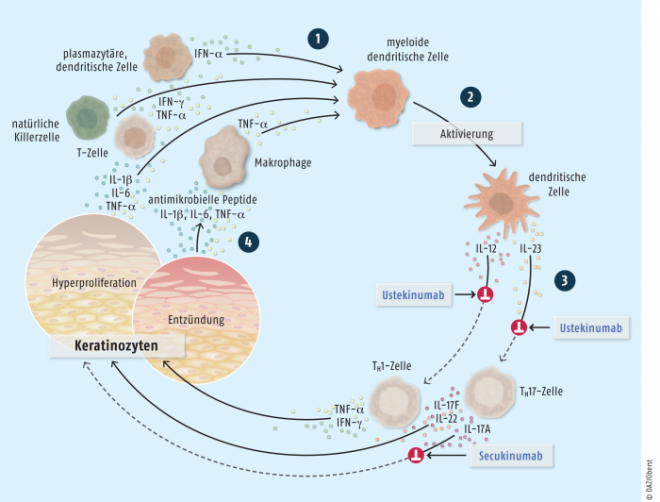
Wirkmechanismen von Interleukin-Inhibitoren bei Psoriasis. Ursache der Psoriasis ist eine Überaktivität von Immunzellen, die Zytokine wie TNF-α ausschütten (1) und dadurch myeloide dendritische Zellen aktivieren (2). Die aktivierten Zellen sezernieren die Interleukine 12 und 23, die T-Helferzellen aktivieren (3). TH1-Zellen halten durch die Sekretion von TNF-α und Interferon-γ die Entzündungsprozesse (z. B. der Gelenke) in Gang (4), während TH17-Zellen durch die Sekretion von Interleukin 17A die übermäßige Proliferation der Keratinozyten (Haut) veranlassen, die wiederum das Immunsystem aktiviert. Die Biologicals Ustekinumab und Secukinumab unterbrechen diesen Kreislauf, indem sie Interleukine hemmen (rote Symbole).
2 in 1
Bei gleichzeitigem Auftreten von Schuppenflechte und einer PsA sind die TNF-α-Antagonisten gegenüber den konventionellen Arzneimitteln zu bevorzugen, da sie neben den Hautsymptomen auch die Gelenkentzündungen entscheidend verbessern (Tab. 1). Grundsätzlich gibt es für die Wahl eines bestimmten Biologicals keine Vorgaben, vielmehr sind Begleiterkrankungen, die Einnahme weiterer Arzneimittel, die Compliance des Patienten und individuelle Therapieziele von Bedeutung [1]. Bei der PsA zeigen die TNF-α-Antagonisten Infliximab, Adalimumab und Etanercept eine vergleichbare Wirkung. Hingegen ist Etanercept bei Psoriasis vulgaris weniger wirksam als die anderen beiden genannten Antikörper. Daher werden in den ersten Behandlungswochen meist höhere Etanercept-Dosen von zweimal 50 mg pro Woche eingesetzt, um eine deutliche Verbesserung der Hautsymptome zu erzielen [2]. Für Secukinumab konnte gegenüber Etanercept und Ustekinumab eine signifikante Überlegenheit hinsichtlich der Verbesserung von Hautsymptomen und der Lebensqualität nachgewiesen werden. Zudem wurde ein schnelleres Ansprechen gezeigt [3].
|
Mit zusätzlicher Wirksamkeit auf Hautsymptome: TNF-α-Inhibitoren: Adalimumab, Etanercept, Infliximab IL-Inhibitoren: Secukinumab, Ustekinumab
Ohne Wirksamkeit auf Hautsymptome: TNF-α-Inhibitoren: Certolizumab, Golimumab
|
Wichtige Hinweise vor der Therapie
Vor einer Therapie mit Biologicals müssen (wegen der immunsuppressiven Wirkung) schwere Infektionskrankheiten, vor allem eine akute oder latente Tuberkulose oder eine Hepatitis B, sicher ausgeschlossen werden. Während der Therapie sind regelmäßige Laborkontrollen (Blutbild, Leber-, Nierenfunktionswerte) vorzunehmen.
Für Patienten, die mit Biologicals behandelt werden, gibt es spezielle Hinweiskarten mit Warnhinweisen (beim behandelnden Arzt erhältlich). Die Hinweiskarten machen die Patienten u. a. darauf aufmerksam, dass sie anfälliger für schwere Infektionen sind und deshalb bei den ersten Anzeichen eines Infekts unbedingt den Arzt aufsuchen sollten. Während einer Biological-Therapie darf der Patient nicht mit Lebendimpfstoffen geimpft werden. Das Risiko für Lymphome kann steigen.
Kontraindiziert sind Biologicals in Schwangerschaft und Stillzeit. Frauen im gebärfähigen Alter sollten eine zuverlässige Verhütungsmethode während der Behandlung und einige Monate danach anwenden (bis zu 6 Monate: Golimumab, Infliximab; 5 Monate: Adalimumab, Certolizumab, Secukinumab; 15 Wochen: Ustekinumab; 3 Wochen: Etanercept).
Schritt für Schritt erklären
Die sieben Biologicals (einschließlich Biosimilars) zur Therapie der Psoriasis-Arthritis werden in verschiedenen Dosierungen oder Darreichungsformen angeboten; die Applikation erfolgt meistens mithilfe einer Fertigspritze (FS) oder eines Pens (Tab. 2).
Arzneistoff, Handelsname, Darreichungsformen |
Dosierung bei Psoriasis vulgaris (PsV) und Psoriasis-Arthritis (PsA) |
Hinweise |
|---|---|---|
Adalimumab, Humira® 40 mg FS, Pen
|
PsV: initial: 80 mg s.c., dann 40 mg jede oder jede 2. Wo
PsA: 40 mg s.c. alle 2 Wo
|
FS / Pen darf bis 14 d bei max. 25 °C gelagert werden; bei PsV zugelassen ab 4 J., Dosis nach kg KG** |
Etanercept, Enbrel® 25 / 50 mg FS, 50 mg Pen, 10 mg für Kinder / 25 mg Durchstechflasche; Biosimilar: Benepali® 50 mg Injektionslösung
|
PsV: initial: 2 × 50 mg s.c./Wo; dann 2 × 25 mg/Wo oder 1 × 50 mg/Wo
PsA: 2 × 25 mg s.c./Wo oder 1 × 50 mg/Wo
|
FS / Pen kann bis 4 Wo bei max. 25 °C gelagert werden; bei PsV zugelassen ab 6 J., Dosis: 0,8 mg/kg KG |
Infliximab, Remicade® 100 mg Durchstechflasche; Biosimilars: Inflectra®, Remsima®
|
PsV und PsA: 5 mg/kg KG i.v.-Infusion in Wo 0, 2 und 6; dann alle 8 Wo |
Infusion durch den Arzt,keine Selbstinjektion! |
Secukinumab, Cosentyx® 150 mg FS, Pen
|
PsV und PsA*: jeweils 300 mg s.c. in Wo 0, 1, 2 und 3; ab 4. Wo 1 × 300 mg/Monat (= 2 Pens bzw. Spritzen) |
First-line-Therapie bei PsV, Second-line-Therapie bei PsA |
Ustekinumab, Stelara® 45 mg Injektionslösung, 45/90 mg FS
|
PsV und PsA: 45 mg s.c. in Wo 0 und 4, dann alle 12 Wo; Patienten > 100 kg: 90 mg |
bei PsV zugelassen ab 12 J., Dosis nach kg KG** |
Certolizumab, Cimzia® 200 mg FS
|
PsV: keine Zulassung
PsA: initial: 400 mg s.c. in Wo 0, 2 und 4; Erhaltungsdosis: 200 mg alle 14 Tage (oder: 400 mg/4 Wo), möglichst kombiniert mit MTX
|
maximal 2 h über 8 °C lagern |
Golimumab, Simponi® 50 / 100 mg FS, Injektor
|
PsV: keine Zulassung
PsA: 1 × 50 mg s.c./Monat, jeweils am selben Tag des Monats; Patienten > 100 kg KG: 1 × 100 mg/Monat
|
|
* bei Patienten mit PsA und gleichzeitiger mittelschwerer bis schwerer PsV (Plaque-Psoriasis) sowie bei Patienten mit PsA, die auf TNF-α-Inhibitoren unzureichend ansprechen; bei allen anderen Patienten mit PsA jeweils die halbe Dosis: 150 mg; ** siehe Fachinfo | ||
Wer die Selbstinjektion praktiziert, muss die richtige Vorgehensweise kennen (s. Kasten "Vorgehensweise: Subkutane Injektion"). Die subkutane Injektion erfolgt in die Vorderseite der Oberschenkel oder in den Bauch, nicht jedoch im Radius von 5 cm um den Bauchnabel herum. Es sollte auch nicht in eine gerötete, verletzte oder verhärtete Hautstelle sowie in Psoriasis-Plaques injiziert werden. Bei jeder Anwendung ist eine andere Injektionsstelle zu wählen. Um dem Patienten die korrekte Handhabung seines verordneten Präparats (Fertigspritze, Pen, Injektor) zu erklären, empfiehlt es sich, gemeinsam die wichtigsten Schritte mithilfe der anschaulichen Abbildungen in der Gebrauchsanweisung durchzusprechen [10].
Vorgehensweise: Subkutane Injektion
- Packung mit der Fertigspritze oder dem Pen aus dem Kühlschrank nehmen und 15 bis 30 Minuten lang ungeöffnet bei Raumtemperatur stehen lassen.
- Gründlich die Hände mit Wasser und Seife waschen.
- Injektionsstelle (intakte Haut) mit einem Alkoholtupfer reinigen; desinfizierte Hautstelle 30 Sekunden lang trocknen lassen; vor der Injektion nicht noch einmal berühren.
- Aussehen der Fertigspritze / des Pens kontrollieren. Die Flüssigkeit sollte klar sein. Nicht verwenden, wenn die Flüssigkeit deutlich sichtbare Partikel enthält, trübe erscheint oder eine eindeutig braune Färbung aufweist. Flüssige Zubereitungen nicht schütteln (sonst: Veränderung der Quartärstruktur der Proteine und Inaktivierung).
- Schutzkappe entfernen.
- Bei Fertigspritze: Hautfalte bilden, Nadel im 45°-Winkel zügig und vollständig einstechen, dann langsam und vollständig injizieren. Nadel mit heruntergedrücktem Kolben herausziehen und Hautfalte loslassen. Bei Pen: Nadel im 90 °-Winkel ansetzen, dann Auslöseknopf drücken. Hörbares zweites Klicken und verfärbtes Sichtfenster zeigen erfolgreiche Applikation an. Pen von der Injektionsstelle abheben.
- Schutzkappe nicht wieder aufsetzen. Spritze / Pen sofort in Entsorgungsbox entsorgen.
- Kühlen der Einstichstelle mit einem Kühlpack vor und nach der Injektion, um allergische Reaktion zu vermeiden.
Besonderheiten der Präparate
Adalimumab (Humira®) steht als Pen oder Fertigspritze zur Selbstinjektion zur Verfügung.
Um mit dem Pen eine Injektion vorzunehmen, muss sowohl die graue Schutzkappe als auch die rote Kappe am Ende des Pens abgezogen werden. Damit ist der Pen bereits aktiviert. Die weiße Nadelschutzhülle wird in einem 90°-Winkel auf die Injektionsstelle aufgesetzt, dann wird der rote Aktivierungsknopf bis zu einem klickenden Geräusch heruntergedrückt. Dieses Klicken signalisiert das Ende der Injektion. Im Sichtfenster muss eine komplett gelbe Anzeige erscheinen.
Bei der Anwendung der Fertigspritze wird zunächst die Schutzkappe von der Nadel entfernt und die Spritze danach in einem 45°-Winkel in eine gebildete Hautfalte gesetzt und langsam injiziert. Hierbei muss auf eine ausreichende Einstichtiefe geachtet werden, da sonst ein sehr unangenehmes Brennen an der Injektionsstelle auftreten kann. Wie beim Pen ist ca. zehn Sekunden zu warten, ehe die Nadel mit gedrücktem Kolbenkopf aus der Haut gezogen wird.
Etanercept (Enbrel®; Biosimilar: Benepali® Injektionslösung) ist als Fertigspritze, als Pen und als Lyophilisat mit separatem Lösungsmittel zur subkutanen Injektion erhältlich. Die Anwendung der Fertigspritze entspricht der Selbstinjektion von Humira® (45°-Winkel, Hautfalte).
Bei der Anwendung des Pens wird zuerst die weiße Verschlusskappe entfernt. Danach ist er im 90°-Winkel auf die Injektionsstelle aufzusetzen. Mit dem Daumen wird der grüne Auslöseknopf gedrückt und beim ersten Klickgeräusch sofort wieder losgelassen, um die Injektion zu starten. Nach einem zweiten Klicken ist die Injektion beendet, der Pen kann dann von der Haut abgehoben werden. Das Kontrollfenster des Pens sollte jetzt vollständig violett sein. Ein einmal ausgelöster, aber nicht injizierter Pen ist zu verwerfen.
Falls ein Lyophilisat verordnet ist, muss der Patient die gebrauchsfertige Injektionslösung jeweils direkt vor der Anwendung herstellen. In der Packung befinden sich eine Durchstechflasche mit gefriergetrocknetem Pulver, eine Fertigspritze mit sterilem Wasser zum Auflösen des Pulvers, ein Adapter für die Durchstechflasche, zwei Alkoholtupfer sowie eine Kanüle zur Injektion. Zunächst wird die Kunststoff-Verschlusskappe von der Durchstechflasche abgehoben, der graue Gummistopfen mit einem Alkoholtupfer gereinigt und mit dem Adapterdorn durchstochen. Daraufhin rastet die Adapterfassung hörbar ein. Erst jetzt wird die Plastikverpackung vom Adapter entfernt und die weiße Verschlusskappe entlang der Sollbruchstelle von der Spritze abgebrochen. Die Spritze wird nun mit dem Adapter verbunden und das Lösungsmittel langsam und ohne Aufschäumen aus der Spritze in die Durchstechflasche gegeben. Die Spritze verbleibt mit der Kanüle auf dem Fläschchen, dessen Inhalt mit kreisenden Bewegungen vorsichtig durchmischt wird. Durch die Kanüle wird die Lösung in die Spritze aufgezogen. Die befüllte Spritze wird vom Adapter abgedreht und mit der zweiten in der Packung beiliegenden Kanüle verbunden. Nach Entfernen der Schutzhülle erfolgt die Injektion.
Golimumab (Simponi®) befindet sich in einem vorbefüllten Injektor oder in einer Fertigspitze.
Beim Injektor wird zunächst die Kappe leicht gedreht, um das Sicherheitssiegel zu durchtrennen. Anschließend wird die Kappe abgezogen, der Injektor im 90°-Winkel fest auf die gewählte Hautstelle aufgesetzt und der seitliche Auslöseknopf gedrückt. Ein erstes hörbares Klicken bedeutet, dass die Injektion begonnen hat. Der Injektor muss weiterhin fest auf die Haut gedrückt werden, bis ein zweites Klicken das Ende der Injektion signalisiert. Danach wird der Injektor von der Injektionsstelle abgehoben. Nach erfolgreicher Injektion verfärbt sich das Sichtfenster gelb.
Die Simponi®-Fertigspritze wird wie die Humira®-Fertigspritze verabreicht.
Ustekinumab (Stelara®) wird zur subkutanen Injektion aus einer Durchstechflasche entnommen. Dazu wird die Kappe von der Flasche entfernt und der Gummistopfen mit einem Alkoholtupfer gereinigt. Nach dem Entfernen der Schutzhülle wird die Nadel durch den Gummistopfen gestoßen und die Lösung in die Spritze aufgezogen. Anschließend wird die Nadel aus der Durchstechflasche herausgezogen und in die gebildete Hautfalte gestochen, worauf die gesamte Flüssigkeit unter die Haut injiziert wird.
Ustekinumab steht auch als Fertigspritze zur Verfügung. Hier wird der Nadelschutz gerade von der Spritze abgezogen und das Arzneimittel durch Herunterdrücken des Kolbens appliziert. Das Nadelschutzsystem wird aktiviert, wenn der Kolben vollständig heruntergedrückt und der gesamte Spritzeninhalt injiziert ist. Die Nadel kann dann herausgezogen werden. Nach dem Loslassen des heruntergedrückten Kolbens bewegt sich die Nadel nach oben, bis sie ganz vom Nadelschutz bedeckt ist.
Secukinumab (Cosentyx®) kann vom Patienten subkutan mit Pen oder Fertigspritze appliziert werden (siehe Ustekinumab). Tritt an der Injektionsstelle etwas Blut aus, kann für etwa zehn Sekunden ein Verbandsmull auf die Injektionsstelle gedrückt werden.
Die Certolizumab-Fertigspritze (Cimzia®) wird analog zu den anderen Fertigspritzen verabreicht. Nach Entfernen der Kappe wird die Spritze in einem Winkel von 45° mit einer raschen, kurzen Bewegung in die gebildete Hautfalte gestochen. Der Kolben muss vollständig heruntergedrückt werden, um die gesamte Lösung zu injizieren.
Infliximab (Remicade®, Biosimilars: Inflectra®, Remsima®) ist im Gegensatz zu den anderen Biologicals nicht zur subkutanen Injektion geeignet, sondern wird vom Arzt als intravenöse Infusion verabreicht. Um die Infusionslösung zuzubereiten, muss das Pulver zunächst in 10 ml Wasser für Injektionszwecke gelöst werden. Das Lyophilisat wird durch Rollen der Durchstechflasche zwischen den Handflächen und vorsichtiges Schwenken in Lösung gebracht. Anschließend wird der Inhalt der Flasche mit 0,9-prozentiger NaCl-Lösung gemischt und ist dann fertig für die Infusion.
Das gewisse Extra
Einige Firmen bieten verschiedene kostenlose Extras rund um die Psoriasisbehandlung an [10]. Dazu gehören ein Sammelbehälter zur Entsorgung der benutzten Pens oder Spritzen, ein Terminplaner und ein Tagebuch sowie eine spezielle Kühltasche zum Transport des Arzneimittels auf Reisen.
Für Stelara®-Patienten hat der Hersteller Janssen-Cilag den Psoriasis Termin Service entwickelt, der die Patienten telefonisch oder per SMS rechtzeitig an den nächsten Behandlungstermin in der Praxis erinnert.
Patienten, die mit Simponi® (Fa. Essex) therapiert werden, erhalten mit einem gewissen Code auf der Internetseite www.just-for-me.de Zugang zu einem speziellen Patientenunterstützungsprogramm.
Die Firma Pfizer bietet Enbrel®-Patienten über das Together-Programm nützliche Materialien und Dienstleistungen rund um die Therapie an. Hierzu zählen ein individuelles Injektionstraining im häuslichen Umfeld, Schulungsvideos, Beratungsgespräche durch Fachkräfte, eine kostenfreie Service-Hotline für Patientenfragen sowie Informationsbroschüren zu verschiedenen Themen wie Schwangerschaft und Impfungen während der Biological-Behandlung.
Die Apotheke kann den Patienten praktische Tipps für den Transport ihrer Arzneimittel auf Reisen geben. Bei Auslandsreisen sollte der Patient immer ein ärztliches Attest und weitere Infos in mehreren Sprachen mit sich führen (z. B. falls der Zoll sich für die Präparate interessiert). Während des Fluges sind Biologicals unbedingt in einer Kühltasche aufzubewahren, entweder im Handgepäck oder noch besser im Bordkühlschrank, keinesfalls jedoch im Frachtraum des Flugzeugs.
Doch nicht nur für die schönste Zeit des Jahres, den Urlaub, haben Psoriasis-Patienten einen hohen Informationsbedarf. Wichtig ist es daher, ihnen in allen Lebenslagen als kompetente Ansprechpartner vor Ort zur Verfügung zu stehen, um ihnen den Alltag mit ihrer Erkrankung zu erleichtern. |
Literatur
[1] Augustin M, Radtke M. Psoriasis – eine interdisziplinäre Herausforderung. Hautarzt 2011;62:779-792
[2] S3-Leitlinie zur Therapie der Psoriasis vulgaris. AWMF-Leitlinien-Register Nr. 012/001, Update 2011
[3] Fachinformation Cosentyx® 150 mg Injektionslösung in einem Fertigpen (Stand April 2015): CLEAR-und FIXTURE-Studie
[4] Fachinformation Humira® 40 mg Injektionslösung im Fertigpen (Stand Juli 2015)
[5] Fachinformation Enbrel® 50 mg Injektionslösung im Fertigpen (Stand April 2015)
[6] Fachinformation Remicade® 100 mg Pulver für ein Konzentrat zur Herstellung einer Injektionslösung (Stand April 2015)
[7] Fachinformation Stelara® 45 mg Injektionslösung (Stand Juli 2015)
[8] Fachinformation Cimzia® 200 mg Injektionslösung (Stand Mai 2015)
[9] Fachinformation Simponi® 50 mg / 100 mg Injektionslösung im vorgefüllten Injektor (Stand November 2015)
[10] Winterhagen I. Beratungspraxis Psoriasis. Deutscher Apotheker Verlag, Stuttgart 2011
Autorin
Ines Winterhagen hat in Marburg Pharmazie studiert und ist seit der Approbation 2003 in der öffentlichen Apotheke tätig. Sie ist Fachapothekerin für Offizinpharmazie, Homöopathie und Naturheilkunde. In der Reihe „Beratungspraxis“, die im Deutschen Apotheker Verlag erscheint, schrieb sie die Bücher „Neurodermitis“ und „Psoriasis“. Sie ist Referentin und Mitglied im Weiterbildungsausschuss der LAK Baden-Württemberg.






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.