
- DAZ.online
- DAZ / AZ
- DAZ 14/2015
- Defekt
Lieferengpässe
Defekt!
Arzneimittel-Lieferengpässe haben vielfältige Ursachen – die eine Lösung gibt es nicht
Die „Diefenbach-Listen“
Das ehemalige Vorstandsmitglied des Hessischen Apothekerverbandes (HAV) Dr. Hans Rudolf Diefenbach hat sich durch seine nachhaltigen Bemühungen um Transparenz hinsichtlich der Lieferengpässe besondere Verdienste erworben. Diese sollen hier eingangs noch einmal kurz rekapituliert werden.
- Erstmals hatte Diefenbach im März 2014 eine Auswertung seiner von 430 Apotheken gesammelten Defektlisten präsentiert, die den Zeitraum vom 1. Januar bis zum 28. Februar 2014 abdeckten. Sie hatten eine große Bandbreite an Ausfällen offenbart. Unter anderem zeigten sich massive Lieferengpässe bei trizyklischen Antidepressiva (Amitriptylin), nichtopioiden (Diclofenac) wie auch Opioid-Analgetika (Tilidin), Hypnotika (Zopiclon, Zolpidem), Betablockern (Metoprolol, Bisoprolol) und der gesamten Schilddrüsenhormonpalette, ebenso bei Osteoporosemitteln, oralen Antidiabetika (Metformin) und einer ganzen Reihe von Antibiotika, jeweils bezogen auf bestimmte Hersteller (DAZ.online vom 14.03.2014).
- Vor dem Deutschen Apothekertag 2014 wollte Diefenbach dann feststellen, inwieweit sich die Situation zwischenzeitlich geändert hatte. Die Auswertung von 150 Defektlisten aus der ganzen Republik, die die Zeit vom 1. Juli bis zum 15. Augst 2014 betrafen, erfasste dieses Mal ausschließlich rezeptpflichtige Arzneimittel. Die betroffenen Unternehmen waren laut Diefenbach nahezu identisch, die Schwerpunkte jedoch anders: Unter zehn relevanten Arz-neimittelgruppen erneut dabei waren Antibiotika (vor allem Cefixim und Ciprofloxacin). Hinzu kamen unter anderem Corticoide (Mometason), der Protonenpumpenhemmer Pantoprazol, Simvastatin und Blutdrucksenker, jeweils von einzelnen Herstellern. Lücken gab es auch bei Antidiabetika, Psychopharmaka und Schlafmitteln. Eine gewisse Entspannung zeigte sich für die Schilddrüsenhormone (DAZ.online vom 15.09.2014).
- Unlängst präsentierte der hessische Apotheker dann die dritte Auswertung von Defektlisten von 137 Apotheken nach einer neuerlichen bundesweiten Befragung, ebenfalls nur zu Rx-Arzneimitteln und ohne Impfstoffe. Nach Diefenbachs Einschätzung ist die Breite der Nichtlieferbarkeit von Arzneimitteln der vor einem Jahr festgestellten Sachlage ebenbürtig. Besonders betonte er die Lücken bei Wirkstoffen der Substitutionsausschlussliste, wie etwa L-Thyroxin oder Betaacetyldigoxin. In der Gruppe der Ophthalomologika war offenbar die Darreichungsform Salbe über Monate hinweg so gut wie nicht verfügbar. Auch Antibiotika bereiten weiterhin Sorgen, und Lieferengpässe nehmen immer mehr Breite im Gesamtsortiment ein (DAZ.online vom 17.02.2015 und vom 10.03.2015).
Kahlschläge auch im Krankenhaus
Aber nicht nur in der öffentlichen Apotheke, sondern offenbar auch in der Krankenhausversorgung tun sich mehr und mehr Lücken auf. Schon im Jahr 2012 hatte der Bundesverband deutscher Krankenhausapotheker (ADKA) reklamiert, dass dort zunehmend lebenswichtige Medikamente fehlten und Alarm geschlagen. Das Problem ziehe sich durch alle Arzneimittelgruppen (DAZ.online vom 12.06.2012).
Dass die deutschen Krankenhausapotheker damit in Europa nicht alleine dastehen, belegt eine Umfrage, die die Europäische Vereinigung der Krankenhausapotheker (EAHP) im letzten Jahr unter mehr als 600 Krankenhausapothekern in 36 europäischen Ländern durchgeführt hat, die größte Erhebung dieser Art jemals. Das Hauptergebnis: Allerorten auf dem gesamten Kontinent gibt es Arzneimittelengpässe. Rund 87 Prozent der Befragten gaben an, mindestens einmal im Monat Probleme bei der Beschaffung von Medikamenten zu haben, 66 Prozent wöchentlich oder sogar täglich. Bei knapp 52 Prozent der Apotheker fehlten am häufigsten Originalarzneimittel. Rund 36 Prozent bezeichneten die Generika (einschließlich Marken-Generika) als die am stärksten betroffene Kategorie. Hinsichtlich der Indikationsbereiche führten antimikrobielle Mittel und onkologische Präparate die Mängelliste an. Dann folgten Notfallmedikamente und kardiovaskuläre Mittel und Anästhetika. „Das Problem wurde viel zu lange unter den Teppich gekehrt. Die EU muss jetzt handeln“, hatte EAHP-Präsident Dr. Roberto Frontini bei der Vorstellung des Berichts in Brüssel festgestellt (DAZ.online vom 24.11.2014).
Wacht die Politik langsam auf?
Die Politik gibt sich bis dato angesichts des Problems relativ abwartend bis „behäbig“. Erstmals fand im Jahr 2013 vor dem Hintergrund steigender Lieferengpässe ein Multi-Stakeholder-Dialog im Bundesgesundheitsministerium (BMG) statt.
Im März 2014 hieß es dann in einer Antwort auf eine Kleine Anfrage der Linksfraktion relativ entspannt, man rechne damit, dass es auch künftig Schwierigkeiten bei der Lieferung von Impfstoffen und anderen Arzneimitteln geben könne, allerdings seien sie häufig nicht von langer Dauer und müssten auch nicht zwangsläufig zu Versorgungsengpässen führen. Weder eine gesetzliche Verpflichtung der Hersteller zur Vorratshaltung wurde seinerzeit für erforderlich gehalten noch eine Ausweitung der Rechte der Behörden im Hinblick auf deren Kontrollbefugnisse.
Wenige Monate später klang das schon etwas anders: Die Bundesregierung beobachte die Entwicklung sehr genau. Eine Verschärfung der Situation lasse sich aktuell nicht erkennen, schrieb die Parlamentarische Staatssekretärin im BMG Annette Widmann-Mauz (CDU) Mitte August 2014 in ihrer Antwort auf eine weitere Kleine Anfrage, diesmal der Grünen-Fraktion. Über weitergehende Maßnahmen werde man abhängig von der weiteren Entwicklung der Situation entscheiden. Die Ausweitung des derzeitigen freiwilligen in ein verpflichtendes und erweitertes Melderegister zu aktuellen Lieferengpässen sowie eine Liste klinisch unentbehrlicher Medikamente werde bereits diskutiert.
Wachgerüttelt scheint die Politik in der Zwischenzeit demnach immerhin zu sein, denn Lieferengpässe stehen auch auf der Agenda des Pharma-Dialogs, der am 15. September 2014 gestartet wurde, recht weit oben (siehe DAZ-Interview mit Bundesgesundheitsminister Hermann Gröhe in DAZ 2014, Nr. 37, S. 20 – 22).
Papier der Herstellerverbände
Die pharmazeutische Industrie geht in einem gemeinsamen Papier der Herstellerverbände BAH, BPI, Pro Generika und vfa von Mai 2014 auf ihre Sichtweise hinsichtlich der Lie-ferengpässe ein. Die Herstellung von Arzneimitteln als besondere Güter könne nicht „auf Zuruf“ angepasst, umgestellt oder erhöht werden, heißt es dort. Reguläre Vorlaufzeiten von der Produktionsplanung bis zur Auslieferung von Arzneimitteln lägen im Durchschnitt bei circa sechs Monaten. Wenn Krankenkassen im Rahmen von Rabattverträgen mit Unternehmen Liefervereinbarungen eingehen, bedeute dies im Umkehrschluss, dass Firmen, die nicht berücksichtigt wurden, ihre Produktionsstätten mit der Herstellung anderer Medikamente auslasten. Falle nun eines der Rabattvertragsunternehmen aus, könnten die anderen den plötzlich eintretenden Mehrbedarf im Regelfall nicht decken.
Als weiterer Faktor für mögliche Verknappungen wird die stark steigende globale Nachfrage nach Arzneimitteln und ihren Wirkstoffen angeführt. Hiermit könnten der Bau neuer Produktionsstätten für Wirkstoffe und Arzneimittel und deren behördliche Freigabe zeitlich nicht Schritt halten. Vom Beginn der Arbeiten bis zur behördlichen Abnahme einer Produktionsstätte könnten bis zu fünf Jahre vergehen.
Das neue IMS-Gutachten
Weitere Erkenntnisse zu den möglichen Ursachen von Liefer- und Versorgungsengpässen in Deutschland und ausgewählten Ländern (Niederlande, Finnland, Frankreich, Großbritannien, Kanada, Schweiz und USA) liefert das Gutachten „Best-Practice-Ansätze bei Arzneimittelengpässen im internationalen Vergleich“ von IMS Health im Auftrag von Pro Generika, das am 24. März 2015 in Berlin vorgestellt wurde. Der Fokus des Gutachtens ist der Generikamarkt, der mit einem Versorgungsanteil von 75 Prozent der DDD die Grundlage der Arzneimittelversorgung in Deutschland darstellt. Gerade hier führt der Preisdruck zu einer kostenoptimierten Arzneimittelherstellung und -distribution. Zusätzlich bewirken die Rabattverträge große Schwankungen in der Produktion und eine mangelhafte Planungssicherheit bei den Unternehmen.
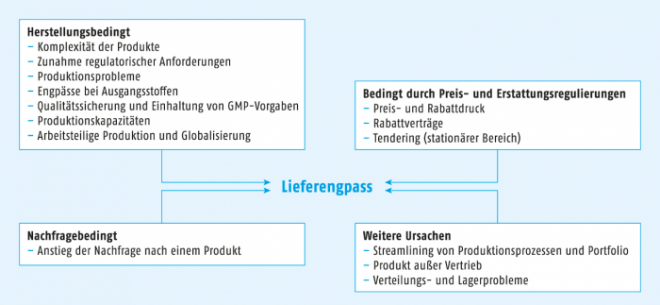
In allen untersuchten Ländern werden nach dem Gutachten die gleichen Ursachen für Engpässe benannt (s. Abbildung), die jeweils einen unterschiedlich starken Einfluss auf die Engpasssituation haben.
Ursachen für Arzneimittel-Lieferengpässe nach Angaben des IMS-Gutachtens zu Lieferengpässen 2015.
Kernfaktor Wirkstoffe
Die ausreichende Bereitstellung von Wirkstoffen (API) gilt gemeinhin als einer der Kernfaktoren für die Sicherheit der Versorgung mit den fertigen Präparaten. Insofern lohnt zum besseren Verständnis der Materie ein kleiner Einblick in wichtige derzeitige Trends im weltweiten Wirkstoff-Markt. Nach Informationen aus diversen aktuellen Erhebungen namhafter internationaler Marktforschungsunternehmen (u. a. Markets and Markets, MDTV Alliance, Research and Markets, Market Watch, Transparency Market Research) wurde der Wert des globalen API-Marktes im Jahr 2012 auf rund 113 Milliarden US-Dollar geschätzt, wobei bis 2019 eine kontinuierliche jährliche Wachstumsrate von knapp 8 Prozent prognostiziert wird. Die Marktentwicklung wird nach Meinung der Experten insgesamt getrieben von dem Sektor der hochaktiven Wirkstoffe (High Potency Active Pharmaceutical Ingredient (HPAPI)) und den BioGenerika, da von den entsprechenden Präparaten der höchste Benefit zu erwarten ist. Allerdings soll dadurch auch das gesamtwirtschaftliche Wachstum des API-Marktes beflügelt werden. Das generische Segment wächst demgegenüber aufgrund der zunehmenden weltweiten Nachfrage volumenmäßig am stärksten.
Wo kommen die Wirkstoffe her?
Der Markt mit weltweit mehr als 2000 Unternehmen und über 5000 Produktionsstätten ist sehr kompetitiv. Geografisch betrachtet hat Nordamerika die Nase vorn im weltweiten API-Markt (43 Prozent in 2012), aber die Region Asien-Pazifik (ca. 28 Prozent in 2012) legt aufgrund von Patentabläufen, niedrigen Betriebskosten, Dienstleistungen im Bereich der Auftragsherstellung (CMO) und hohen Investitionen in die medizinische Forschung am schnellsten zu. Nach der Wirtschaftskrise haben vor allem Indien und China zunehmend an Boden gewonnen.
Der führende internationale Anbieter von APIs hat seinen Hauptsitz in Israel in der Nähe von Tel Aviv. Teva Active Pharmaceutical Ingredients (TAPI) verfügt über das branchenweit umfassendste Portfolio von über 300 API-Produkten und beschäftigt weltweit mehr als 5000 Mitarbeiter an über 20 Standorten, darunter in Italien, Ungarn, Tschechien, Kroatien, Israel, Indien, China, Mexiko, Puerto Rico und den USA.
Große Ansammlungen von Wirkstoffherstellern befinden sich in Asien speziell in Indien und China. In Indien produzieren Aurobindo Pharma und Cipla jeweils ca. 200 API, Dr. Reddy‘s Laboratories 60, die in mehr als 200 Länder der Welt exportiert werden. Zusammen bedienen Indien und China fast 30 Prozent des generischen API-Marktes. Danach folgt Westeuropa mit rund 19 Prozent in 2012.
Trend geht zum Outsourcing
In den letzten Jahren hat die in-house API-Fertigung in den westlichen Ländern durch den harten Wettbewerb und immer geringere Rentabilität einen kontinuierlichen Rückgang erlebt. Mehr und mehr Pharmaanbieter weichen in die Schwellenländer aus, um den kommerziellen Druck in ihren Heimatmärkten in Europa oder auch in den USA aufzufangen. Nach einer Prognose von Boehringer Ingelheim, auf die sich MDTV Alliance beruft, soll der API-Lieferanteil von Indien und China an die USA, der sich derzeit auf 40 Prozent belaufen soll, in den nächsten 10 Jahren auf 80 Prozent ansteigen. Die Fertigungsstätten arbeiten jedoch unter den wachsamen Augen europäischer und US-amerikanischer Inspektoren, und im Falle von GMP-Problemen heißt es eben „Import-Stopp“ und damit „Lieferengpass“ oder sogar „Ausfall“ bei den betreffenden Fertigprodukten.
Lösungsansätze für Lieferengpässe
Nach dem IMS-Gutachten zu Lieferengpässen im Generika-Sektor sind neben den Ursachen auch die Gegenmaßnahmen ähnlich, allerdings werden je nach Land unterschiedliche Schwerpunkte gesetzt (s. Tabelle).
| Deutschland | Finnland | Frankreich | Großbritannien | Niederlande | Schweiz | Kanada | USA | |
|---|---|---|---|---|---|---|---|---|
| Enge Zusammenarbeit der Hersteller mit Zulassungs- und Überwachungsbehörden | + | + | + | |||||
| Multi-Stakeholder-Ansatz | (+) | + | + | + | ||||
| Melderegister (verpflichtend/freiwillig) | + | + | + | + | + | + | + | + |
| Liste essenzieller Arzneimittel | (+) | + | + | + | ||||
| Verpflichtende Mindestlagerbestände | + | + | + | + | + | |||
| Beschleunigte Zulassung für Produkte oder Produktionsanlagen | + | + | + | |||||
| Importregelungen | + | + | + | + | + | + | ||
| Verpflichtende Meldung von Außervertriebnahme von zugelassenen Arzneimitteln | + | + | + | + | + | + | + | |
| Preisanpassung für Shortage-Produkte | + | + | ||||||
Quelle: IMS-Gutachten „Best-Practice-Ansätze bei Arzneimittelengpässen im internationalen Vergleich“ (Januar 2015) | ||||||||
Dabei sollte zwischen freiwilligen Maßnahmen durch die Stakeholder und gesetzlich/behördlich vorgeschriebenen unterschieden werden. In allen Ländern gibt es freiwillige oder verpflichtende Melderegister mit unterschiedlichem Fokus und Detailtiefe. Auf Pflicht-Lagerbestände bei den pharmazeutischen Unternehmen setzen in Europa neben Deutschland auch Finnland, Frankreich und die Schweiz. Teilweise sind nationale Listen essenzieller Arzneimittel vorhanden. Auch Importregelungen sind ein bevorzugtes Instrument. Dagegen sehen nur wenige Länder die Erhöhung der Erstattungspreise der von Engpässen betroffenen Pro-dukte vor (Finnland und Großbritannien). Eine enge Zusammenarbeit zwischen Herstellern und Behörden ist in den untersuchten europäischen Ländern ebenfalls noch relativ unterentwickelt. Nicht viel besser sieht es bei den Multi-Stakeholder-Ansätzen aus, die das Engpass-Management entlang der gesamten Lieferkette koordinieren und damit deren Auswirkungen zu mindern versuchen. IMS Health kommt in seinem Gutachten zu dem Schluss, dass keine der in den untersuchten Ländern etablierten Maßnahmen vollständig oder weitgehend zur Vermeidung von Lieferengpässen geführt hat. Es gebe international keine „One-Fits-All“-Lösung.
Bestrebungen der EMA und der ISPE
Die Society for Pharmaceutical Engineering (ISPE), eine weltweite Not-for-profit-Organisation von Pharmaexperten in der Industrie und von Regulierungsbehörden aus 90 Ländern hat Ende 2012 eigens eine Arbeitsgruppe zu Lieferengpässen gegründet (Drug Shortage Task Force). Im Rahmen der Initiative wurde im Februar und März 2013 unter rund 270 Personen und Firmen eine Umfrage zur Ermittlung der technischen und GMP-Compliance-bezogenen Probleme und zu etwaigen Gegenmaßnahmen durchgeführt. Mehr als die Hälfte gab an, Programme zur Verhinderung von Lieferengpässen zu betreiben, jedoch wurden diese in wiederum der Hälfte dieser Fälle nicht als wirksam angesehen. Die Unternehmen, in denen dies besser klappt, setzten in hohem Maße auch auf eine enge Kommunikation mit den Behörden. Hier wird insgesamt noch einiges an Verbesserungsbedarf gesehen. Dies hat im Übrigen auch die Europäische Arzneimittel-Agentur EMA in ihrem „Reflection paper“ über Herstellungs- bzw. GMP-bedingte Lieferengpässe erkannt.
Basierend auf den Ergebnissen der Umfrage legte die ISPE im Oktober einen Plan zur Verhinderung von Lieferengpässen vor (ISPE Drug Shortages Prevention Plan), der auf einem hexagonalen Modell mit den Elementen Unternehmenskultur, robustes Qualitätssystem, Metrics, kontinuierliche Geschäftsplanung, Kapazitätsbildung und Kommunikation mit den Behörden aufsetzt, und von der EMA, der FDA und einigen nationalen Arzneimittelbehörden geprüft wurde. In diesem Jahr soll die ISPE-Initiative nun in die dritte Phase mit der Implementierung der Empfehlungen, Schulungen und Konferenzen gehen.
Fokus gemeinwirtschaftliche Verpflichtung
Auch der europäische Dachverband der forschenden Pharmaindustrie EFPIA hat sich unlängst mit eigenen „Policy Proposals“ zur Minimierung von Lieferengpässen in Europa in die Diskussion eingemischt. Die EFPIA setzt hierzu vor allem auf eine bessere Unterrichtung über Verknappungen, eine größere Transparenz in der Lieferkette und eine strengere Anwendung bereits vorhandener Rechtsvorschriften hinsichtlich der gemeinwirtschaftlichen Verpflichtung der Hersteller zur Bereitstellung von Arzneimitteln. Das Dokument enthält im Übrigen eine aufschlussreiche Darstellung der Maßnahmen, die einzelne europäische Länder unternehmen, um Verknappungen auf ihren Heimatmärkten zu unterbinden, wie etwa Verbote von Parallelexporten.
Zeigen die USA, wie es gehen kann?
Eine gewisse Ausnahmestellung im Reigen der in dem IMS-Gutachten untersuchten Länder haben die USA, die auch gerne als „leuchtendes Beispiel“ hinsichtlich der erfolgreichen Verhinderung von Lieferengpässen vorgeführt werden. Die FDA führt ein verpflichtendes Melderegister für essenzielle Arzneimittel („medically necessary drugs”) und hat offenbar durch Zusammenarbeit mit den Herstellern bei der Lösung von Herstellungs-/Qualitätsproblemen, schnellere Inspektionen und Genehmigungen von Änderungen sowie Importerlaubnisse und Ausnahmeregelungen ein recht erfolgreiches Maßnahmenpaket zur Reduktion von Liefereng-pässen geschnürt. Auf diese Weise konnten in den letzten Jahren nach FDA-Angaben mehrere Hundert solcher Vorkommnisse verhindert werden, 170 alleine in 2013. Die meisten davon waren durch Qualitäts- und Produktionsschwierigkeiten bedingt.
Auch die amerikanischen Apotheker bringen sich hier tatkräftig ein. Wie aus dem IMS-Gutachten hervorgeht, kooperiert der amerikanische Apothekerverband ASHP eng mit der FDA und unterhält außerdem sein eigenes, umfassendes Lieferengpassregister, an das Apotheker und Hersteller freiwillig melden.
Out of Stock: Wo finde ich regelmäßige Infos?
Deutschland: Register des BfArM unter www.bfarm.de/lieferengpaesse
Österreich: Bundesamt für Sicherheit im Gesundheitswesen AGES Medizinmarktaufsicht. www.basg.gv.at, unter „Übersichtsliste Vertriebseinschränkungen“
Schweiz: www.swissmedic.ch/, unter „Mitteilungen zur Arzneimittelsicherheit“
EU-weit: Europäische Arzneimittel-Agentur (EMA) unter www.ema.europa.eu/ → human regulatory → medicine shortages → shortages catalogue
Fazit und Ausblick
Lieferengpässe von Arzneimitteln treten in unterschiedlichem Maße in vielen Ländern auf. Bei Betrachtung der Anwendungsbereiche, die von Verknappungen betroffen sind, lassen sich derzeit anhand der Daten kaum Muster oder Gesetzmäßigkeiten ableiten. Dies liegt auch daran, dass nicht in allen Ländern eine Meldeverpflichtung besteht, und dass die Meldepflicht unterschiedlich weit ausgelegt ist.
Deutschland steht im Vergleich mit anderen Ländern in Sachen Regulierung der Versorgung gar nicht so schlecht da: Die pharmazeutischen Unternehmer haben den gesetzlichen Auftrag, eine angemessene und kontinuierliche Bereitstellung von Arzneimitteln sicherzustellen. Es gibt immerhin ein freiwilliges Melderegister, und Listen essenzieller Arzneimittel in den jeweiligen Fachgebieten sind in Vorbereitung.
Und dennoch: die beim BfArM gemeldeten Lieferengpässe haben sich im letzten Jahr gegenüber 2013 mehr als verdoppelt. Da es sich um ein freiwilliges und auf bestimmte Wirkstoffe beschränktes Register handelt, dürfte die „Dunkelziffer“ um einiges höher sein. Darauf deuten auch die Erhebungen von Diefenbach hin. Gleichwohl geben auch diese naturgemäß nur ein unvollständiges Bild ab. Zu den Ursachen konkreter Lieferprobleme oder Rückrufe bei einzelnen Medikamenten kann schließlich nur der jeweilige Hersteller selbst Auskunft geben.
Das Problem ist erkannt, aber die Gefahr vor allem aufgrund der Komplexität der Materie noch lange nicht gebannt. Obwohl Lieferengpässe klar von Versorgungsengpässen unter-schieden werden sollten, ist eine Verharmlosung hier fehl am Platze. Eher angebracht wäre vor allem vonseiten der Politik etwas mehr Instinkt für die Mechanismen des Marktes. Es gibt offenbar kein Patentrezept dafür, an welchen Stellschrauben am ehesten gedreht werden sollte, um das Problem in den Griff zu kriegen. Transparenz in der Lieferkette und ein enger Austausch mit den Behörden scheinen dabei allerdings durchaus eine gewisse Wegweiser-Funktion zu haben.
Der Schuh drückt die Apothekerschaft, die ihre Patienten tagtäglich mit einem „Tut mir leid, gibt‘s im Moment nicht“ konfrontieren muss, jedenfalls allerorten mächtig. Beim Deutschen Apothekertag 2014 in München befassten sich gleich mehrere Anträge seitens Kammern und/oder Verbänden quer durch die Republik damit (DAZ 2014, Nr. 39, S. 76 – 80). Einer davon kam von der LAK Thüringen. Er schlug vor, unter Einbindung der Arzneimittelkommission der Deutschen Apotheker (AMK) und von ABDATA ein eigenes elektronisches Verzeichnis einzurichten, in das die Apotheken auftretende Lieferengpässe eintragen können, um die Versorgungssituation unabhängig von Herstellerangaben zentral erfassen und dokumentieren zu können. Der Antrag wurde in einen Ausschuss verwiesen ... |
Literatur
EAHP. Medicines Shortages In European Hospitals. Results of the largest pan-European survey on medicines supply shortages in the hospital sector, its prevalence, nature and impacts for patient care. The evidence and case for action. October 2014.
Antwort der Bundesregierung vom 11.03.2014 auf die Kleine Anfrage der Abgeordneten Kathrin Vogler, Sabine Zimmermann (Zwickau), Harald Weinberg, weiterer Abgeordneter und der Fraktion DIE LINKE –Ausweitung der Versorgungsengpässe bei Medikamenten und Impfstoffen (BT-Drucksache 18/753).
Antwort der Parlamentarischen Staatssekretärin im BMG Annette Widmann-Mauz vom 15. August 2014 auf eine Kleine Anfrage der Abgeordneten Kordula Schulz-Asche, Elisabeth Scharfenberg, Maria Klein-Schmeink, weiterer Abgeordneter und der Fraktion BÜNDNIS 9O/DIE GRÜNEN betreffend „Empfehlungen zur Arzneimittelversorgung durch den Sachverständigen zur Begutachtung der Entwicklung im Gesundheitswesen‘‘ (BT-Drucksache 18/2333).
Papier der Herstellerverbände BAH, BPI, Pro Generika und vfa zu Lieferengpässen bei Arzneimitteln vom 13.05.2014. www.vfa.de/de/download-manager/_gemeinsames-positionspapier-herstellerverbaende-lieferengpaesse.pdf
Report on the ISPE Drug Shortages Survey: June 2013. www.ispe.org/drug-shortages-initiative/about-the-survey.
ISPE Drug Shortages Prevention Plan, October 2014. www.ispe.org/drug-shortages-initiative.






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.