
- DAZ.online
- DAZ / AZ
- DAZ 40/2012
- Darmkrebs vorbeugen
Ernährungsmedizin
Darmkrebs vorbeugen
Der in Teil 1 dargestellte Einfluss einzelner Lebensmittel auf das Dickdarmkrebsrisiko [70] wird zumeist auf bestimmte Inhaltsstoffe zurückgeführt. Zu den Substanzen, die in diesem Zusammenhang häufig (und vielfach kontrovers) diskutiert werden, zählen Fette, Kohlenhydrate und Ballaststoffe sowie eine Reihe von Mikronährstoffen, insbesondere Vitamin D, Folsäure und Antioxidanzien.
Nahrungsfett und Fettsäuren
Epidemiologie
Frühe Korrelationsstudien hatten einen engen Zusammenhang zwischen der Gesamtfettaufnahme und der Häufigkeit kolorektaler Karzinome nahe gelegt [83]. Parallel dazu wurde in tierexperimentellen Untersuchungen bei fettreicher Ernährung eine gesteigerte Tumorgenese nachgewiesen [48]. Die Ansicht, dass eine hohe Fettaufnahme die Entstehung von Dick- und Mastdarm forciert, dominierte dann auch lange die Fachliteratur. Es waren schließlich die Ergebnisse großangelegter Langzeitbeobachtungsstudien, die einen Wandel in der Beurteilung herbeiführten. So kam bereits 1997 eine Metaanalyse von 13 Fall-Kontroll-Studien zu dem Ergebnis, dass der Gesamtfettverzehr keinen von der Energieaufnahme losgelösten Effekt auf das Dickdarmkrebsrisiko ausübt [31]. Auch die Mehrzahl der aussagekräftigeren Kohortenstudien konnte keine Beziehung zwischen der Fettaufnahme und dem kolorektalen Krebsrisiko herstellen (Literatur bei [6]). Entsprechend kommt auch eine im Jahre 2011 durchgeführte Auswertung von 13 Kohortenstudien mit insgesamt 459.910 Teilnehmern zu dem Ergebnis, dass der Fettanteil selbst nicht das Risiko für kolorektale Karzinome verändert [50].
Die Evidenz, dass das kolorektale Krebsrisiko durch eine Reduktion der Fettaufnahme nicht gesenkt werden kann, wird daher als wahrscheinlich eingestuft [6; 8].
Unabhängig von der Frage, welche Bedeutung der Gesamtfettaufnahme zukommt, ist der Einfluss der Fettqualität und das Fettsäuremuster von Interesse (Literatur bei [6; 8]):
Gesättigte Fettsäuren und einfach ungesättigte Fettsäuren (MUFA): Beobachtungsstudien zeigen keinen konsistenten Zusammenhang zwischen der Zufuhr gesättigter Fettsäuren und dem Erkrankungsrisiko. Ebenso ergaben die Studienergebnisse keinen Hinweis, dass MUFA die Entstehung kolorektaler Tumore beeinflusst.
Mehrfach ungesättigte Fettsäuren (PUFA): Sowohl die Gesamtheit der PUFA als auch die Zufuhr von Omega-6-Fettsäuren ist nicht mit dem Erkrankungsrisiko assoziiert. Dagegen steht eine hohe Arachidonsäurezufuhr in Verdacht, das Dickdarmkrebsrisiko zu erhöhen.
Omega-3-Fettsäuren: Fall-Kontroll- und Kohortenstudien lassen vermuten, dass langkettige ω-3-Fettsäuren (Docosahexaensäure; DHA und Eicosapentaensäure; EPA) chemoprotektiv wirken. Die Evidenz für ihren risikosenkenden Effekt wird als möglich gewertet. Dieselbe Einschätzung gilt für ein abgesenktes Verhältnis von Omega-6- zu Omega-3-Fettsäuren.
Trans-Fettsäuren: Die aktuelle Studienlage lässt keinen Zusammenhang zwischen der Zufuhr von trans-Fettsäuren und der Entstehung von Dick- und Mastdarmkrebs erkennen [64; 72]. Entsprechend gilt die Evidenz für einen risikomodifizierenden Effekt als unzureichend [6].
Kohlenhydrate, glykämischer Index und glykämische Last
Vordergründig scheinen Tumorentstehung und Kohlenhydratzufuhr nicht in Verbindung zu stehen. Allerdings können Kohlenhydrate aufgrund ihrer Funktion als Energieträger und ihrer Interaktion mit dem Insulinstoffwechsel eine Reihe von Prozessen beeinflussen, die mit der Kanzerogenese assoziiert sind (siehe unten) [5; 37]. Die epidemiologische Studienlage lässt dennoch keinen diesbezüglichen Effekt des Kohlenhydratverzehrs erkennen [4; 7]:
Gesamtkohlenhydratzufuhr: In einer jüngeren Metaanalyse von 14 Kohortenstudien war die Gesamtaufnahme an Kohlenhydraten nicht mit dem Risiko für kolorektale Karzinome assoziiert. Pro Anstieg des Kohlenhydratverzehrs um 100 g/Tag wurde sogar ein um 5 % vermindertes Risiko errechnet; der Effekt war allerdings nicht signifikant [4].
Glykämischer Index (GI) und glykämische Last (GL): Auch diese beiden Indikatoren der Kohlenhydrataufnahme bzw. -wirkung zeigten keinen risikomodifizierenden Effekt, wie dieselbe Metaanalyse ergab.
Zuckergesüßte Getränke sowie Mono- und Disaccharide. In einer im Rahmen des Pooling-Projekts durchgeführten Auswertung von 13 Kohortenstudien war kein Zusammenhang zwischen der Aufnahme von zuckergesüßten Getränken und dem Dickdarmkrebsrisiko nachweisbar [85]. Auch von Mono- und Disacchariden geht keine erkennbare risikomodifizierende Wirkung aus [7].
Ballaststoffe
Der Einfluss der Ballaststoffzufuhr auf die Entwicklung von Dick- und Mastdarmkrebs wurde kürzlich in dem Beitrag "Gesundheitliche Effekte von Ballaststoffen" (siehe DAZ 2012, Nr. 32, S. 54 ff) ausführlich dargestellt [69], weshalb an dieser Stelle auf die dortigen Ausführungen verwiesen werden soll.
Zu ergänzen sind nur die Ergebnisse, die jüngst im Rahmen einer Nachbeobachtung der EPIC-Studie veröffentlicht wurden. An der prospektiven Kohortenstudie waren über 477.000 Personen (142.250 Männer; 335.062 Frauen) beteiligt; das Follow-Up umfasste im Mittel elf Jahre und 4517 Fälle. Personen, die sich sehr ballaststoffreich ernährten (≥ 28,5 g/Tag), hatten ein um 17 % vermindertes Risiko, ein kolorektales Karzinom zu entwickeln, verglichen mit Personen mit der geringsten Ballaststoffzufuhr (< 16,4 g/Tag). Für Dickdarmkrebs und Mastdarmkrebs (separate Auswertung) zeigte sich ein ähnlich risikosenkender Effekt; allerdings war die Wirkung nur beim Kolonkarzinom signifikant.
Analysen zur Dosis-Wirkungsbeziehung ergaben eine nahezu lineare Beziehung zwischen der Ballaststoffaufnahme und dem Risiko, ein kolorektales Karzinom zu entwickeln. Wird die Ballaststoffzufuhr um 10 g/Tag gesteigert, so ist dies mit einer Risikoabsenkung um 13 % verbunden. Dabei ist das Schutzpotenzial von Ballaststoffen aus Getreideprodukten etwas stärker ausgeprägt als das von Gemüse und Obst [55].
Insgesamt untermauern die Daten die wissenschaftliche Evidenz für einen risikosenkenden Effekt von Lebensmitteln, die Ballaststoffe enthalten. Die Evidenz hierfür wird seitens des WCRF als überzeugend eingestuft [82].
Vitamin D
Epidemiologie
Unter dem Titel "Do sunlight and vitamin D reduce the likelihood of colon cancer?" publizierten die beiden US-amerikanischen Brüder Cederic und Frank Garland im Jahr 1980 einen zum Klassiker der Epidemiologie avancierten Beitrag [3; 13; 15; 22]. Darin stellten sie die – wie der Titel bereits andeutet – These auf, dass regelmäßige Sonnenexposition via Vitamin-D-Bildung die Anfälligkeit für Dickdarmkrebs reduziert [18].
Konsistent hierzu zeigte sich in nachfolgenden Korrelationsstudien ein auffallender geografischer bzw. -klimatischer Gradient: Je größer die Entfernung zum Äquator bzw. je geringer die UV-B-Exposition, desto höher das Risiko an Brust-, Eierstock-, Prostata- und Rektumkarzinom zu versterben [9; 19 – 20; 24 – 25; 27; 46; 61]. Auch die allgemeine Krebssterblichkeit steht mit der UV-Bestrahlung in Zusammenhang.
Zwischenzeitlich ist die Zahl der UV-B-sensitiven Krebsformen auf über 15 angewachsen; Tendenz steigend [25 – 28; 54]. Besonders gut belegt ist die "UV-B-Vitamin-D-Hypothese" für kolorektale Tumoren [29]. Selbst wenn verschiedene Störgrößen (Confounder) wie Alter, Rauch-, Bewegungs- und Trinkgewohnheiten bei den Auswertungen mit berücksichtigt werden, bleibt die inverse Beziehung zwischen UV-B-Exposition und Krebssterblichkeit bestehen [9; 25].
Unterstützt wird die Vitamin-D-These durch Beobachtungsstudien. Die dort erarbeiteten Befunde wurden zwischenzeitlich in mehreren Metaanalysen ausgewertet. Dabei zeigt sich: je besser die Vitamin-D-Versorgung (Marker: Serum-Calcidiol-Spiegel), desto geringer das Dickdarmkrebsrisiko [23; 35]. Selbst wenn die Analyse auf die aussagekräftigeren Kohortenstudien beschränkt werden und die für Verzerrungen anfälligen Fall-Kontroll-Studien bei der Auswertung unberücksichtigt bleiben, bleibt der Zusammenhang bestehen. Pro Anstieg der Serum-Calcidiol-Konzentration um 50 nmol/l (20 ng/ml) errechnet sich ein um 43 % vermindertes Risiko für kolorektale Karzinome [84].
Die bislang umfangreichste Metaanalyse zum Themenkomplex "Vitamin D und kolorektales Krebsrisiko" wurde jüngst von einer zehnköpfigen Forschergruppe im Fachblatt der American Association for Cancer Research veröffentlicht. Neben dem Einfluss des Vitamin-D-Status auf das Krebsrisiko wurden auch die Effekte der Vitamin-D-Zufuhr untersucht [73]:
Vitamin-D-Status: Zwischen der Konzentration an Calcidiol im Blut und dem Risiko, an kolorektalen Karzinomen zu erkranken, besteht eine nahezu lineare, inverse Assoziation. Pro Anstieg des Calcidiolwerts um 100 IE/l (2,4 ng/ml) errechnet sich ein um 4 % vermindertes Erkrankungsrisiko. Bei separater Betrachtung von Dickdarm- und Mastdarmkrebs ergibt sich eine ähnliche, allerdings nicht-signifikante Dosis-Wirkungsbeziehung.
Vitamin-D-Zufuhr: Für einen Anstieg der Vitamin-D-Zufuhr aus der Nahrung um 100 IE/Tag (2,5 µg Vitamin D2 oder D3) wurde ein um 5 % vermindertes kolorektales Erkrankungsrisiko errechnet. Bei der getrennten Betrachtung von Dickdarm und Mastdarmkrebs konnte kein signifikanter Schutzeffekt nachgewiesen werden. Bei Betrachtung der Gesamtvitamin-D-Aufnahme (Nahrung und Supplemente) reduzierte sich das Dickdarmkrebsrisiko bei einer Zufuhrsteigerung von 100 IE/Tag um 7 %. Bezüglich kolorektaler Karzinome und Mastdarmkrebs ergab sich kein signifikanter Effekt.
Während Beobachtungsstudien bei verbesserter Vitamin-D-Versorgung eine konsistente Risikoreduktion für kolorektale Karzinome zeigen, ist die Evidenz für einen Vitamin-D-Schutzeffekt aus Interventionsstudien weniger überzeugend. So ergaben die Ergebnisse einer im Jahr 2003 im British Journal of Medicine veröffentlichten randomisierten kontrollierten Interventionsstudie mit 2686 Männern und Frauen im Alter von 65 bis 85 Jahren keine Hinweise für einen Vitamin-D-Schutzeffekt. Oral verabreichtes Vitamin D3 (100.000 IE alle vier Monate) über fünf Jahre hatte keinen Einfluss auf die Dickdarmkrebsinzidenz und Mortalität im Vergleich zu Placebo. In der Vitamin-D-Gruppe wurden 28 Kolonkrebsfälle beobachtet; in der Placebogruppe 27 [74].
Auch in der Womens Health Study (WHI) mit über 36.000 postmenopausalen Frauen hatte die Supplementierung von Vitamin D (400 IE/Tag; 10 µg/Tag) und Calcium (1000 mg/Tag) keine signifikante Reduktion des Dickdarmkrebsrisikos zur Folge (Interventionsdauer: sieben Jahre) [77]. Kritisch anzumerken ist hier jedoch, dass die Vitamin-D-Dosierung vermutlich zu gering war, um einen klinisch relevanten Effekt nachweisen zu können [21; 28; 30].
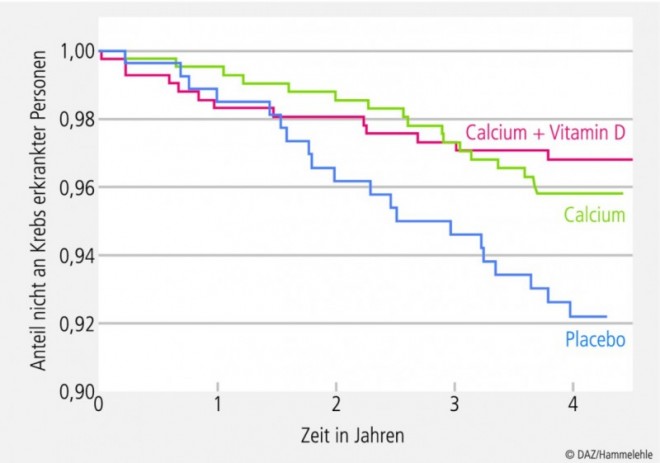
Für diese These spricht das Ergebnis eines weiteren RCTs. Die von Forschern um den bekannten Vitamin-D-Experten Robert Heaney durchgeführte populationsbasierte Doppelblindstudie schloss 1179 gesunde postmenospausale Frauen im Alter von > 55 Jahren ein. Die Studienteilnehmerinnen erhielten für vier Jahre 1400 bis 1500 mg Calcium, eine Kombination von Calcium (1500 mg/Tag) und Vitamin D (1100 IE/Tag) oder ein Placebo. Für die Vitamin-D- und Calcium-Gruppe ergab sich eine signifikante, 60 % reduzierte Krebsinzidenz (alle Krebsarten) im Vergleich zu Placebo. In der Calcium-Gruppe war der Effekt etwas geringer [44] (siehe Abb. 1).
Basierend auf den inkonsistenten Ergebnissen zwischen Beobachtungs- und Interventionsstudien wird der risikosenkende Effekt hoher Calcidiolspiegel auf kolorektale Karzinome, gleichbedeutend mit einer guten Vitamin-D-Versorgung, als möglich gewertet [47; 56].
Wirkmechanismus
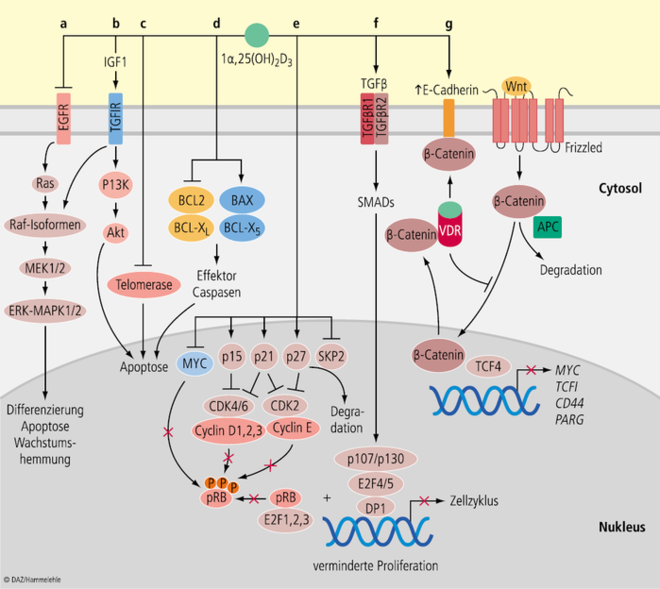
Der antikanzerogene Effekt von Vitamin D lässt sich auf fünf grundlegende Mechanismen zurückführen [11; 14; 75] (siehe Abb. 2):
Zellproliferation: Der biologisch aktive Vitamin-D-Metabolit Calcitriol hemmt die Proliferation von Tumorzellen, indem er Schlüsselstellen der Zell-Cyclus-Signaltransduktion moduliert. Folge: Zell-Cyclus-Arrest.
Zelldifferenzierung: Calcitriol unterstützt die Differenzierung von Epithelzellen, u. a. über die Aktivierung von Proteinkinase C (PKC).
Apoptose: Calcitriol induziert die Expression von pro-apoptotischen Proteinen (Bax, Bak und Bad). Gleichzeitigt reprimiert es die Synthese von Eiweißen, die die Apoptose von Tumorzellen unterdrücken (Vcl-2; Bcl-XL).
Angiogenese: Die Neubildung von Blutgefäßen im Tumorgewebe wird durch Calcitriol gestört. Dies geschieht zum einen über eine verminderte Synthese von Pro-Angiogenese-Faktoren (u. a. VEGF; Vascular Endothelial Growth Factor). Zum anderen induziert Calcitriol die Bildung von Anti-Angiogenese-Metaboliten, beispielsweise den potenten Hemmstoff Thrombospondin 1 (THSD1).
Inflammation: Calcitriol wirkt entzündungshemmend, indem es die Arachidonsäure-Cyclooxygenase-Kaskade unterdrückt.
Mineralstoffe und Vitamine
Neben Vitamin D können weitere Vitamine Einfluss auf das Krebsrisiko nehmen. Dazu zählen Vitamin E und C sowie Folsäure und Vitamin B6. Unter den Mineralstoffen sind insbesondere Calcium und Selen von Interesse. Ihre chemopräventiven Effekte sowie die Bewertung der diesbezüglichen wissenschaftlichen Evidenz sind einer Tabelle zu entnehmen, die hier als PDF bereitgestellt ist.
Fazit und Empfehlungen für die Praxis
Nahrungsfaktoren modifizieren das Risiko für kolorektale Tumoren in unterschiedlicher Weise. Die Evidenz zum Zusammenhang einzelner Nährstoffe und dem Erkrankungsrisiko ist in Tabelle 1 zusammengestellt. Wie daraus hervorgeht, ist der Einfluss bzw. die Evidenz für einen krankheitsmodifizierenden Effekt bei den meisten Einzelnährstoffen vergleichsweise schwach. Wichtiger als einzelne Nährstoffe ist offenbar das Lebensmittelmuster bzw. der Lebensstil.
Empfehlenswert ist eine vorwiegend pflanzlich orientierte Kost, die einen hohen Anteil an Obst, Gemüse, Vollkornprodukten und Hülsenfrüchten aufweist, ergänzt um Nüsse, Milchprodukte, Fischgerichte und Geflügel. Dagegen sollte der Konsum energiereicher Süß- und Fleischwaren eingeschränkt werden.
Obwohl Beobachtungsstudien die Vermutung untermauern, dass Folsäure-haltigen Multivitamin-Präparaten ein protektives Potenzial zukommt [58], raten Fachorganisationen wie der WCRF nicht zu einer generellen Einnahme entsprechender Supplemente. Bei Risikogruppen oder Personen, deren Ernährung sich nicht entsprechend modifizieren lässt, kann die Zufuhr eines Folsäure- und Selen-haltigen Multimineral-Multivitaminpräparats allerdings sinnvoll sein. Empfehlenswert sind dann physiologische Dosierungen der Nährstoffe im Bereich der D-A-CH- bzw. RDA-Referenzwerte.
Im Kasten "Empfehlungen" sind die zentralen Empfehlungen des WCRF zur Krebsprävention zusammengefasst.
Empfehlungen des WCRF zur Prävention von Krebserkrankungen [78]1. Körperfettmasse:
2. Körperliche Aktivität:
3. Lebensmittel und Getränke, die eine Körpergewichtszunahme fördern:
4. Pflanzliche Lebensmittel:
5. Lebensmittel tierischer Herkunft:
6. Alkohol:
7. Haltbarmachung, Verarbeitung, Zubereitung:
|
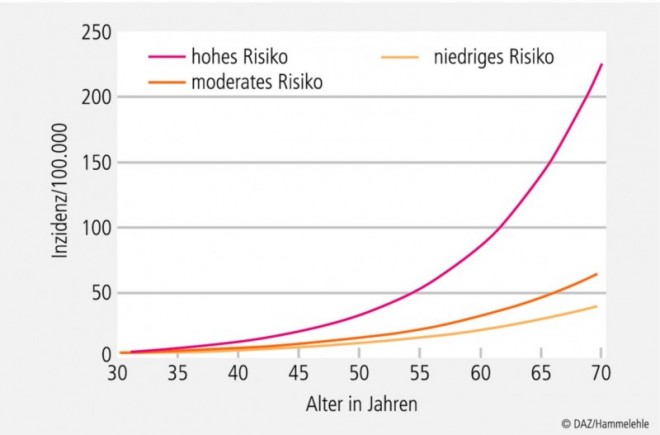
Welches krebspräventive Potenzial Lebensstilfaktoren besitzen, haben Forscher der Harvard Universität bereits im Jahr 2000 für US-amerikanische Männer im mittleren Lebensalter vorgerechnet. Allein durch Vermeidung von Übergewicht, Steigerung der körperlichen Aktivität, Einschränkung des Alkohol- und Fleisch(waren)verzehrs sowie Einnahme eines Folsäure-haltigen Multivitamin-Präparats lassen sich danach etwa 55 % der Dickdarmkrebsfälle vermeiden [59]. Auch etwa 30 % der distalen Dickdarm-Adenome wären vermeidbar (46 % reduziertes atributales Risiko für großflächige Adenome mit ≥ 1 cm2; 22 % gesenktes atributales Risiko für kleinflächige Adenome mit < 1 cm2) [59]. Ähnliche Effekte des Lebensstils auf die Entwicklung von Dickdarmkrebs wurden bei US-amerikanischen Frauen nachgewiesen. Verglichen mit gesundheitsbewussten Frauen hatten Personen in der Hoch-Risiko-Gruppe ein vierfach erhöhtes Erkrankungsrisiko (siehe Abb. 3).
Interessant ist, dass ein krebsprotektiver Lebensstil auch vor weiteren chronischen Erkrankungen schützt. So zeigen Berechnungen, dass mindestens 80 % der koronaren Herzerkrankungen [65], 90 % der Diabetes-Typ-2-Fälle [32] und 70 % der Schlaganfälle [43] auf den westlichen Ernährungs- und Lebensstil zurückzuführen sind. Prävention lohnt sich also!
Literatur
[1] Ahearn TU, McCullough ML, Flanders WD, Long Q, Sidelnikov E, Fedirko V, Daniel CR, Rutherford RE, Shaukat A, Bostick RM. A randomized clinical trial of the effects of supplemental calcium and vitamin D3 on markers of their metabolism in normal mucosa of colorectal adenoma patients. Cancer Res. 2011 Jan 15;71(2):413-23.
[2] Ainsworth BE, Haskell WL, Leon AS, Jacobs DR Jr, Montoye HJ, Sallis JF, Paffenbarger RS Jr. Compendium of physical activities: classification of energy costs of human physical activities. Med Sci Sports Exerc. 1993 Jan;25(1):71-80.
[3] Alexander DD, Cushing CA, Lowe KA, Sceurman B, Roberts MA. Meta-analysis of animal fat or animal protein intake and colorectal cancer. Am J Clin Nutr. 2009 May;89(5):1402-9.
[4] Alexander DD, Weed DL, Cushing CA, Lowe KA. Meta-analysis of prospective studies of red meat consumption and colorectal cancer. Eur J Cancer Prev. 2011 Jul;20(4):293-307.
[5] Answorth BE, Haskell WL, Leon AS et al: Compendium of physical activities: classification of energy costs of human physical activities. Med Sci Sports Exerc. 1993 Jan;25(1):71-80.
[6] Aune D, Chan DS, Lau R, Vieira R, Greenwood DC, Kampman E, Norat T. Carbohydrates, glycemic index, glycemic load, and colorectal cancer risk: a systematic review and meta-analysis of cohort studies. Cancer Causes Control. 2012 Apr;23(4):521-35.
[7] Aune D, Lau R, Chan DS, Vieira R, Greenwood DC, Kampman E, Norat T. Dairy products and colorectal cancer risk: a systematic review and meta-analysis of cohort studies. Ann Oncol. 2012 Jan;23(1):37-45.
[8] Aune D, Lau R, Chan DS, Vieira R, Greenwood DC, Kampman E, Norat T. Nonlinear reduction in risk for colorectal cancer by fruit and vegetable intake based on meta-analysis of prospective studies. Gastroenterology. 2011 Jul;141(1):106-18.
[9] Baan R, Straif K, Grosse Y, Secretan B, El Ghissassi F, Bouvard V, Altieri A, Cogliano V; WHO International Agency for Research on Cancer Monograph Working Group. Carcinogenicity of alcoholic beverages. Lancet Oncol. 2007 Apr;8(4):292-3.
[10] Bagnardi V, Blangiardo M, La Vecchia C, Corrao G. A meta-analysis of alcohol drinking and cancer risk. Br J Cancer. 2001 Nov 30;85(11):1700-5.
[11] Bastide NM, Pierre FH, Corpet DE. Heme iron from meat and risk of colorectal cancer: a meta-analysis and a review of the mechanisms involved. Cancer Prev Res (Phila). 2011 Feb;4(2):177-84.
[12] Benito M, Díaz-Rubio E. Molecular biology in colorectal cancer. Clin Transl Oncol. 2006 Jun;8(6):391-8. Review.
[13] Berlin JA, Colditz GA. A meta-analysis of physical activity in the prevention of coronary heart disease. Am J Epidemiol. 1990 Oct;132(4):612-28.
[14] Block G, Patterson B, Subar A. Fruit, vegetables, and cancer prevention: a review of the epidemiological evidence. Nutr Cancer. 1992;18(1):1-29.
[15] Boeing H, Bechthold A, Bub A, Ellinger S, Haller D, Kroke A, Leschik-Bonnet E,Müller MJ, Oberritter H, Schulze M, Stehle P, Watzl B. Critical review: vegetables and fruit in the prevention of chronic diseases. Eur J Nutr. 2012 Jun 9. [Epub ahead of print]
[16] Boeing H. Kohlenhydratzufuhr und Prävention von Krebskrankheiten. In: Deutsche Gesellschaft für Ernährung e. V. (DGE) (Hrsg.). Evidenzbasierte Leitlinie. Kohlenhydratzufuhr und Prävention ausgewählter ernährungsmitbedingter Krankheiten". Version 2011. Bonn 2011, S. 138-157. Online verfügbar unter http://www.dge.de/pdf/ws/ll-kh/DGE-Leitlinie-KH-ohne-Anhang_Tabellen.pdf
[17] Boeing H. Tumorentstehung - hemmende und fördernde Ernährungsfaktoren. In: Deutsche Gesellschaft für Ernährung e.V. (Hrsg.): Ernährungsbericht 2004. Bonn, 2004, S. 235-82
[18] Boeing H. Zusammenhang zwischen Ernährung und Krebsentstehung. In: Deutsche Gesellschaft für Ernährung e.V. (Hrsg.): Ernährungsbericht 2008. Bonn, 2008, S. 301-335
[19] Bostick RM, Potter JD, Kushi LH, Sellers TA, Steinmetz KA, McKenzie DR, Gapstur SM, Folsom AR. Sugar, meat, and fat intake, and non-dietary risk factors for colon cancer incidence in Iowa women (United States) Cancer Causes Control. 1994;5:38–52.
[20] Botteri E, Iodice S, Bagnardi V, Raimondi S, Lowenfels AB, Maisonneuve P. Smoking and colorectal cancer: a meta-analysis. JAMA. 2008;300:2765–2778.
[21] Butler LM, Sinha R, Millikan RC, Martin CF, Newman B, Gammon MD, Ammerman AS, Sandler RS. Heterocyclic amines, meat intake, and association with colon cancer in a population-based study. Am J Epidemiol. 2003 Mar 1;157(5):434-45.
[22] Calvert PM, Frucht H. The genetics of colorectal cancer. Ann Intern Med. 2002 Oct 1;137(7):603-12.
[23] Chan AT, Giovannucci EL. Primary prevention of colorectal cancer. Gastroenterology. 2010 Jun;138(6):2029-2043.e10.
[24] Chan DS, Lau R, Aune D, Vieira R, Greenwood DC, Kampman E, Norat T. Red and processed meat and colorectal cancer incidence: meta-analysis of prospective studies. PLoS One. 2011;6(6):e20456.
[25] Chao A, Thun MJ, Jacobs EJ, Henley SJ, Rodriguez C, Calle EE. Cigarette smoking and colorectal cancer mortality in the cancer prevention study II. J Natl Cancer Inst. 2000;92:1888–1896.]
[26] Chatenoud L, Tavani A, La Vecchia C, Jacobs DR Jr, Negri E, Levi F, Franceschi S. Whole grain food intake and cancer risk. Int J Cancer. 1998 Jul 3;77(1):24-8.
[27] Cho E, Smith-Warner SA, Ritz J, van den Brandt PA, Colditz GA, Folsom AR, Freudenheim JL, Giovannucci E, Goldbohm RA, Graham S, Holmberg L, Kim DH, Malila N, Miller AB, Pietinen P, Rohan TE, Sellers TA, Speizer FE, Willett WC, Wolk A,Hunter DJ. Alcohol intake and colorectal cancer: a pooled analysis of 8 cohort studies. Ann Intern Med. 2004 Apr 20;140(8):603-13.
[28] Cho E, Smith-Warner SA, Spiegelman D, Beeson WL, van den Brandt PA, Colditz GA, Folsom AR, Fraser GE, Freudenheim JL, Giovannucci E, Goldbohm RA, Graham S, Miller AB, Pietinen P, Potter JD, Rohan TE, Terry P, Toniolo P, Virtanen MJ, Willett WC, Wolk A, Wu K, Yaun SS, Zeleniuch-Jacquotte A, Hunter DJ. Dairy foods, calcium, and colorectal cancer: a pooled analysis of 10 cohort studies. J Natl Cancer Inst. 2004 Jul 7;96(13):1015-22
[29] Corpet DE. Red meat and colon cancer: should we become vegetarians, or can we make meat safer? Meat Sci. 2011 Nov;89(3):310-6.
[30] Delbrück H. [Physical activity and tumor diseases]. Internist (Berl). 2012 Jun;53(6):688-97.
[31] Doll R, Peto R. Mortality in relation to smoking: 20 years' observations on male British doctors. Br Med J. 1976;2:1525–1536.
[32] Donohoe CL, Doyle SL, Reynolds JV. Visceral adiposity, insulin resistance and cancer risk. Diabetol Metab Syndr. 2011 Jun 22;3:12.
[33] Doyle SL, Donohoe CL, Lysaght J, Reynolds JV. Visceral obesity, metabolic syndrome, insulin resistance and cancer. Proc Nutr Soc. 2012 Feb;71(1):181-9
[34] Fedirko V, Tramacere I, Bagnardi V, Rota M, Scotti L, Islami F, Negri E, Straif K, Romieu I, La Vecchia C, Boffetta P, Jenab M. Alcohol drinking and colorectal cancer risk: an overall and dose-response meta-analysis of published studies. Ann Oncol. 2011 Sep;22(9):1958-72
[35] Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010;127:2893-917.
[36] Flood A, Velie EM, Chaterjee N, Subar AF, Thompson FE, Lacey JV Jr, Schairer C, Troisi R, Schatzkin A. Fruit and vegetable intakes and the risk of colorectal cancer in the Breast Cancer Detection Demonstration Project follow-up cohort. Am J Clin Nutr. 2002 May;75(5):936-43.
[37] Giovannucci E, Ascherio A, Rimm EB, Colditz GA, Stampfer MJ, Willett WC. Physical activity, obesity, and risk for colon cancer and adenoma in men. Ann Intern Med. 1995;122:327–334.
[38] Giovannucci E, Colditz GA, Stampfer MJ, Hunter D, Rosner BA, Willett WC, Speizer FE. A prospective study of cigarette smoking and risk of colorectal adenoma and colorectal cancer in U.S. women. J Natl Cancer Inst. 1994;86:192–199.
[39] Giovannucci E, Rimm EB, Stampfer MJ, Colditz GA, Ascherio A, Kearney J, Willett WC. A prospective study of cigarette smoking and risk of colorectal adenoma and colorectal cancer in U.S. men. J Natl Cancer Inst. 1994;86:183–191.]
[40] Gonder U, Worm N. Re: Meat, fish, and colorectal cancer risk: the European Prospective Investigation into Cancer and Nutrition. J Natl Cancer Inst. 2005 Dec 7;97(23):1788; author reply 1788-9.
[41] Gunter MJ, Leitzmann MF. Obesity and colorectal cancer: epidemiology, mechanisms and candidate genes. J Nutr Biochem. 2006 Mar;17(3):145-56
[42] Gunter MJ, Probst-Hensch NM, Cortessis VK, Kulldorff M, Haile RW, Sinha R. Meat intake, cooking-related mutagens and risk of colorectal adenoma in a sigmoidoscopy-based case-control study. Carcinogenesis. 2005 Mar;26(3):637-42.
[43] Hahn A, Ströhle A, Wolters M: Ernährung - Physiologische Grundlagen, Prävention, Therapie., (2. Aufl.) Stuttgart: Wissenschaftliche Verlagsgesellschaft, 2006
[44] Halle M, Schoenberg MH. Physical activity in the prevention and treatment of colorectal carcinoma. Dtsch Arztebl Int. 2009 Oct;106(44):722-7
[45] Hammond EC, Horn D. Smoking and death rates: report on forty-four months of followup of 187,783 men. II. Death rates by cause. JAMA. 1958;166:1294–1308.
[46] Harriss DJ, Atkinson G, George K, Cable NT, Reilly T, Haboubi N, Zwahlen M, Egger M, Renehan AG; C-CLEAR group. Lifestyle factors and colorectal cancer risk (1): systematic review and meta-analysis of associations with body mass index. Colorectal Dis. 2009 Jul;11(6):547-63.
[47] Heineman EF, Zahm SH, McLaughlin JK, Vaught JB. Increased risk of colorectal cancer among smokers: results of a 26-year follow-up of US veterans and a review. Int J Cancer. 1994;59:728–738.
[48] Holt PR, Atillasoy EO, Gilman J, Guss J, Moss SF, Newmark H, Fan K, Yang K, Lipkin M. Modulation of abnormal colonic epithelial cell proliferation and differentiation by low-fat dairy foods: a randomized controlled trial. JAMA. 1998 Sep 23-30;280(12):1074-9.
[49] Holt PR, Wolper C, Moss SF, Yang K, Lipkin M. Comparison of calcium supplementation or low-fat dairy foods on epithelial cell proliferation and differentiation. Nutr Cancer. 2001;41(1-2):150-5.
[50] Huncharek M, Muscat J, Kupelnick B. Colorectal cancer risk and dietary intake of calcium, vitamin D, and dairy products: a meta-analysis of 26,335 cases from 60 observational studies. Nutr Cancer. 2009;61(1):47-69.
[51] Husemann B, Neubauer MG, Duhme C. [Sedentary occupation and recto-sigmoidal neoplasms]. Onkologie. 1980 Aug;3(4):168-71.
[52] Huxley RR, Ansary-Moghaddam A, Clifton P, Czernichow S, Parr CL, Woodward M.The impact of dietary and lifestyle risk factors on risk of colorectal cancer: a quantitative overview of the epidemiological evidence. Int J Cancer. 2009 Jul 1;125(1):171-80.
[53] IARC Working Group on the Evaluation of Cancer-Prevention Strategies. IARC Handbooks of Cancer Prevention: Fruit and Vegetables. Lyon, 2003
[54] Jacobs DR Jr, Marquart L, Slavin J, Kushi LH. Whole-grain intake and cancer: an expanded review and meta-analysis. Nutr Cancer. 1998;30(2):85-96.
[55] Kahn HA. The Dorn study of smoking and mortality among U.S. veterans: report on eight and one-half years of observation. Natl Cancer Inst Monogr. 1966;19:1–125.
[56] Karagas MR, Tosteson TD, Greenberg ER, Rothstein RI, Roebuck BD, Herrin M, Ahnen D. Effects of milk and milk products on rectal mucosal cell proliferation in humans. Cancer Epidemiol Biomarkers Prev. 1998 Sep;7(9):757-66.
[57] Key TJ, Schatzkin A, Willett WC, Allen NE, Spencer EA, Travis RC. Diet, nutrition and the prevention of cancer. Public Health Nutr. 2004 Feb;7(1A):187-200.
[58] Key TJ. Fruit and vegetables and cancer risk. Br J Cancer. 2011 Jan 4;104(1):6-11.
[59] Khan N, Afaq F, Mukhtar H. Lifestyle as risk factor for cancer: Evidence from human studies. Cancer Lett. 2010 Jul 28;293(2):133-43. Epub 2010 Jan 18.
[60] Khandekar MJ, Cohen P, Spiegelman BM. Molecular mechanisms of cancer development in obesity. Nat Rev Cancer. 2011 Nov 24;11(12):886-95.
[61] Knize MG, Felton JS. Formation and human risk of carcinogenic heterocyclic amines formed from natural precursors in meat. Nutr Rev. 2005 May;63(5):158-65.
[62] Koushik A, Hunter DJ, Spiegelman D, Beeson WL, van den Brandt PA, Buring JE, Calle EE, Cho E, Fraser GE, Freudenheim JL, Fuchs CS, Giovannucci EL, Goldbohm RA, Harnack L, Jacobs DR Jr, Kato I, Krogh V, Larsson SC, Leitzmann MF, Marshall JR, McCullough ML, Miller AB, Pietinen P, Rohan TE, Schatzkin A, Sieri S, Virtanen MJ, Wolk A, Zeleniuch-Jacquotte A, Zhang SM, Smith-Warner SA. Fruits, vegetables, and colon cancer risk in a pooled analysis of 14 cohort studies. J Natl Cancer Inst. 2007 Oct 3;99(19):1471-83.
[63] Larsson SC, Wolk A. Meat consumption and risk of colorectal cancer: a meta-analysis of prospective studies. Int J Cancer. 2006 Dec 1;119(11):2657-64.
[64] Larsson SC, Wolk A. Obesity and colon and rectal cancer risk: a meta-analysis of prospective studies. Am J Clin Nutr. 2007;86:556–565
[65] Lee CD, Folsom AR, Blair SN. Physical activity and stroke risk: a meta-analysis. Stroke. 2003 Oct;34(10):2475-81.
[66] Lee IM, Paffenbarger RS, Jr, Hsieh CC. Physical activity and risk of developing colorectal cancer among college alumni. J Natl Cancer Inst. 1991;83:1324–1329.
[67] Liang PS, Chen TY, Giovannucci E. Cigarette smoking and colorectal cancer incidence and mortality: systematic review and meta-analysis. Int J Cancer. 2009;124:2406–2415.
[68] Link LB, Potter JD. Raw versus cooked vegetables and cancer risk. Cancer Epidemiol Biomarkers Prev. 2004 Sep;13(9):1422-35.
[69] Longnecker MP, Orza MJ, Adams ME, Vioque J, Chalmers TC. A meta-analysis of alcoholic beverage consumption in relation to risk of colorectal cancer. Cancer Causes Control. 1990 Jul;1(1):59-68.
[70] Martinez ME, Giovannucci E, Spiegelman D, Hunter DJ, Willett WC, Colditz GA. Leisure-time physical activity, body size, and colon cancer in women. Nurses' Health Study Research Group. J Natl Cancer Inst. 1997;89:948–955.
[71] Martinez ME, Giovannucci E, Spiegelman D, Stampfer MJ, Hunter DJ, Speizer FE, Willett WC, Colditz GA. Physical activity, body size, and colorectal cancer in women. Am J Epidemiol. 1996;143:S73.
[72] McCredie M. Cancer epidemiology in migrant populations. Recent Results Cancer Res. 1998;154:298-305.
[73] Michels KB, Edward Giovannucci, Joshipura KJ, Rosner BA, Stampfer MJ, Fuchs CS, Colditz GA, Speizer FE, Willett WC. Prospective study of fruit and vegetable consumption and incidence of colon and rectal cancers. J Natl Cancer Inst. 2000 Nov 1;92(21):1740-52. Erratum in: J Natl Cancer Inst 2001 Jun 6;93(11):879.
[74] Miller HE, Rigelhof F, Marquart L, Prakash A, Kanter M. Antioxidant content of whole grain breakfast cereals, fruits and vegetables. J Am Coll Nutr. 2000 Jun;19(3 Suppl):312S-319S.
[75] Mizoue T, Inoue M, Wakai K, Nagata C, Shimazu T, Tsuji I, Otani T, Tanaka K, Matsuo K, Tamakoshi A, Sasazuki S, Tsugane S; Research Group for Development and Evaluation of Cancer Prevention Strategies in Japan. Alcohol drinking and colorectal cancer in Japanese: a pooled analysis of results from five cohort studies. Am J Epidemiol. 2008 Jun 15;167(12):1397-406.
[76] Moore HG. Colorectal cancer: what should patients and families be told to lower the risk of colorectal cancer? Surg Oncol Clin N Am. 2010 Oct;19(4):693-710.
[77] Moskal A, Norat T, Ferrari P, Riboli E. Alcohol intake and colorectal cancer risk: a dose-response meta-analysis of published cohort studies. Int J Cancer. 2007 Feb 1;120(3):664-71.
[78] Murtaugh MA, Ma KN, Sweeney C, Caan BJ, Slattery ML. Meat consumption patterns and preparation, genetic variants of metabolic enzymes, and their association with rectal cancer in men and women. J Nutr. 2004 Apr;134(4):776-84.
[79] Newcomb PA, Storer BE, Marcus PM. Cigarette smoking in relation to risk of large bowel cancer in women. Cancer Res. 1995;55:4906–4909.
[80] Ning Y, Wang L, Giovannucci EL. A quantitative analysis of body mass index and colorectal cancer: findings from 56 observational studies. Obes Rev. 2010 Jan;11(1):19-30.
[81] Nomura AM, Wilkens LR, Murphy SP, Hankin JH, Henderson BE, Pike MC, Kolonel LN. Association of vegetable, fruit, and grain intakes with colorectal cancer: the Multiethnic Cohort Study. Am J Clin Nutr. 2008 Sep;88(3):730-7.
[82] Norat T, Riboli E. Dairy products and colorectal cancer. A review of possible mechanisms and epidemiological evidence. Eur J Clin Nutr. 2003 Jan;57(1):1-17.
[83] Norat T, Bingham S, Ferrari P, Slimani N, Jenab M, Mazuir M, Overvad K, Olsen A, Tjønneland A, Clavel F, Boutron-Ruault MC, Kesse E, Boeing H, Bergmann MM, Nieters A, Linseisen J, Trichopoulou A, Trichopoulos D, Tountas Y, Berrino F, Palli D, Panico S, Tumino R, Vineis P, Bueno-de-Mesquita HB, Peeters PH, Engeset D, Lund E, Skeie G, Ardanaz E, González C, Navarro C, Quirós JR, Sanchez MJ, Berglund G, Mattisson I, Hallmans G, Palmqvist R, Day NE, Khaw KT, Key TJ, SanJoaquin M, Hémon B, Saracci R, Kaaks R, Riboli E. Meat, fish, and colorectal cancer risk: the European Prospective Investigation into cancer and nutrition. J Natl Cancer Inst. 2005 Jun 15;97(12):906-16.
[84] Norat T, Lukanova A, Ferrari P, Riboli E. Meat consumption and colorectal cancer risk: dose-response meta-analysis of epidemiological studies. Int J Cancer. 2002 Mar 10;98(2):241-56.
[85] Parkin DM, Boyd L, Walker LC. 16. The fraction of cancer attributable to lifestyle and environmental factors in the UK in 2010. Br J Cancer. 2011 Dec 6;105 Suppl 2:S77-81.
[86] Petrides PE. Tumorgewebe. In: Löffler G, Petrides PE (Hrsg.). Biochemie und Pathobiochemie. 7. Auflage, Berlin/Heidelberg/New York, Springer 2003
[87] Pischon T, Lahmann PH, Boeing H, Friedenreich C, Norat T, Tjonneland A, Halkjaer J, Overvad K, Clavel-Chapelon F, Boutron-Ruault MC, Guernec G, Bergmann MM, Linseisen J, Becker N, Trichopoulou A, Trichopoulos D, Sieri S, Palli D, Tumino R, Vineis P, Panico S, Peeters PH, Bueno-de-Mesquita HB, Boshuizen HC, Van Guelpen B, Palmqvist R, Berglund G, Gonzalez CA, Dorronsoro M, Barricarte A, Navarro C, Martinez C, Quiros JR, Roddam A, Allen N, Bingham S, Khaw KT, Ferrari P, Kaaks R, Slimani N, Riboli E. Body size and risk of colon and rectal cancer in the European Prospective Investigation Into Cancer and Nutrition (EPIC) J Natl Cancer Inst. 2006;98:920–931
[88] Platz EA, Willett WC, Colditz GA, Rimm EB, Spiegelman D, Giovannucci E. Proportion of colon cancer risk that might be preventable in a cohort of middle-aged US men. Cancer Causes Control. 2000 Aug;11(7):579-88.
[89] Pot GK, Habermann N, Majsak-Newman G, Harvey LJ, Geelen A, Przybylska-Philips K, Nagengast FM, Witteman BJ, van de Meeberg PC, Hart AR, Schaafsma G, HooiveldG, Glei M, Lund EK, Pool-Zobel BL, Kampman E. Increasing fish consumption doesnot affect genotoxicity markers in the colon in an intervention study.Carcinogenesis. 2010 Jun;31(6):1087-91.
[90] Riboli E, Norat T. Epidemiologic evidence of the protective effect of fruit and vegetables on cancer risk. Am J Clin Nutr. 2003 Sep;78(3 Suppl):559S-569S.
[91] Rogot E, Murray JL. Smoking and causes of death among US Veterans: 16 years of observation. Public Health Reports. 1980;95:213–222.
[92] Rozen P, Lubin F, Papo N, Knaani J, Farbstein H, Farbstein M, Zajicek G. Calcium supplements interact significantly with long-term diet while suppressing rectal epithelial proliferation of adenoma patients. Cancer. 2001 Feb 15;91(4):833-40.
[93] Sandhu MS, White IR, McPherson K. Systematic review of the prospective cohort studies on meat consumption and colorectal cancer risk: a meta-analytical approach. Cancer Epidemiol Biomarkers Prev. 2001 May;10(5):439-46.
[94] Santarelli RL, Pierre F, Corpet DE. Processed meat and colorectal cancer: a review of epidemiologic and experimental evidence. Nutr Cancer. 2008;60(2):131-44.
[95] Santarelli RL, Vendeuvre JL, Naud N, Taché S, Guéraud F, Viau M, Genot C, Corpet DE, Pierre FH. Meat processing and colon carcinogenesis: cooked, nitrite-treated, and oxidized high-heme cured meat promotes mucin-depleted foci in rats. Cancer Prev Res (Phila). 2010 Jul;3(7):852-64.
[96] Sato Y, Tsubono Y, Nakaya N, Ogawa K, Kurashima K, Kuriyama S, Hozawa A, Nishino Y, Shibuya D, Tsuji I. Fruit and vegetable consumption and risk of colorectal cancer in Japan: The Miyagi Cohort Study. Public Health Nutr. 2005 May;8(3):309-14.
[97] Secretan B, Straif K, Baan R, Grosse Y, El Ghissassi F, Bouvard V, Benbrahim-Tallaa L, Guha N, Freeman C, Galichet L, Cogliano V; WHO International Agency for Research on Cancer Monograph Working Group. A review of human carcinogens--Part E: tobacco, areca nut, alcohol, coal smoke, and salted fish. Lancet Oncol. 2009 Nov;10(11):1033-4.
[98] Seitz HK, Stickel F. Molecular mechanisms of alcohol-mediated carcinogenesis. Nat Rev Cancer. 2007 Aug;7(8):599-612.
[99] Sinha R, Peters U, Cross AJ, Kulldorff M, Weissfeld JL, Pinsky PF, Rothman N, Hayes RB. Meat, meat cooking methods and preservation, and risk for colorectal adenoma. Cancer Res. 2005 Sep 1;65(17):8034-41.
[100] Slattery ML, Potter J, Caan B, Edwards S, Coates A, Ma K-N, Berry TD. Energy balance and colon cancer--beyond physical activity. Cancer Res. 1997;57:75–80
[101] Slavin J. Why whole grains are protective: biological mechanisms. Proc Nutr Soc. 2003 Feb;62(1):129-34.
[102] Smith BK, Robinson LE, Nam R, Ma DW. Trans-fatty acids and cancer: a mini-review. Br J Nutr. 2009 Nov;102(9):1254-66. Epub 2009 Aug 7.
[103] Steinmetz KA, Potter JD. Vegetables, fruit, and cancer. II. Mechanisms. Cancer Causes Control. 1991 Nov;2(6):427-42.
[104] Ströhle A, Maike W, Hahn A. [Nutrition and colorectal cancer]. Med Monatsschr Pharm. 2007 Jan;30(1):25-32.
[105] Sugimura T, Wakabayashi K, Nakagama H, Nagao M. Heterocyclic amines: Mutagens/carcinogens produced during cooking of meat and fish. Cancer Sci. 2004 Apr;95(4):290-9
[106] Thun MJ, Calle EE, Namboodiri MM, Flanders WD, Coates RJ, Byers T, Boffetta P, Garfinkel L, Heath CW., Jr Risk factors for fatal colon cancer in a large prospective study. J Natl Cancer Inst. 1992;84:1491–1500.
[107] Touvier M, Chan DS, Lau R, Aune D, Vieira R, Greenwood DC, Kampman E, Riboli E, Hercberg S, Norat T. Meta-analyses of vitamin D intake, 25-hydroxyvitamin D status, vitamin D receptor polymorphisms, and colorectal cancer risk. Cancer Epidemiol Biomarkers Prev. 2011 May;20(5):1003-16.
[108] Tsoi KK, Pau CY, Wu WK, Chan FK, Griffiths S, Sung JJ. Cigarette smoking and the risk of colorectal cancer: a meta-analysis of prospective cohort studies. Clin Gastroenterol Hepatol. 2009;7:682–688. e1–5.]
[109] Tsubono Y, Otani T, Kobayashi M, Yamamoto S, Sobue T, Tsugane S; JPHC Study Group. No association between fruit or vegetable consumption and the risk of colorectal cancer in Japan. Br J Cancer. 2005 May 9;92(9):1782-4.
[110] Voorrips LE, Goldbohm RA, van Poppel G, Sturmans F, Hermus RJ, van den Brandt PA. Vegetable and fruit consumption and risks of colon and rectal cancer in a prospective cohort study: The Netherlands Cohort Study on Diet and Cancer. Am J Epidemiol. 2000 Dec 1;152(11):1081-92.
[111] Watson AJ, Collins PD. Colon cancer: a civilization disorder. Dig Dis. 2011;29(2):222-8. Epub 2011 Jul 5.
[112] Wolin KY, Yan Y, Colditz GA, Lee IM. Physical activity and colon cancer prevention: a meta-analysis. Br J Cancer. 2009 Feb 24;100(4):611-6.
[113] Wolin KY, Yan Y, Colditz GA. Physical activity and risk of colon adenoma: a meta-analysis. Br J Cancer. 2011 Mar 1;104(5):882-5.
[114] World Cancer Resarch Fund/American Institute for Cancer Research (WCRF/AICR). Food, nutrition, physical activity and the prevention of cancer: a global perspective. American Institute for Cancer Research, Washington DC, 2007. Online verfügbar unter http://eprints.ucl.ac.uk/4841/1/4841.pdf
[115] World Cancer Research Fund (WCRF)/American Institute for Cancer Research (AICR). Continuous Update Project Colorectal Cancer Report 2010 Summary, May 2011. Online verfügbar unter http://www.wcrf.org/PDFs/Colorectal-cancer-report-summary-2011.pdf
[116] World Cancer Research Fund (WCRF)/American Institute for Cancer Research (AICR). Policy and Action for Cancer Prevention. Food, Nutrition and Physical Activity: A Global Perspective. AJCR, Washington, Dc, 2009
[117] World Hehalth Organization (WHO). World Cancer Report 2008, Editors: Boyle P, Levin B, International Agency for Research on Cancer (IARC, 2008. Online verfügbar unter http://www.iarc.fr/en/publications/pdfs-online/wcr/2008/wcr_2008.pdf
[118] Key TJ, Appleby PN, Spencer EA, Travis RC, Roddam AW, Allen NE. Cancer incidence in vegetarians: results from the European Prospective Investigation into Cancer and Nutrition (EPIC-Oxford). Am J Clin Nutr. 2009 May;89(5):1620S-1626S.
[119] Key TJ, Fraser GE, Thorogood M, Appleby PN, Beral V, Reeves G, Burr ML, Chang-Claude J, Frentzel-Beyme R, Kuzma JW, Mann J, McPherson K. Mortality in vegetarians and nonvegetarians: detailed findings from a collaborative analysis of 5 prospective studies. Am J Clin Nutr. 1999 Sep;70(3 Suppl):516S-524S.
Korrespondenzautor
Dr. Alexander Ströhle
Leibniz Universität Hannover
Institut für Lebensmittelwissenschaft
und Humanernährung
Am Kleinen Felde 30
30167 Hannover
E-Mail stroehle@nutrition.uni-hannover.de





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.