
- DAZ.online
- DAZ / AZ
- DAZ 32/2012
- Gesundheitliche Effekte ...
Ballaststoffe
Gesundheitliche Effekte von Ballaststoffen

Neben ihrer primären, auf den Gastrointestinaltrakt begrenzten Wirkung, üben Ballaststoffe weitere, auf den Gesamtstoffwechsel bezogene Effekte aus. Zu diesen systemischen Wirkungen zählen u. a. die Beeinflussung des Lipid-, Glucose- und Insulinstoffwechsels sowie antiinflammatorische Effekte. Nicht zuletzt deshalb wird der quantitativen und qualitativen Ballaststoffzufuhr eine wichtige Bedeutung für die Prävention verschiedener „Western diseases“ beigemessen [4 – 5; 25; 59; 61 – 62; 70; 73; 83]. Dazu zählen im Wesentlichen:
Übergewicht und Adipositas
Diabetes mellitus Typ 2
Dyslipoproteinämien, Hypertonie und koronare Herzerkrankungen
Kolorektale Tumoren
Die umfangreiche Datenlage zum Zusammenhang von Ballastsstoffaufnahme und Erkrankungsrisiko wurde zwischenzeitlich z. T. metaanalytisch ausgewertet und in umfangreichen Übersichtsarbeiten dokumentiert [3; 5; 7; 13; 38; 53; 61 – 62; 70; 72; 81; 82; 84; 89; 93]. Auch wurde das Datenmaterial jüngst von einer Expertengruppe der Deutschen Gesellschaft für Ernährung e. V. (DGE) gesichtet und unter evidenzbasierten Kriterien bewertet [22]. Hierzu wurden die Studien zunächst in Abhängigkeit ihres Designs verschiedenen Evidenzklassen zugewiesen. Dabei bilden Metaanalysen von randomisierten, kontrollierten Interventionsstudien (RCTs) die höchste Evidenzstufe (Klasse Ia); nicht-analytische Studien wie Fall-Kontroll- und Querschnittsuntersuchungen wurden in die niedrigste Evidenzkategorie (Klasse IV) eingeordnet. Darauf aufbauend wurde – in Anlehnung an das Bewertungsschema der IARC (International Agency for Research on Cancer; Europäisches Krebsforschungszentrum) [40] – eine Bewertung der Evidenz nach Härtegraden vorgenommen [12].
Die folgenden Ausführungen basieren in wesentlichen Teilen auf dieser jüngsten DGE-Leitlinie, ergänzt um aktuelle Studienergebnisse und Hintergrundinformationen.
Ballaststoffe in der Prävention von Übergewicht und Adipositas
Hintergrund: Übergewicht und Adipositas stellen in Deutschland und anderen Industrienationen das zentrale Gesundheitsproblem dar [42]. Nach Daten des neuen großen Erwachsenen-Gesundheitssurveys „Studie zur Gesundheit Erwachsener in Deutschland“, die vom Robert Koch-Institut durchgeführt und am 14. Juni 2012 vom Bundesministerium für Gesundheit (BMG) vorgestellt wurde, gelten 67,1 % der Männer und 53,0 % der Frauen als übergewichtig (BMI: ≥ 25 kg/m2); etwa 23 % sind adipös (BMI: ≥ 30 kg/m2) [30]. Besonders besorgniserregend ist die Zunahme der Adipositasprävalenz im Kindes- und Jugendalter. Wie die Daten des Kinder- und Jugendgesundheitssurveys (KiGGS) zeigen, sind 15 % der Kinder in Deutschland übergewichtig; etwa 6 % gelten als adipös [45]. Übergewicht und Adipositas sind nicht nur als kosmetisches Problem anzusehen, vielmehr begünstigen sie die Entstehung zahlreicher Erkrankungen. Nach Schätzungen der WHO sind etwa 44 % aller Diabetes-Fälle, 23 % aller koronaren Herzerkrankungen und 7 bis 41 % der Tumorerkrankungen auf Adipositas zurückzuführen. Die Adipositas stellt somit eine erhebliche Belastung für das Gesundheitssystem dar. Gegenwärtig verursacht Adipositas Kosten in Höhe von mindestens 17 Mrd. Euro jährlich [33].
Epidemiologischer Zusammenhang: Sowohl Querschnitts- als auch prospektive Kohortenstudien weisen in der Mehrzahl auf eine inverse Assoziation zwischen der Ballaststoffzufuhr und dem Adipositasrisiko hin. In zwei großen Querschnittsstudien mit mehr als 100.000 Teilnehmern war das Adipositasrisiko bei Personen mit der höchsten Ballaststoffaufnahme 23 % geringer als bei Personen mit niedriger Zufuhr (RR 0,77; 95 % CI 0,68 – 0,87) [3]. Auch die zusammenfassende Auswertung von vier Kohortenstudien mit etwa 115.000 Teilnehmern zeigt einen ähnlichen Zusammenhang: Je mehr Ballaststoffe konsumiert werden, desto geringer das Risiko für einen unerwünschten Gewichtsanstieg. In der Nurses‘ Health Study hatten z. B. Frauen in der höchsten Quintile der Ballaststoffaufnahme ein um 49 % vermindertes Risiko für die Entwicklung von Übergewicht bzw. Adipositas, verglichen mit Frauen in der niedrigsten Quintile (OR 0,51; 95 % CI 0,39 – 0,67) [50]. Auch in einer jüngeren, im Rahmen des DIOGenes Project durchgeführten Auswertung der EPIC-Studie mit 89.432 Teilnehmern war ein inverser Zusammenhang zwischen der Ballaststoffaufnahme und der Zunahme des Körpergewichts bzw. des Taillenumfangs nachzuweisen [23]. Insgesamt weisen die Beobachtungsstudien darauf hin, dass eine erhöhte Ballaststoffzufuhr das Risiko für Übergewicht bzw. Adipositas um etwa 30 % reduziert [3].
Im Gegensatz zu den Beobachtungsstudien mangelt es bislang an Interventionsstudien, die einen protektiven Effekt von Ballaststoffen im Rahmen der Primärprävention belegen. Hinweise hierfür liefern Daten einer einjährigen Pilotstudie zur Adipositasprävention. In dieser Untersuchung bei 40 jungen Frauen mit familiärer Prädisposition für Adipositas sah zwar die Intervention keine Erhöhung der Ballaststoffaufnahme vor; bei der Auswertung war jedoch eine inverse Beziehung zwischen der Ballaststoffdichte der Nahrung und dem Gewichtsanstieg nachzuweisen [24]. Für einen risikosenkenden Effekt spricht auch die multivariate Sekundärauswertung des Women‘s Health Initiative Dietary Modification Trial (WHI) mit etwa 49.000 US-Amerikanerinnen. Hier war eine Steigerung der Ballaststoffzufuhr im Verlauf der 7,5-jährigen Nachbeobachtungsphase im Trend mit einem Gewichtsverlust assoziiert [37].
Hinweise für einen protektiven Effekt von Ballaststoffen hinsichtlich Übergewicht bzw. Adipositas liefern auch Interventionsstudien zur Gewichtsreduktion. So wurde bereits im Jahr 2001 im Rahmen einer systematischen Übersichtsarbeit gezeigt: Eine Steigerung der Ballaststoffaufnahme um 14 g/Tag (Quellen: Ballaststoffzusätze oder ballaststoffreiche Nahrungsmittel) führt im Verlauf von etwa 4 Monaten zu einer Gewichtsreduktion von 1,9 kg. Mit einem Gewichtsverlust von 2,4 kg war der Effekt bei übergewichtigen oder adipösen Personen besonders ausgeprägt. Normalgewichtige Personen verloren im gleichen Zeitraum nur 0,8 kg [38]. Auch eine Auswertung von 21 randomisierten placebokontrollierten Studien (RCTs) aus dem Jahr 2009 kam zu einem ähnlichen Ergebnis. In Abhängigkeit der Ballaststoffquelle ergaben sich folgende Resultate [3]:
Ballaststoffreiche Lebensmittel: In die Auswertung einbezogen wurden 5 RCTs. Verglichen mit der Kontrollgruppe erzielten Personen, die ballaststoffreiche Lebensmittel erhalten hatten, einen um 1 kg größeren Gewichtsverlust (Beobachtungszeitraum: 8 Wochen).
Ballaststoffzusätze (Supplemente): Die Auswertung umfasste 16 RCTs mit insgesamt 814 Teilnehmern (391 in der Verum- und 423 in der Placebogruppe). Die Ballaststoffzufuhr (primär in Form von unlöslichen Ballaststoffen, teils in Form von Guar Gum) erfolgte vorwiegend in Form von Tabletten oder Kapseln; die Dosis schwankte zwischen 4,5 und 20 g/Tag (im Mittel 7,5 g/Tag, verteilt auf 3 Mahlzeiten). Sowohl die Probanden der Verum- wie auch der Placebogruppe erhielten eine kalorisch restriktive Ernährung. Im Verlauf der zwölfwöchigen Beobachtungsphase erzielten die Personen in der Ballaststoffgruppe (- 4,9 kg; - 4,9 %) einen 2,2 kg stärkeren Gewichtsverlust als die Studienteilnehmer der Placebogruppe (- 2,7 kg; - 2,7 %).
Die bislang umfassendste und differenzierteste Analyse zum Einfluss der Ballaststoffzufuhr auf die Gewichtsentwicklung stammt von einer niederländischen Forschergruppe und wurde 2011 im renommierten Fachorgan Obesity Reviews veröffentlicht.
In die systematische Übersichtsarbeit wurden über 60 Interventionsstudien einbezogen und in Abhängigkeit von Ballaststofftyp und -dosis ausgewertet (siehe Tab. 1). Die Kernergebnisse lauten [89]:
Unabhängig von der Ballaststoffart reduziert eine Ballaststoffaufnahme von im Mittel 11 g/Tag im Verlauf von etwa 11 Wochen das Körpergewicht um 0,7 kg. Das entspricht einer Gewichtsreduktion von 0,4 % im Verlauf von 4 Wochen.
Als besonders effektiv haben sich lösliche Ballaststoffe, darunter Fructane (Inulin, Fructooligosaccharide) und aquatische Polysaccharide wie Alginate oder Agar erwiesen. Der Gewichtsverlust im Verlauf von 11 bis 13 Wochen beträgt bei einer Zufuhr von 10 bis 14 g/Tag zwischen 3,5 und 6,3 kg. Das entspricht einer Gewichtsreduktion von etwa 1,7 % pro Monat. Mit Chitosan und Glukomannanen (Dosis 2 – 3 g/Tag) sowie mit Dextrinen und Weizenkleie (Dosis etwa 14 g/Tag) lässt sich im Verlauf von 4 Wochen ein Gewichtsverlust von 0,3 bis 0,95 %, entsprechend einer Körpergewichtsreduktion von 0,7 bis 1,0 kg, erzielen. Die meisten anderen Ballaststoffe haben keine oder nur sehr schwache Effekte auf die Gewichtsentwicklung (siehe Tab. 2).
Zwischen der Ballaststoffzufuhr und der Gewichtsentwicklung besteht eine Dosis-Wirkungs-Beziehung. Danach ist ein Anstieg der Ballaststoffaufnahme – unabhängig von der Ballaststoffart – um 1 g/Monat mit einem Gewichtsverlust von 0,014 % verbunden. Differenziert nach der physikochemischen Beschaffenheit der Ballaststoffe, zeigt sich nur für Chitosan ein deutlicher Dosis-Wirkungszusammenhang.
Basierend auf der Auswertung der Interventionsstudien scheint der Effekt der Ballaststoffe auf die Körpergewichtsreduktion von im Mittel etwa 0,4 % gering zu sein. Für eine Referenzperson mit 80 kg entspricht das gerade einmal einem Gewichtsverlust von 320 g/Monat. Allerdings ist davon auszugehen, dass die gegenwärtig in westlichen Industrienationen zu beobachtende Adipositasepidemie auf einer jährlichen Körpergewichtszunahme von 0,5 bis 1,0 kg beruht [36]. Vor diesem Hintergrund ist der durch eine ballaststoffreiche Kost zu erzielende Effekt also durchaus klinisch relevant [89].
Wirkmechanismen: Über welche biochemisch-physiologischen Prozesse Ballaststoffe zur Verringerung des Adipositasrisikos beitragen, wird seit Langem diskutiert [3; 61; 71; 89]. Zu den möglichen Mechanismen zählen:
Herabsetzung der Energiedichte: Der Verzehr einer Nahrung mit niedriger Energiedichte – ausgedrückt in kcal/100 g – senkt mit überzeugender Evidenz das Risiko für eine Körpergewichtszunahme [51 – 52; 80]. Generell gilt für Lebensmittel: Je höher der Ballaststoff- und Wasseranteil ist, desto niedriger die Energiedichte. Entsprechend wird die Energiedichte einer Kost umso geringer ausfallen, je höher der Anteil schwerer und voluminöser, das heißt wasser- und ballaststoffreicher Lebensmittel ist [78]. Durch die Herabsetzung der Energiedichte können Ballaststoffe bzw. ballaststoffreiche Kostformen die Energieaufnahme reduzieren und so längerfristig der Entstehung von Übergewicht entgegenwirken [89].
Verbesserte Sättigung: Ein mit der Nahrungsaufnahme verbundenes, früh einsetzendes und lang anhaltendes Sättigungsgefühl ist ein wichtiger Faktor, um die Energiezufuhr auf einem niedrigen Niveau zu halten und so einem Anstieg des Körpergewichts vorzubeugen [78].
Wie eine systematische Auswertung von Interventionsstudien belegt, reduzieren Ballaststoffe unabhängig von der chemischen Beschaffenheit die Nahrungs- und Energieaufnahme. Bei einer Ballaststoffzufuhr von durchschnittlich 8,5 g reduziert sich der subjektive Appetit im postprandialen Verlauf von 1 bis 4 Stunden um 4,2 bis 5,2 %; die längerfristige Energieaufnahme sinkt im Schnitt um 2,6 % [89].
In Abhängigkeit ihrer physikochemischen Eigenschaften beeinflussen Ballaststoffe in unterschiedlichem Maß die Sättigung und Energieaufnahme. Generell zeigen gut lösliche Ballaststoffe stärkere Effekte als weniger lösliche (siehe Tab. 2).
Die Mechanismen, die diesen Wirkungen zugrunde liegen, umfassen:
(1) Effekte in der Mundhöhle: Der höhere Kauaufwand für ballaststoffreiche Kostformen bewirkt eine verlangsamte und verminderte Nahrungsaufnahme [77].
(2) Effekte im Magen und Dünndarm: Das Wasserbindungs- und Quellvermögen von Ballaststoffen führt im Magen zu einer Volumen- und Viskositätserhöhung des Nahrungsbreis. Die Folge ist eine verzögerte Magenentleerung und eine durch Dehnungsrezeptoren vermittelte Aktivierung anorektischer Signalmoleküle im Hypothalamus [77]. Generell gilt: Je schwerer und voluminöser, d. h. je ballaststoff- und wasserreicher die Mahlzeit, desto schneller und stärker die Sättigung – unabhängig von ihrem Energiegehalt [66]. Vor diesem Hintergrund überrascht es nicht, dass zum Gewichtserhalt eine ballaststoff- und proteinreiche Ernährung mit verminderter Zufuhr energiedichter, hochglykämisch wirksamer Stärke- und Zuckererzeugnisse am besten geeignet ist, wie eine Multizenterstudie mit 773 Teilnehmern belegt [46]. Auch modulieren Ballaststoffe die Sekretion gastrointestinaler, als Sättigungssignale fungierender Hormone (u. a. Cholecystokinin, gastroinhibitorisches Polypeptid (GIP, glucagon-like-peptide) (siehe Teil 1; [77]). Inwieweit die aufgezeigten Effekte beim Menschen von Relevanz sind, wird allerdings kontrovers diskutiert [18; 71]
(3) Effekte im Kolon: Fermentierbare Ballaststoffe (u. a. resistente Stärke, Pektin und Inulin) werden in tieferen Darmabschnitten von der dortigen Mikroflora zu kurzkettigen Fettsäuren (Azetat, Propionat und Butyrat) abgebaut (siehe Teil 1; [78]). Kurzkettige Fettsäure (KKFS) binden an zwei G-Protein-gekoppelte Rezeptortypen (FFA-2 und FFA 3). Diese werden u. a. von Kolonozyten und Adipozyten exprimiert. Die Bindung von KKFS aktiviert die beiden FFA-Subtypen, wodurch die Dickdarmzellen vermehrt Peptid YY (PYY) in die Blutbahn abgeben. Im Gehirn wirkt PYY als Sättigungssignal, so dass Ballaststoffe auf diesem Weg die Nahrungsaufnahme reduzieren können [18; 71].
Umgekehrt antwortet der Organismus bei niedrigem Angebot an KKFS, d. h. bei Ballaststoffmangel, mit Appetitsteigerung. Die biochemische Beziehung zwischen KKFS, FFA-Rezeptoren und Sättigung wird ergänzt durch das Hormon Leptin: Die Aktivierung von FFA-3 mittels KKFS induziert in Adipozyten die Expression von Leptin, einem weiteren Sättigungshormon. Auch modulieren Ballaststoffe die Sekretion gastrointestinaler, als Sättigungssignale fungierender Hormone (u. a. Cholecystokinin, gastroinhibitorisches Polypeptid (GIP, glucagon-like-peptide)) (siehe Teil 1; [77]). Inwieweit die aufgezeigten Effekte beim Menschen von Relevanz sind, wird allerdings kontrovers diskutiert [18; 71]
(4) Effekte auf den Glucose- und Insulinstoffwechsel: Wie in Teil 1 beschrieben, vermindern Ballaststoffe, insbesondere lösliche wie Guar, Psyllium oder Pektin, den postprandialen Blutzucker- und Insulinanstieg [77]. Die reduzierte Insulinsekretion steht mit einer verminderten Fettspeicherung in Zusammenhang, wodurch der Entstehung von Übergewicht entgegengewirkt wird. Möglicherweise trägt auch der flache postprandiale Blutzuckerverlauf (Stichwort „stabiler Blutzuckerspiegel“) und ein hierdurch bedingtes längerfristiges Sättigungsgefühl zur Gewichtsstabilisierung bei [61].
Zusammenfassende Evidenzbewertung: Vor dem Hintergrund der aufgezeigten biochemisch-physiologischen Plausibilität und der Befunde aus Kohortenstudien, senkt eine erhöhte Ballaststoffzufuhr mit wahrscheinlicher Evidenz das Adipositasrisiko [15].
Wider die Insulinresistenz – Ballaststoffe in der Prävention von Typ-2-Diabetes
Hintergrund: Diabetes mellitus zählt zu den häufigsten endokrinen Störungen. Schätzungen zufolge leben in Deutschland rund 8 Millionen Diabetiker, wovon der Großteil (etwa 90 %) an Typ-2-Diabetes leidet. Im Zentrum der Erkrankung steht die Störung der Insulinwirkung an den peripheren Zielzellen (Insulinresistenz), begleitet von einer in der Frühphase der Krankheit kompensatorischen Hyperinsulinämie. Defekte der Betazellen führen schließlich zur Diabtes-Typ-2-Manifestation. Aufgrund der veränderten Lebens- und Ernährungsgewohnheiten ist in den nächsten Jahren mit einem weltweiten Anstieg der Typ-2-Diabetes-Fälle zu rechnen. Bei nicht fachgerechter Stoffwechselführung begünstigt Diabetes mellitus die Entstehung von Folgeerkrankungen (u. a. Atherosklerose, mikroangiopathische Veränderungen an Niere und Auge). Die daraus resultierenden Kosten stellen eine erhebliche Belastung für das Gesundheitssystem dar. So stiegen die direkten Ausgaben für die Behandlung von Diabetikern von 27,8 Millionen Euro im Jahr 2000 auf 42 Millionen im Jahr 2007. Die Zunahme der Folgekosten lag im gleichen Zeitraum bei rund 49 %, was im Jahr 2007 Aufwendungen in Höhe von 19,1 Millionen Euro entspricht [33].
Epidemiologischer Zusammenhang: Bereits Mitte der 1970er Jahre wies der Brite Hugh C. Trowell (1904 – 1989) auf die ätiologische Bedeutung von Ballaststoffen bei Diabetes mellitus hin [85]. Unterstützt wurde die Ballaststoff-Hypothese durch ökologische Studien in den USA. Diese zeigten, dass die epidemische Zunahme der Diabetes-Typ-2-Fälle der letzten Jahre von einem rückläufigen Verzehr ballaststoffreicher Lebensmittel begleitet wurde [32]. Auch mehrere großangelegte Kohortenstudien weisen auf eine inverse Assoziation zwischen der Ballaststoffzufuhr und dem Typ-2-Diabetes-Risiko hin. Sowohl in einer Nachbeobachtung der Nurses‘ Health Study [67] als auch in der IOWA Women‘s Health Study [54], dem Finnish Mobile Clinic Health Examination Survey [56] und der British Regional Heart Study [90] erwies sich eine hohe Ballaststoffzufuhr als Diabetes-Schutzfaktor. Die zusammenfassende Auswertung von fünf Kohortenstudien mit fast 240.000 Teilnehmern ergab eine Risikoreduktion von 19 % für die Gruppe mit der höchsten Ballaststoffzufuhr.
Allerdings existieren auch prospektive Kohortenstudien, die den protektiven Effekt der Gesamtballaststoffzufuhr nicht bestätigen konnten (Übersicht bei [69]). Weitgehend konsistent dagegen sind die Ergebnisse der Studien zum Einfluss von Ballaststoffen aus Getreide und von Vollkornprodukten auf das Risiko, an Typ-2-Diabetes zu erkranken. So ergab eine 2007 durchgeführte Metaanalyse von 9 prospektiven Kohortenstudien einen deutlichen Schutzeffekt für Getreideballaststoffe: Personen im obersten Quintil oder Quartil der Ballaststoffzufuhr hatten ein um 33 % vermindertes Erkrankungsrisiko, verglichen mit Personen mit geringer Zufuhr (RR 0,67; 95 % CI 0,62 – 0,72) [70]. Ein ähnlich protektiver Effekt zeigt sich für Vollkornprodukte, wie eine weitere Metaanalyse von 7 Kohortenstudien belegt. Mit jeder Steigerung des Vollkornproduktverzehrs um 2 Portionen/Tag sinkt das Diabetes-Risiko um 21 % (RR 0,79; 95 % CI 0,72 – 0,87) [20]. Basierend auf einer zusammenfassenden Auswertung von 11 Studien mit über 427.000 Teilnehmern wird geschätzt, dass die reichliche Aufnahme von Vollkornprodukten und Getreideballaststoffen das Erkrankungsrisiko um 29 % senkt [3].
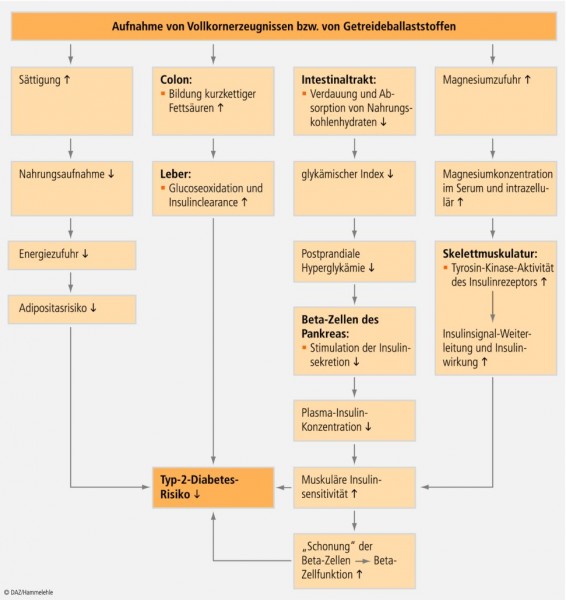
Wirkmechanismen: Die protektiven Effekte von Getreideballaststoffen bzw. Vollkornprodukten werden zum einen auf indirekte und direkte Effekte der Ballaststoffe selbst sowie auf Begleitsubstanzen, insbesondere Magnesium, zurückgeführt (siehe Abb. 1):
Senkung des Adipositasrisikos: Adipositas, insbesondere in ihrer abdominalen Ausprägung (Stammfettsucht; „Apfeltyp“), erhöht mit überzeugender Evidenz das Risiko für Typ-2-Diabetes. Die oben in Zusammenhang mit der Gewichtsentwicklung erläuterten Effekte von Ballaststoffen auf Sättigung und Nahrungsaufnahme legen nahe, dass vermehrter Konsum von Getreideballaststoffen indirekt das Typ-2-Risiko senkt, indem der Entstehung von Übergewicht entgegengewirkt wird [3].
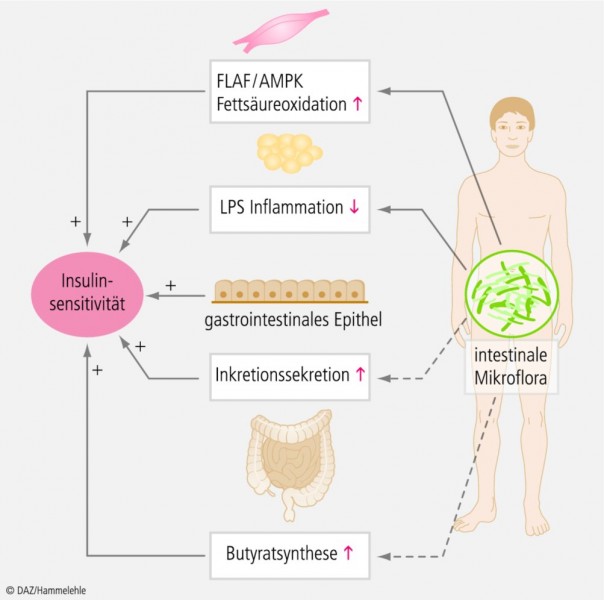
Verbesserung der Insulinsensitivität: Wie oben erwähnt, steht die Insulinresistenz im Zentrum der Pathophysiologie des Typ-2-Diabetes. Sowohl Kohorten- als auch Interventionsstudien (siehe Tab. 3) weisen darauf hin, dass die vermehrte Zufuhr von Ballaststoffen mit einer verbesserten Insulinsensitivität einhergeht [3]. Es existieren verschiedene Hypothesen, die diesen Sachverhalt erklären, darunter solche, die den Einfluss der Intestinalflora in den Fokus stellen (siehe Abb. 2).
Danach modifizieren (fermentierbare) Ballaststoffe die Zusammensetzung der Dickdarmbakterien, wodurch es zu Veränderungen im Stoffwechsel des Gesamtorganismus kommt [19; 26; 57; 88; 92]:
(1) Hochregulation der AMP-abhängigen Proteinkinase (AMPK) im Muskel- und Lebergewebe und einer dadurch bedingten Steigerung der Fettsäureoxidation.
(2) Reduktion der Bildung von Endotoxinen, insbesondere von bakteriellen Lipopolysacchariden (LPS). LPS stimulieren im Organismus die Bildung proinflammatorischer Cytokine, darunter TNF-α. Dieser Mediator setzt die Insulinwirkung und Glucoseprozessierung in der Muskel- und Leberzelle herab.
(3) Vermehrte Bildung von Butyrat durch Firmicutes prausnitzii. Eine Steigerung der Butyrat-Plasmaspiegel verbessert die Insulinsensitivität. Zurückzuführen ist dies eventuell auf die antiinflammatorischen Effekte von Butyrat.
(4) Modulation der Inkretion-Sekretion, u. a. Abgabe von GIP und GLP-1, die in Zusammenhang mit dem Glucose- und Insulingeschehen stehen.Abnahme der postprandialen Hyperglykämie: Die β-Zellen des Pankreas werden in hohem Maße durch Blutzuckerspitzen beansprucht, um dem kompensatorisch gesteigerten Insulinbedarf Rechnung zu tragen. Dies gilt besonders bei insulinresistenten Personen. Die Hyperinsulinämie ist insofern problematisch, als im Frühstadium der Diabetes-Erkrankung („Prädiabetes“) Insulin die Nahrungsaufnahme und damit das Substratangebot steigert. Diese Vorgänge münden in einen sich gegenseitig aufschaukelnden Prozess, bestehend aus Hyperinsulinämie, insulinstimulierter Fettgewebsbildung und einer dadurch verstärkten Insulinresistenz, wodurch wiederum die Insulinsekretion und letztlich das Diabetes-Typ-2-Risiko ansteigt [78]. Die günstigen Effekte von Ballaststoffen auf den postprandialen Glucoseverlauf vermindern die Hyperinsulinämie (siehe Teil 1). Dadurch wirken sie einer als „Down-Regulation“ bezeichneten Abnahme der Membran gebundenen Insulinrezeptoren in den peripheren Geweben entgegen. Auch die Affinität des Insulins zu seinen Rezeptoren wird verbessert. Beide Veränderungen verbessern die Insulinsensitivität; die Gefahr einer Insulinresistenz sinkt.
Zusammenfassende Evidenzbewertung: Basierend auf der aufgezeigten biochemisch-physiologischen Plausibilität, die im Gegensatz zu den divergierenden Ergebnissen aus Kohortenstudien steht, wurde die Evidenz für einen fehlenden Zusammenhang zwischen der Gesamtballaststoffaufnahme und dem Typ-2-Diabetes-Risiko als möglich gewertet. Dagegen senkt eine hohe Zufuhr von Ballaststoffen aus Getreide bzw. ein hoher Verzehr von Vollkornprodukten mit wahrscheinlicher Evidenz das Erkrankungsrisiko [69].
Dyslipoproteinämie und Hypertonie – Ballaststoffe in der Prävention der KHK
Hintergrund: Die koronare Herzerkrankung (KHK) ist die bedeutsamste Organmanifestation der Atherosklerose. In Deutschland entfielen im Jahr 2010 15,5 % aller Todesfälle auf ischämische Herzerkrankungen. Nahrungsfaktoren wie Ballaststoffe modifizieren bestimmte Risikofaktoren (u. a. hohes Verhältnis von Gesamt- zu HDL-Cholesterol, Hypertonie) und nehmen dadurch Einfluss auf das Erkrankungsrisiko [47; 53; 74; 86].
Epidemiologischer Zusammenhang: Der Effekt der Ballaststoffaufnahme auf das KHK-Risiko wurde in einer Vielzahl von Beobachtungsstudien analysiert. Die Ergebnisse der darauf basierenden Metaanalysen und systematischen Übersichten lassen sich wie folgt zusammenfassen [3; 48]:
In einer gepoolten Auswertung von 10 prospektiven Kohortenstudien mit 5249 KHK-Fällen und einer Nachbeobachtungsperiode von 6 bis 10 Jahren, sank das KHK-Risiko bei einer Steigerung der Gesamtballaststoffaufnahme um 10 g/Tag um 14 % (RR 0,86; 95 % CI 0,78 – 0,96); für tödliche KHK-Ereignisse verringerte sich das Risiko um 27 % /RR 0,73; 95 % CI 0,61 – 0,87).
Aufgeschlüsselt nach der Ballaststoffquelle ergaben sich pro Anstieg der Zufuhr um 10 g/Tag folgende Resultate:
(1) Getreideballaststoffe. Nicht-signifikante Senkung des KHK-Risikos um 10 % (RR 0,90; 95 % CI 0,77 – 1,07) und signifikante Reduktion tödlicher KHK-Ereignisse um 25 % (RR 0,75; 95 % CI 0,63 – 0,91).
(2) Ballaststoffe aus Gemüse. 16 % reduziertes KHK-Risiko (RR 0,84; 95 % CI 0,70 – 0,99) und 30 % vermindertes Risiko für tödliche KHK-Ereignisse.
(3) Ballaststoffe aus Obst. Nicht-signifikante Senkung des Erkrankungs- und KHK-Sterblichkeitsrisikos (RR 1,00; 95 % CI, 0,88 – 1,13 bzw. 1,00; 95 % CI 0,82 – 1,23).
Weiterhin ergab die differenzierte Analyse, dass sowohl die Zufuhr löslicher als auch unlöslicher Balllaststoffe invers mit dem Risiko für KHK in Zusammenhang steht. Allerdings war der protektive Effekt löslicher Ballaststoffe (Risikosenkung um 28 % für KHK) deutlicher ausgeprägt als der unlöslicher Nahrungsfasern (Risikosenkung um 10 %) [62].In einer darauffolgend publizierten Metaanalyse aus dem Jahr 2005 mit 7 Kohortenstudien und mehr als 158.000 Teilnehmern, war das Risiko für KHK ebenfalls invers mit der Ballaststoffzufuhr korreliert. Für Personen mit der höchsten Ballaststoffaufnahme wurde ein um 29 % vermindertes Erkrankungsrisiko errechnet [3].
Die jüngste und umfassendste systematische Auswertung wurde 2009 von einer kanadischen Arbeitsgruppe um Andrew Mente in der Fachzeitschrift Archives of Internal Medicine veröffentlicht. In die Analyse einbezogen wurden 14 Kohortenstudien mit 215.054 Teilnehmern. Für Personen in der höchsten Quantile der Ballaststoffzufuhr ergab sich ein 22 % geringeres KHK-Risiko, verglichen mit Personen in der untersten Quantile (RR 0,78; 95 % CI 0,72 – 0,84) [53].
Wirkmechanismen: Der präventive Effekt der Ballaststoffe bei KHK beruht auf einer Reihe direkter und indirekter Mechanismen [3]:
Senkung der etablierten KHK-Risikofaktoren Adipositas und Diabetes mellitus Typ 2 (siehe oben).
Abnahme des LDL- und Gesamtcholesterols (siehe Teil 1; [77; 94]) und damit des Quotienten aus Gesamtcholesterol und HDL-Cholesterol, einem aussagekräftigen Prädiktor des KHK-Risikos [29].
Positive Beeinflussung des (postprandialen) Dysmetabolismus (postprandiale Blutzuckerspitzen, kompensatorische Hyperinsulinämie) (siehe oben). Postprandiale Hyperglykämien gelten zwischenzeitlich als ein wichtiger unabhängiger Risikofaktor für Herz-Kreislauf-Erkrankungen [16]. Dabei sind postprandiale Blutzuckerspitzen wesentlich enger mit Herz-Kreislauf-Erkrankungen assoziiert als der Nüchtern-Blutzucker. Bereits starke Blutzuckerschwankungen mit hohen Spitzen und tiefen Abfällen gelten inzwischen als kardiovaskulärer Risikofaktor [55].
Entzündungshemmung (Senkung des C-reaktiven Proteins; CRP und Tumor-Nekrose-Faktors α; TNF-α) [17; 43 – 44; 58; 87].
Antihypertensiver Effekt. In zwei Metaanalysen aus den Jahren 2004 und 2005 wurden die Effekte des Ballaststoffverzehrs auf den Blutdruck analysiert. In beiden Auswertungen von randomisierten Interventionsstudien wurde bei einer durchschnittlichen Ballaststoff-Mehrzufuhr von 11 g/Tag ein hypotensiver Effekt (Senkung des systolischen und diastolischen Werts) festgestellt. Dieser Befund war jedoch nur für Patienten mit Hypertonie konsistent nachweisbar [72; 93].
Zusammenfassende Evidenzbewertung: Insgesamt wird die Evidenz für einen KHK-protektiven Effekt durch die vermehrte Zufuhr von Ballaststoffen (Gesamtballaststoffe sowie lösliche und unlösliche Nahrungsfasern) als wahrscheinlich bewertet. Für Getreide- und Obstballaststoffe gilt die Evidenz als möglich [48]. Für die KHK-Risikofaktoren Hypertonie bzw. Gesamt- und LDL-Cholesterol wird der risikosenkende Effekt der Gesamtballaststoffzufuhr als wahrscheinlich bzw. möglich gewertet. Lösliche Ballaststoffe senken mit überzeugender Evidenz das Gesamt- und LDL-Cholesterol [10; 94].
Ballaststoffe in der Prävention von Tumoren des Dick- und Enddarms
Hintergrund: Mit jährlich etwa 1,2 Millionen Neuerkrankungen zählen Tumoren des Dick- und Enddarms weltweit zu den dritthäufigsten Krebserkrankungen [27]. Gemäß dem Mehrstufen-Modell der Adenom-Karzinom-Sequenz lässt sich die Genese des kolorektalen Karzinoms in einzelne Schritte unterteilen. Danach stehen präneoplastische Veränderungen (aberrant crypt foci; ACF) am Beginn einer oft langjährigen Entwicklung, in deren Folge benigne Adenome entstehen, die schließlich zu Adenokarzinomen transformieren. Verantwortlich hierfür sind Mutationen von Onkogenen und Tumorsuppressorgenen, die im Verlauf der Tumorentstehung akkumulieren und die klonale Expansion der Tumorzellen bedingen. Nahrungsfaktoren können sowohl auf die Initiationsphase der Krebsentstehung als auch auf die weiteren Schritte der Promotion und Progression Einfluss nehmen. Entsprechend stellt die Ernährung einen potenten Expositionsfaktor dar, der das Risiko für kolorektale Tumoren modifiziert [75 – 76].
Epidemiologischer Zusammenhang: Basierend auf der Beobachtung, dass kolorektale Krebserkrankungen bei traditionell sich sehr ballaststoffreich ernährenden Völkern sehr selten auftreten, postulierte der Mediziner Dennis P. Burkitt Anfang der 1970er Jahre einen entsprechenden „Ballaststoff-Schutzeffekt“. Ballaststoffreiche Kostformen, so die These, sollen über verschiedene Mechanismen (siehe unten) das Risiko für Dickdarmtumoren senken [14]. Unterstützt wurde diese Vermutung durch länderübergreifende Korrelationsstudien. Hier zeigte sich, dass Angehörige von Bevölkerungsgruppen mit hoher Ballaststoffzufuhr deutlich seltener an kolorektalen Tumoren erkranken als solche mit niedriger Aufnahme [6]. Auch die Ergebnisse der bis in die 1990er Jahre durchgeführten Fall-Kontroll-Studien fügten sich stimmig in das Bild der Ballaststoff-Krebs-Hypothese ein. Je höher die Ballaststoffzufuhr, so der Befund, desto geringer das Erkrankungsrisiko [39].
Die nachfolgend durchgeführten und weit aussagekräftigeren prospektiven Kohortenstudien fielen indes weit weniger einheitlich aus. So ergab die 2004 im Rahmen des „Pooling-Projekts“ durchgeführte Auswertung von 13 Kohortenstudien mit über 725.000 Studienteilnehmern und 8000 Fällen an kolorektalen Karzinomen nur ein nicht-signifikant vermindertes Erkrankungsrisiko bei hoher Ballaststoffzufuhr, wenn Störgrößen wie Energie- und Folsäureaufnahme, Alkohol- und Fleischkonsum etc. statistisch berücksichtigt wurden (gepooltes RR 0,94; 95 % CI 0,86 – 1,03) [59]. Demgegenüber war das Risiko für maligne Tumoren des Dickdarms in der EPIC-Studie mit nahezu 520.000 Teilnehmern bei einer hohen Ballaststoffaufnahme (34 g/Tag) signifikant um 40 % niedriger als bei einer geringen Zufuhr (12 g/Tag) (RR 0,58; 95 % CI 0,58 (0,41 – 0,85) [9].
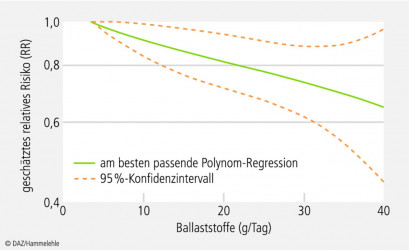
Die bislang umfassendste Auswertung wurde 2011 von einer Arbeitsgruppe um Teresa Norat im British Medical Journal veröffentlicht. In die Metaanalyse einbezogen wurden 25 prospektive Kohortenstudien, wobei die Ballaststoffzufuhr zwischen 6,3 und 21,4 g/Tag schwankte. Personen mit der höchsten Ballaststoffaufnahme hatten ein um 12 % vermindertes Risiko für kolorektale Krebserkrankungen, verglichen mit Personen mit der geringsten Zufuhr (RR 0,88; 95 % 0,82 – 0,94) [5]. Für eine Steigerung der Ballaststoffzufuhr um 10 g/Tag errechneten die Forscher eine Risikoreduktion um 10 % (RR 90; 95 % CI 0,86 – 0,94), so dass sich eine nahezu lineare Dosis-Wirkungs-Beziehung ergab (siehe Abb. 3).
Bei der differenzierten Analyse zeigte sich, dass nicht alle Ballaststoffe dasselbe protektive Potenzial besitzen. Als besonders schützend erwiesen sich Ballaststoffe aus Getreide und Leguminosen, während die Ballaststoffzufuhr über Obst nur sehr schwach mit dem Erkrankungsrisiko in Zusammenhang stand (siehe Tab. 4).
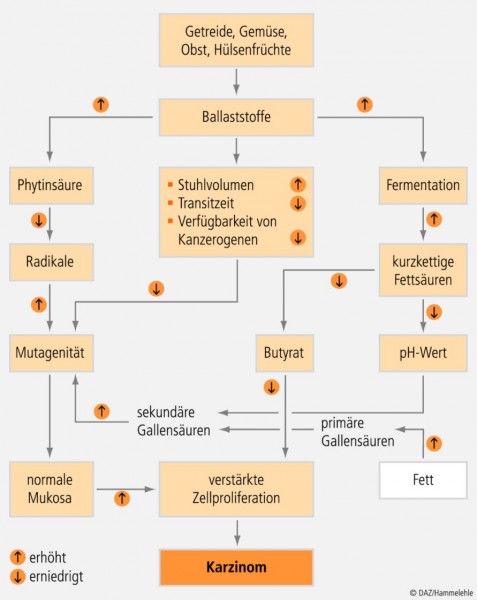
Wirkmechanismen: Der protektive Effekt der Ballaststoffe wird auf eine Reihe von Mechanismen zurückgeführt (siehe Abb. 4). Danach wirken Ballaststoffe chemopräventiv, indem sie [49; 68; 75; 95]
die Darmpassage verkürzen und damit die Kontaktzeit potenzieller Noxen mit der Dickdarmschleimhaut vermindern,
sekundäre Gallensäuren, die zum Teil zytotoxisch und karzinogen wirken, binden und ihre Ausscheidung forcieren,
zur Bildung kurzkettiger Fettsäuren wie Butyrat führen und so die normale Zellproliferation aufrechterhalten,
die Populationsdichte kolonständiger Bakterien erhöhen. Diese nutzen das im Darm anfallende Ammoniak, ein mutagenes Agens, für die bakterielle Proteinsynthese.
Zusammenfassende Evidenzbewertung: Basierend auf den aufgezeigten epidemiologischen und biochemisch-physiologischen Zusammenhängen, wird die Evidenz für einen risikosenkenden Effekt von Getreideballaststoffen auf das Risiko maligner Tumoren des Kolons und Rektums als wahrscheinlich gewertet. Für die Gesamtballaststoffe gilt ein protektiver Effekt als möglich [11].
Fazit für die Praxis
Weit davon entfernt, ein inerter, überflüssiger Nahrungsbestandteil zu sein, beeinflussen Ballaststoffe vielfältige physiologische Funktionen. Dadurch steht die Ballaststoffzufuhr in engem Zusammenhang mit der Entwicklung weitverbreiteter Krankheiten, darunter Adipositas, Typ-2-Diabetes, Herz-Kreislauf-Erkrankungen und kolorektale Tumoren. Tabelle 5 fasst die Bewertung der Evidenz zu den gesundheitlichen Auswirkungen der Ballaststoffaufnahme zusammen. Wie daraus hervorgeht, besitzen Ballaststoffe ein erhebliches protektives Potenzial, das es in der Praxis zu nutzen gilt. Ernährungsfachgesellschaften empfehlen zur Prävention eine Ballaststoffzufuhr von mindestens 30 g/Tag, entsprechend einer Aufnahme von 16 g/1000 kcal bei Frauen und 12,5 g/1000 kcal bei Männern [21].
In Deutschland bewegt sich die Ballaststoffzufuhr bei Frauen und Männer zwischen 16 und 29 g Ballaststoffe/Tag, wie regionale und überregionale Verzehrsstudien zeigen. Nach Erhebungen der Nationalen Verzehrsstudie II wurde für Frauen und Männer eine Ballaststoffaufnahme von durchschnittlich 10,4 bis 12,9 g/1000 kcal ermittelt, entsprechend 25 bis 27 g/Tag. Insgesamt liegt die Ballaststoffzufuhr bei 75 % der Frauen und 66 % der Männer unter dem D-A-CH-Richtwert von 30 g/Tag. Die Versorgungssituation ist also verbesserungswürdig [8].
Eine ballaststoffreiche Ernährung lässt sich in der Praxis leicht realisieren, indem Vollkornprodukte, Obst, Gemüse und Hülsenfrüchte vermehrt in den Speiseplan einbezogen werden:
Austausch von Auszugsmehlprodukten durch Vollkornvarianten.
Substitution eines Teils der Käse- und Wurstwaren durch Leguminosen.
Verzehr von Nüssen und Trockenfrüchten als Snacks im Austausch gegen Süßwaren, Chips etc.
Reichlich Gemüse in Form von Salaten.
Eine sehr hohe Zufuhr an Ballaststoffen kann – insbesondere wenn Konzentrate (Kleie etc.) aufgenommen werden, mit einer Reihe unerwünschter Folgen verbunden sein:
Gastrointestinale Symptome: Personen, die ihre Ballaststoffaufnahme rasch und deutlich steigern, berichten zu Beginn der Ernährungsumstellung gelegentlich über Flatulenzneigung und abdominelle Krämpfe [2]. Bei Zufuhr hoher Mengen von Ballaststoffkonzentraten und unzureichender Flüssigkeitszufuhr besteht zudem die Gefahr eines Ileus, insbesondere bei Personen mit Darmmotilitätsstörungen [1].
Mineralstoffverfügbarkeit: Mineralstoffe wie Calcium, Eisen und Zink können von Ballaststoffen gebunden und so der Absorption entzogen werden. Dieser Effekt, wie er insbesondere für Getreideballaststoffe nachgewiesen wurde, ist jedoch eher auf ihren hohen Phytatgehalt zurückzuführen; die Nahrungsfasern selbst sind hierbei von untergeordneter Bedeutung. Da eine ballaststoffreiche Ernährung gleichzeitig mit einer deutlich erhöhten Zufuhr an Mineralstoffen verbunden ist, werden mögliche Verluste für gewöhnlich mehr als ausgeglichen; ihnen kommt in der Praxis daher üblicherweise keine Bedeutung zu [31; 41].
Carotinoidverfügbarkeit: Pektin- und Guar-Isolate, aufgenommen mit einer carotinoidreichen Mahlzeit, vermindern die Absorption von β-Carotin, Lutein und Lycopin [64 – 65].
Pharmakainteraktionen: Zahlreiche Ballaststoffe vermindern oder verlangsamen die Absorption von Pharmaka, wenn sie mit diesen zur selben Zeit aufgenommen werden (Psyllium: Lithium, Carbamazepin, Digoxin, Warfarin; Guar: Digoxin, Acetaminophen, Metformin, Penicillin, Glyburide; Pectin: Lovastatin). Aus diesem Grund sollten Arzneimittel immer zeitlich versetzt von der letzten ballaststoffreichen Mahlzeit eingenommen werden [28; 35; 63].
Literatur
[1] Agha FP, Nostrant TT, Fiddian-Green RG. "Giant colonic bezoar:" a medication bezoar due to psyllium seed husks. Am J Gastroenterol. 1984;79:319-321.
[2] American Academy of Family Physicians. Fiber: How to Increase the Amount in Your Diet . Am Fam Physician. 2004;69:930.
[3] Anderson JW, Baird P, Davis RH Jr, Ferreri S, Knudtson M, Koraym A, Waters V, Williams CL. Health benefits of dietary fiber. Nutr Rev. 2009;67:188-205.
[4] Aune D, Chan DS, Greenwood DC, Vieira AR, Rosenblatt DA, Vieira R, Norat T. Dietary fiber and breast cancer risk: a systematic review and meta-analysis of prospective studies. Ann Oncol. 2012;23:1394-402.
[5] Aune D, Chan DS, Lau R, Vieira R, Greenwood DC, Kampman E, Norat T. Dietary fibre, whole grains, and risk of colorectal cancer: systematic review and dose-response meta-analysis of prospective studies. BMJ. 2011;343:d6617.
[6] Baron JA. Dietary fiber and colorectal cancer: an ongoing saga. JAMA. 2005;294:2904-6.
[7] Bazzano LA. Effects of soluble dietary fiber on low-density lipoprotein cholesterol and coronary heart disease risk. Curr Atheroscler Rep. 2008;10:473-7.
[8] Bechthold A, Brönstrup A. Kohlenhydratzufuhr in Deutschland. In: Deutsche Gesellschaft für Ernährung e. V. (DGE) (Hrsg.). Evidenzbasierte Leitlinie. Kohlenhydratzufuhr und Prävention ausgewählter ernährungsmitbedingter Krankheiten". Version 2011. Bonn 2011, S. 4-15. Online verfügbar unter http://www.dge.de/pdf/ws/ll-kh/DGE-Leitlinie-KH-ohne-Anhang_Tabellen.pdf
[9] Bingham SA, Day NE, Luben R, Ferrari P, Slimani N, Norat T, Clavel-Chapelon F, Kesse E, Nieters A, Boeing H, Tjønneland A, Overvad K, Martinez C, Dorronsoro M, Gonzalez CA, Key TJ, Trichopoulou A, Naska A, Vineis P, Tumino R, Krogh V, Bueno-de-Mesquita HB, Peeters PH, Berglund G, Hallmans G, Lund E, Skeie G, Kaaks R, Riboli E; European Prospective Investigation into Cancer and Nutrition. Dietary fibre in food and protection against colorectal cancer in the European Prospective Investigation into Cancer and Nutrition (EPIC): an observational study. Lancet. 2003;361(9368):1496-501.
[10] Boeing H. Kohlenhydratzufuhr und Prävention der Hypertonie. In: Deutsche Gesellschaft für Ernährung e. V. (DGE) (Hrsg.). Evidenzbasierte Leitlinie. Kohlenhydratzufuhr und Prävention ausgewählter ernährungsmitbedingter Krankheiten". Version 2011. Bonn 2011, S. 107-115. Online verfügbar unter http://www.dge.de/pdf/ws/ll-kh/DGE-Leitlinie-KH-ohne-Anhang_Tabellen.pdf
[11] Boeing H. Kohlenhydratzufuhr und Prävention von Krebskrankheiten. In: Deutsche Gesellschaft für Ernährung e. V. (DGE) (Hrsg.). Evidenzbasierte Leitlinie. Kohlenhydratzufuhr und Prävention ausgewählter ernährungsmitbedingter Krankheiten". Version 2011. Bonn 2011, S. 138-157. Online verfügbar unter http://www.dge.de/pdf/ws/ll-kh/DGE-Leitlinie-KH-ohne-Anhang_Tabellen.pdf
[12] Brönstrup A. Methodisches Vorgehen bei der Erstellung der DGE-Leitlinie "Kohlenhydratzufuhr und Prävention ausgewählter ernährungsmitbedingter Krankheiten". In: Deutsche Gesellschaft für Ernährung e. V. (DGE) (Hrsg.). Evidenzbasierte Leitlinie. Kohlenhydratzufuhr und Prävention ausgewählter ernährungsmitbedingter Krankheiten". Version 2011. Bonn 2011, S. 16-30. Online verfügbar unter http://www.dge.de/pdf/ws/ll-kh/DGE-Leitlinie-KH-ohne-Anhang_Tabellen.pdf
[13] Brown L, Rosner B, Willett WW, Sacks FM. Cholesterol-lowering effects of dietary fiber: a meta-analysis. Am J Clin Nutr. 1999;69:30-42.
[14] Burkitt DP. Epidemiology of cancer of the colon and rectum. Cancer. 1971;28:3-13.
[15] Buyken A, Schulze M. Kohlenhydratzufuhr und Prävention der Adipositas. In: Deutsche Gesellschaft für Ernährung e. V. (DGE) (Hrsg.). Evidenzbasierte Leitlinie. Kohlenhydratzufuhr und Prävention ausgewählter ernährungsmitbedingter Krankheiten". Version 2011. Bonn 2011, S. 31-Online verfügbar unter http://www.dge.de/pdf/ws/ll-kh/DGE-Leitlinie-KH-ohne-Anhang_Tabellen.pdf
[16] Ceriello A, Colagiuri S. International Diabetes Federation guideline for management of postmeal glucose: a review of recommendations. Diabetic medicine : a journal of the British Diabetic Association 2008;25:1151-6.
[17] Chuang SC, Vermeulen R, Sharabiani MT, Sacerdote C, Fatemeh SH, Berrino F, Krogh V, Palli D, Panico S, Tumino R, Athersuch TJ, Vineis P. The intake of grain fibers modulates cytokine levels in blood. Biomarkers. 2011;16:504-10.
[18] Darzi J, Frost GS, Robertson MD. Do SCFA have a role in appetite regulation? Proc Nutr Soc. 2011;70:119-28.
[19] De Bandt JP, Waligora-Dupriet AJ, Butel MJ. Intestinal microbiota in inflammation and insulin resistance: relevance to humans. Curr Opin Clin Nutr Metab Care. 2011;14:334-40.
[20] de Munter JS, Hu FB, Spiegelman D, Franz M, van Dam RM. Whole grain, bran, and germ intake and risk of type 2 diabetes: a prospective cohort study and systematic review. PLoS Med. 2007;4:e261.
[21] Deutsche Gesellschaft für Ernährung e. V. (DGE), Österreichische Gesellschaft für Ernährung (ÖGE), Schweizerische Gesellschaft für Ernährung (SGE), Schweizerische Vereinigung für Ernährung (SVE): Referenzwerte für die Nährstoffzufuhr. 1. Auflage, 3. vollständig durchgesehener und korrigierter Nachdruck. Neuer Umschau Buchverlag, Neustadt an der Weinstraße 2008
[22] Deutsche Gesellschaft für Ernährung e. V. (DGE) (Hrsg.). Evidenzbasierte Leitlinie. Kohlenhydratzufuhr und Prävention ausgewählter ernährungsmitbedingter Krankheiten". Version 2011. Bonn 2011, Online verfügbar unter http://www.dge.de/pdf/ws/ll-kh/DGE-Leitlinie-KH-ohne-Anhang_Tabellen.pdf
[23] Du H, van der A DL, Boshuizen HC, Forouhi NG, Wareham NJ, Halkjaer J, Tjønneland A, Overvad K, Jakobsen MU, Boeing H, Buijsse B, Masala G, Palli D, Sørensen TI, Saris WH, Feskens EJ. Dietary fiber and subsequent changes in body weight and waist circumference in European men and women. Am J Clin Nutr. 2010;91:329-36.
[24] Eiben G, Lissner L. Health Hunters--an intervention to prevent overweight and obesity in young high-risk women. Int J Obes (Lond). 2006;30:691-6.
[25] Eshak ES, Iso H, Date C, Kikuchi S, Watanabe Y, Wada Y, Wakai K, Tamakoshi A; JACC Study Group. Dietary fiber intake is associated with reduced risk of mortality from cardiovascular disease among Japanese men and women. J Nutr. 2010;140:1445-53
[26] Esteve E, Ricart W, Fernández-Real JM. Gut microbiota interactions with obesity, insulin resistance and type 2 diabetes: did gut microbiote co-evolve with insulin resistance? Curr Opin Clin Nutr Metab Care. 2011;14:483-90.
[27] Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010;127:2893-917.
[28] Fugh-Berman A. Herb-drug interactions. Lancet. 2000;355(9198):134-138.
[29] Genest J, Frohlich J, Fodor G, McPherson R; Working Group on Hypercholesterolemia and Other Dyslipidemias. Recommendations for the management of dyslipidemia and the prevention of cardiovascular disease: summary of the 2003 update. CMAJ. 2003;169(9):921-4.
[30] Gößwald A, Lange M, Kamtsiuris P, Kurth BM: DEGS: Studie zur Gesundheit Erwachsener in Deutschland. Bundesweite Quer- und Längsschnittstudie im Rahmen des Gesundheitsmonitorings des Robert Koch-Instituts. Bundesgesundheitsblatt - Gesundheitsforschung - Gesundheitsschutz. 2012;55:775-780
[31] Greger JL. Nondigestible carbohydrates and mineral bioavailability. J Nutr. 1999;129:1434S-1435S.
[32] Gross LS, Li L, Ford ES, Liu S. Increased consumption of refined carbohydrates and the epidemic of type 2 diabetes in the United States: an ecologic assessment. Am J Clin Nutr. 2004;79:774-9.
[33] Hahn A, Ströhle A, Wolters M. Ernährung - Physiologische Grundlagen, Prävention, Therapie., (3. Aufl.) Stuttgart: Wissenschaftliche Verlagsgesellschaft (in Vorbereitung)
[34] Hauner H: Zusammenfassung der Ergebnisse der Leitlinie zur Kohlenhydratzufuhr. In: Deutsche Gesellschaft für Ernährung (Hrsg.): Evidenzbasierte Leitlinie. Kohlenhydratzufuhr und Prävention ausgewählter ernährungsmitbedingter Krankheiten. Version 2011, S. 158-161. Im Internet verfügbar unter http://www.dge.de/pdf/ws/ll-kh/DGE-Leitlinie-KH-ohne-Anhang_Tabellen.pdf e.V Bonn
[35] Hendler SS, Rorvik DR (eds). PDR for Nutritional Supplements. 2nd ed. Montvale: Physicians' Desk Reference Inc.; 2008.
[36] Hill JO, Wyatt HR, Reed GW, Peters JC. Obesity and the environment: where do we go from here? Science. 2003;299:853-5.
[37] Howarth NC, Murphy SP, Wilkens LR, Hankin JH, Kolonel LN. Dietary energy density is associated with overweight status among 5 ethnic groups in the multiethnic cohort study. J Nutr 2006;136:2243-8.
[38] Howarth NC, Saltzman E, Roberts SB. Dietary fiber and weight regulation. Nutr Rev. 2001;59(5):129-139.
[39] Howe GR, Benito E, Castelleto R, Cornée J, Estève J, Gallagher RP, Iscovich JM, Deng-ao J, Kaaks R, Kune GA, et al. Dietary intake of fiber and decreased risk of cancers of the colon and rectum: evidence from the combined analysis of 13 case-control studies. J Natl Cancer Inst. 1992;84:1887-96.
[40] IARC. Handbooks of Cancer Prevention No 6: Weight control and physical activity. International Agency for Research on Cancer (IARC) 2002
[41] Institute of Medicine. Dietary, Functional, and Total Fiber. Dietary Reference Intakes for Energy, Carbohydrate, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids. Washington, D. C.: National Academies Press; 2002:265-334.
[42] International Obesity Task Force. Obesity the global epidemic. Online verfügbar unter http://www.iaso.org/iotf/obesity/obesitytheglobalepidemic/Trends in Adult Obesity Prevalence in Europe.
[43] Kim H, Bartley GE, Young SA, Davis PA, Yokoyama W. HPMC supplementation reduces abdominal fat content, intestinal permeability, inflammation, and insulin resistance in diet-induced obese mice. Mol Nutr Food Res. 2012; 11. doi: 10.1002/mnfr.201200082. [Epub ahead of print]
[44] Krishnamurthy VM, Wei G, Baird BC, Murtaugh M, Chonchol MB, Raphael KL, Greene T, Beddhu S. High dietary fiber intake is associated with decreased inflammation and all-cause mortality in patients with chronic kidney disease. Kidney Int. 2012;81:300-6.
[45] Kurth BM, Schaffrath Rosario A. [The prevalence of overweight and obese children and adolescents living in Germany. Results of the German Health Interview and Examination Survey for Children and Adolescents (KiGGS)]. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 2007;50:736-43.
[46] Larsen TM, Dalskov SM, van Baak M, Jebb SA, Papadaki A, Pfeiffer AF, Martinez JA, Handjieva-Darlenska T, Kunešová M, Pihlsgård M, Stender S, Holst C, Saris WH, Astrup A; Diet, Obesity, and Genes (Diogenes) Project. Diets with high or low protein content and glycemic index for weight-loss maintenance. N Engl J Med. 2010;363:2102-13.
[47] Lichtenstein AH, Appel LJ, Brands M, Carnethon M, Daniels S, Franch HA, Franklin B, Kris-Etherton P, Harris WS, Howard B, Karanja N, Lefevre M, Rudel L, Sacks F, Van Horn L, Winston M, Wylie-Rosett J. Summary of American Heart Association Diet and Lifestyle Recommendations revision 2006. Arterioscler Thromb Vasc Biol. 2006;26:2186-91.
[48] Linseisen J, Wolfram G. Kohlenhydratzufuhr und primäre Prävention der koronaren Herzkrankheit (KHK). In: Deutsche Gesellschaft für Ernährung e. V. (DGE) (Hrsg.). Evidenzbasierte Leitlinie. Kohlenhydratzufuhr und Prävention ausgewählter ernährungsmitbedingter Krankheiten". Version 2011. Bonn 2011, S. 125-137. Online verfügbar unter http://www.dge.de/pdf/ws/ll-kh/DGE-Leitlinie-KH-ohne-Anhang_Tabellen.pdf
[49] Lipkin M, Reddy B, Newmark H, Lamprecht SA. Dietary factors in human colorectal cancer. Annu Rev Nutr. 1999;19:545-86.
[50] Liu S, Willett WC, Manson JE, Hu FB, Rosner B, Colditz G. Relation between changes in intakes of dietary fiber and grain products and changes in weight and development of obesity among middle-aged women. Am J Clin Nutr. 2003;78:920-7.
[51] Mendoza JA, Drewnowski A, Cheadle A, Christakis DA. Dietary energy density is associated with selected predictors of obesity in U.S. Children. J Nutr. 2006;136:1318-22.
[52] Mendoza JA, Drewnowski A, Christakis DA. Dietary energy density is associated with obesity and the metabolic syndrome in U.S. adults. Diabetes Care. 2007;30:974-9.
[53] Mente A, de Koning L, Shannon HS, Anand SS. A systematic review of the evidence supporting a causal link between dietary factors and coronary heart disease. Arch Intern Med. 2009;169:659-69.
[54] Meyer KA, Kushi LH, Jacobs DR Jr, Slavin J, Sellers TA, Folsom AR. Carbohydrates, dietary fiber, and incident type 2 diabetes in older women. Am J Clin Nutr. 2000;71:921-30.
[55] Monnier L, Mas E, Ginet C, et al. Activation of oxidative stress by acute glucose fluctuations compared with sustained chronic hyperglycemia in patients with type 2 diabetes. JAMA 2006;295:1681-7.
[56] Montonen J, Knekt P, Järvinen R, Aromaa A, Reunanen A. Whole-grain and fiber intake and the incidence of type 2 diabetes. Am J Clin Nutr. 2003;77:622-9.
[57] Neyrinck AM, Delzenne NM. Potential interest of gut microbial changes induced by non-digestible carbohydrates of wheat in the management of obesity and related disorders. Curr Opin Clin Nutr Metab Care. 2010;13:722-8.
[58] Parikh S, Pollock NK, Bhagatwala J, Guo DH, Gutin B, Zhu H, Dong Y. Adolescent Fiber Consumption Is Associated with Visceral Fat and Inflammatory Markers. J Clin Endocrinol Metab. 2012 May 16. [Epub ahead of print] PubMed PMID: 22593589.
[59] Park Y, Hunter DJ, Spiegelman D, Bergkvist L, Berrino F, van den Brandt PA, Buring JE, Colditz GA, Freudenheim JL, Fuchs CS, Giovannucci E, Goldbohm RA, Graham S, Harnack L, Hartman AM, Jacobs DR Jr, Kato I, Krogh V, Leitzmann MF, McCullough ML, Miller AB, Pietinen P, Rohan TE, Schatzkin A, Willett WC, Wolk A, Zeleniuch-Jacquotte A, Zhang SM, Smith-Warner SA. Dietary fiber intake and risk of colorectal cancer: a pooled analysis of prospective cohort studies. JAMA. 2005;294:2849-57.
[60] Park Y, Subar AF, Hollenbeck A, Schatzkin A. Dietary fiber intake and mortality in the NIH-AARP diet and health study. Arch Intern Med. 2011;171:1061-8.
[61] Pereira MA, Ludwig DS. Dietary fiber and body-weight regulation. Observations and mechanisms. Pediatr Clin North Am. 2001;48:969-80.
[62] Pereira MA, O'Reilly E, Augustsson K, Fraser GE, Goldbourt U, Heitmann BL, Hallmans G, Knekt P, Liu S, Pietinen P, Spiegelman D, Stevens J, Virtamo J, Willett WC, Ascherio A. Dietary fiber and risk of coronary heart disease: a pooled analysis of cohort studies. Arch Intern Med. 2004;164:370-6
[63] Richter WO, Jacob BG, Schwandt P. Interaction between fibre and lovastatin. Lancet. 1991;338:706.
[64] Riedl J, Linseisen J, Hoffmann J, Wolfram G. Some dietary fibers reduce the absorption of carotenoids in women. J Nutr. 1999;129:2170-2176.
[65] Rock CL, Swendseid ME. Plasma beta-carotene response in humans after meals supplemented with dietary pectin. Am J Clin Nutr. 1992;55:96-99.
[66] Rolls BJ, Drewnowski A, Ledikwe JH. Changing the energy density of the diet as a strategy for weight management. J Am Diet Assoc 2005;105:S98-103.
[67] Salmerón J, Manson JE, Stampfer MJ, Colditz GA, Wing AL, Willett WC. Dietary fiber, glycemic load, and risk of non-insulin-dependent diabetes mellitus in women. JAMA. 1997;277:472-7.
[68] Scharlau D, Borowicki A, Habermann N, Hofmann T, Klenow S, Miene C, Munjal U, Stein K, Glei M. Mechanisms of primary cancer prevention by butyrate and other products formed during gut flora-mediated fermentation of dietary fibre. Mutat Res. 2009;682:39-53.
[69] Schulze M, und Hauner H. Kohlenhydratzufuhr und Prävention des Diabetes mellitus Typ 2. In: Deutsche Gesellschaft für Ernährung e. V. (DGE) (Hrsg.). Evidenzbasierte Leitlinie. Kohlenhydratzufuhr und Prävention ausgewählter ernährungsmitbedingter Krankheiten". Version 2011. Bonn 2011, S. 58-74. Online verfügbar unter http://www.dge.de/pdf/ws/ll-kh/DGE-Leitlinie-KH-ohne-Anhang_Tabellen.pdf
[70] Schulze MB, Schulz M, Heidemann C, Schienkiewitz A, Hoffmann K, Boeing H. Fiber and magnesium intake and incidence of type 2 diabetes: a prospective study and meta-analysis. Arch Intern Med. 2007;167:956-65.
[71] Sleeth ML, Thompson EL, Ford HE, Zac-Varghese SE, Frost G. Free fatty acid receptor 2 and nutrient sensing: a proposed role for fibre, fermentable carbohydrates and short-chain fatty acids in appetite regulation. Nutr Res Rev. 2010;23:135-45.
[72] Streppel MT, Arends LR, van 't Veer P, Grobbee DE, Geleijnse JM. Dietary fiber and blood pressure: a meta-analysis of randomized placebo-controlled trials. Arch Intern Med. 2005;165:150-156.
[73] Streppel MT, Ocké MC, Boshuizen HC, Kok FJ, Kromhout D. Dietary fiber intake in relation to coronary heart disease and all-cause mortality over 40 y: the Zutphen Study. Am J Clin Nutr. 2008;88:1119-25
[74] Ströhle A, Hahn A: Diätetische Maßnahmen bei Atherosklerose - Stellenwert von L-Arginin, Teil 1: Pathophysiologische Grundlage und diätetische Ansatzpunkte. Dtsch. Apoth. Ztg. 152, 2517-2522 (2012).
[75] Ströhle A, Wolters M, Hahn A: Ernährung und Tumorerkrankungen des Kolons und Rektums: Was ist wissenschaftlich gesichert?, Med Monats Pharm. 2007;30: 25-32.
[76] Ströhle A, Wolters M, Hahn A (2006): Ernährungsfaktoren, Gen-Nährstoff-Interaktion und kolorektales Karzinom – eine Übersicht des aktuellen Kenntnisstandes., Dtsch Z Onkol. 2006;38:156-164.
[77] Ströhle A, Wolters M, Hahn A. Gesundheitliche Effekte von Ballaststoffen Ein Update. Teil 1: Von der Struktur zur Funktion. Dtsch. Apoth. Ztg. 152, 3780-3788 (2012).
[78] Ströhle A, Worm N. Metabolisches Syndrom: Pathophysiologische Grundlagen und rationale Empfehlungen zur Ernährungstherapie. Dtsch. Apoth. Ztg. 152, 48-65 (2012).
[79] Ströhle A. Rück- und Seitenblicke im Zeitalter der Ernährungsver(w)irrung – Eine Hommage an Werner Kollath., Reglin Verlag, Köln 2009
[80] Swinburn BA, Caterson I, eidell JC, James WP. Diet, nutrition and the prevention of excess weight gain and obesity. Public Health Nutr. 2004;7:123-46.
[81] Talati R, Baker WL, Pabilonia MS, White CM, Coleman CI. The effects of barley-derived soluble fiber on serum lipids. Ann Fam Med. 2009;7:157-63.
[82] Theuwissen E, Mensink RP. Water-soluble dietary fibers and cardiovascular disease. Physiol Behav. 2008;94:285-92.
[83] Todd S, Woodward M, Tunstall-Pedoe H, Bolton-Smith C. Dietary antioxidant vitamins and fiber in the etiology of cardiovascular disease and all-causes mortality: results from the Scottish Heart Health Study. Am J Epidemiol. 1999;150:1073-80
[84] Trepel F. [Dietary fibre: more than a matter of dietetics. II. Preventative and therapeutic uses]. Wien Klin Wochenschr. 2004;116:511-22.
[85] Trowell HC. Dietary-fiber hypothesis of the etiology of diabetes mellitus. Diabetes. 1975;24:762-5.
[86] Van Horn L, McCoin M, Kris-Etherton PM, Burke F, Carson JA, Champagne CM, Karmally W, Sikand G. The evidence for dietary prevention and treatment of cardiovascular disease. J Am Diet Assoc. 2008;108:287-331.
[87] Villaseñor A, Ambs A, Ballard-Barbash R, Baumgartner KB, McTiernan A, Ulrich CM, Neuhouser ML. Dietary fiber is associated with circulating concentrations of C-reactive protein in breast cancer survivors: the HEAL study. Breast Cancer Res Treat. 2011;129:485-94.
[88] Vrieze A, Holleman F, Zoetendal EG, de Vos WM, Hoekstra JB, Nieuwdorp M. The environment within: how gut microbiota may influence metabolism and body composition. Diabetologia. 2010;53:606-13.
[89] Wanders AJ, van den Borne JJ, de Graaf C, et al. Effects of dietary fibre on subjective appetite, energy intake and body weight: a systematic review of randomized controlled trials. Obes Rev. 2011;12:724-739.
[90] Wannamethee SG, Whincup PH, Thomas MC, Sattar N. Associations between dietary fiber and inflammation, hepatic function, and risk of type 2 diabetes in older men: potential mechanisms for the benefits of fiber on diabetes risk. Diabetes Care. 2009;32:1823-5.
[91] Watzl B, Leitzmann C. Bioaktive Substanzen in Lebensmitteln. 3. Auflage, Hippokrates, Stuttgart 2005
[92] Weickert MO, Pfeiffer AF. Metabolic effects of dietary fiber consumption and prevention of diabetes. J Nutr. 2008;138:439-42.
[93] Whelton SP, Hyre AD, Pedersen B, Yi Y, Whelton PK, He J. Effect of dietary fiber intake on blood pressure: a meta-analysis of randomized, controlled clinical trials. J Hypertens. 2005;23:475-481.
[94] Wolfram G, Linseisen J. Kohlenhydratzufuhr und Prävention der Dyslipoproteinämie. In: Deutsche Gesellschaft für Ernährung e. V. (DGE) (Hrsg.). Evidenzbasierte Leitlinie. Kohlenhydratzufuhr und Prävention ausgewählter ernährungsmitbedingter Krankheiten". Version 2011. Bonn 2011, S. 75-106. Online verfügbar unter http://www.dge.de/pdf/ws/ll-kh/DGE-Leitlinie-KH-ohne-Anhang_Tabellen.pdf
[95] Young GP, Hu Y, Le Leu RK, Nyskohus L. Dietary fibre and colorectal cancer: a model for environment--gene interactions. Mol Nutr Food Res. 2005;49:571-84.
Für die Autoren:
Dr. Alexander Ströhle, Leibniz Universität Hannover, Institut für Lebensmittelwissenschaft und Humanernährung, Am Kleinen Felde 30, 30167 Hannover, E-Mail: stroehle@nutrition.uni-hannover.de




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.