
- DAZ.online
- DAZ / AZ
- DAZ 31/2012
- Gesundheitliche Effekte ...
Ballaststoffe
Gesundheitliche Effekte von Ballaststoffen

Anfang des 18. Jahrhunderts schrieb der Nestor der modernen Ernährungsphysiologie, der Mediziner und Hygieniker Max Rubner (1854 – 1932): Das „alte Verfahren, Korn in einer einzigen Prozedur mitsamt der Kleie zu vermahlen, sollte ganz aufgehoben werden“ [57]. Diese Auffassung war nur konsequent, galten die ballaststoffreichen Randschichten des Getreidekorns doch als überflüssiger, weil unverdaulicher Ballast [58]. Es waren schließlich die Arbeiten der englischen Tropenmediziner Denis P. Burkitt (1911 – 1993) und Hugh C. Trowell (1904 – 1989), die die Ballaststoffe in einem neuen Licht erscheinen ließen. Basierend auf ihren Untersuchungen an afrikanischen Ureinwohnern stellten die Forscher in den 1970er Jahren die „dietary fibre hypothesis“ auf. Nach dieser sind typische „Zivilisationserkrankungen“, darunter Dickdarmerkrankungen (Obstipation, Kolondivertikel und Kolonkarzinom) und koronare Herzkrankheit die Folge einer unzureichenden Zufuhr an Ballaststoffen [10 – 16; 71 – 73]. In der Folgezeit erfuhr die „Ballaststoffhypothese“ großes Interesse. Zahlreiche Studien wurden initiiert, um der Frage nachzugehen: Sind Ballaststoffe wirklich von gesundheitlichem Nutzen; und, wenn ja, welchen Mechanismen liegt dieser zugrunde?
Charakterisierung – was sind Ballaststoffe?
Für Ballaststoffe existiert keine einheitliche, international verbindliche Begriffsdefinition [23]. Allgemein werden Ballaststoffe primär physiologisch – und nicht chemisch – definiert:
Definition in den D-A-CH-Referenzwerten: „Unter dem Sammelbegriff Ballaststoffe (Nahrungsfasern) werden Bestandteile pflanzlicher Nahrung zusammengefasst, die von den körpereigenen Enzymen des menschlichen Magen-Darm-Traktes nicht abgebaut werden“ [22].
Begriffsbestimmung der Lebensmittelchemischen Gesellschaft innerhalb der Gesellschaft Deutscher Chemiker (GDCh): „Ballaststoffe werden definiert als Bestandteile der Pflanzenzellen und/oder isolierte natürliche oder durch technologische Verfahren gewonnene Kohlenhydrate, die durch das menschliche Enzymsystem im Dünndarm nicht zu resorbierbaren Komponenten abgebaut werden. Sie können aber teilweise oder vollständig von der Dickdarmflora fermentiert werden“ [52].
Definition des US-amerikanischen Institute of Medicine: Als Nahrungsfasern (dietary fiber) werden „unverdauliche, in Pflanzen inhärent und unversehrt vorliegende Kohlenhydrate und Lignin“ verstanden. Davon abzugrenzen sind funktionelle Faserstoffe (functional fiber). Sie werden definiert als „isolierte, nicht verdauliche Kohlenhydrate, die im menschlichen Organismus physiologisch vorteilhaft wirken“. Gesamtfaserstoffe (total fiber) bilden „die Summe aus Nahrungsfasern und funktionellen Fasern“ [33; 39].
Gemeinsames Charakteristikum von Ballaststoffen ist somit ihre Nicht-Verdaulichkeit – unabhängig von ihrer chemischen Struktur [1; 24; 42].
Ballaststoffe – eine Nährstoffklasse mit vielen Strukturkomponenten
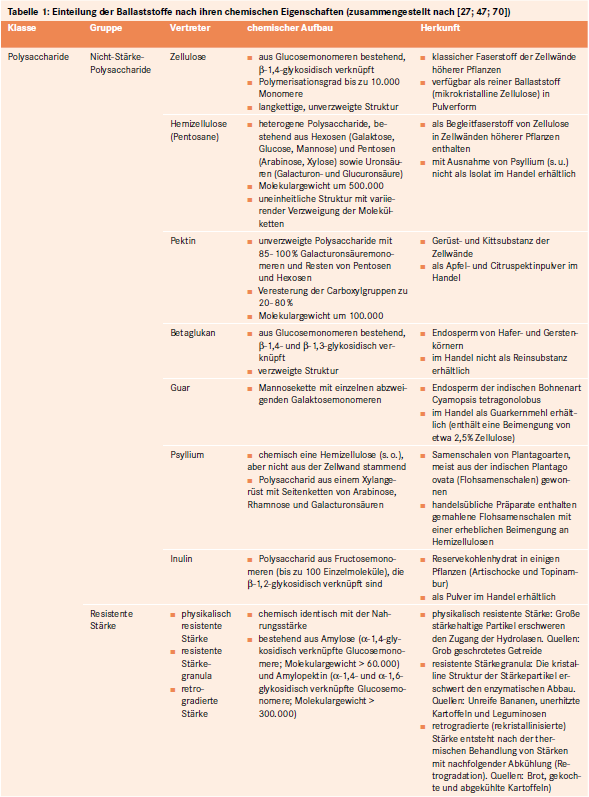
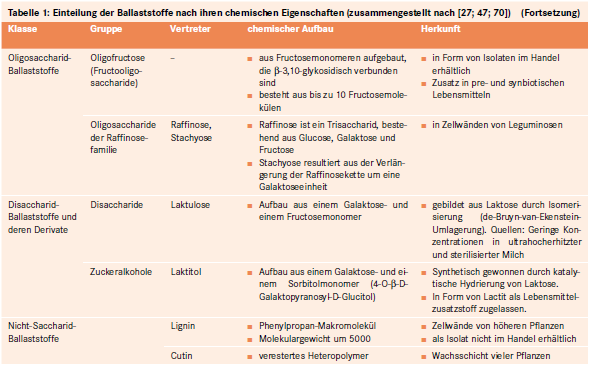
Bei Ballaststoffen handelt es sich um eine sehr heterogene Gruppe von Nahrungsbestandteilen. Sie lassen sich in Abhängigkeit von ihren chemischen, physikochemischen und physiologischen Eigenschaften klassifizieren [27; 47; 51; 70]:
Einteilung nach dem Aufbau
Unter chemischen Gesichtspunkten zählen Ballaststoffe zu zwei großen Stoffklassen:
Saccharide (Weitere Unterteilung in Abhängigkeit des Polymerisationsgrades: Poly-, Oligo-, Disaccharide).
Nicht-Saccharide (Weitere Unterteilung in Abhängigkeit der Strukturcharakteristika der Monomere; siehe Tab. 1).
Quantitativ am bedeutsamsten ist die Unterklasse der komplexen Polysaccharide. Diese umfasst:
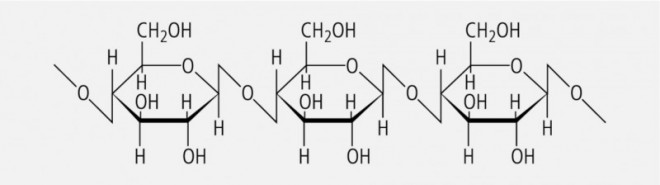
Nicht-Stärke-Polysaccharide wie Zellulose und Hemizellulose (siehe Abb. 1).
Resistente Stärken, worunter jener Anteil der Nahrungsstärke verstanden wird, welcher der enzymatischen Hydrolyse im Dünndarm entgeht und unverändert in den Dickdarm gelangt.
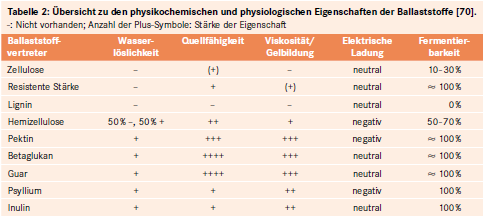
Tabelle 1 gibt eine Übersicht zur chemischen Einordnung der Ballaststoffe in die verschiedenen Stoffklassen und deren Charakteristika.
Einteilung nach dem Löslichkeitsverhalten
Ballaststoffe zeigen in wässriger Lösung typische Eigenschaften, die zur Einteilung dienen können:
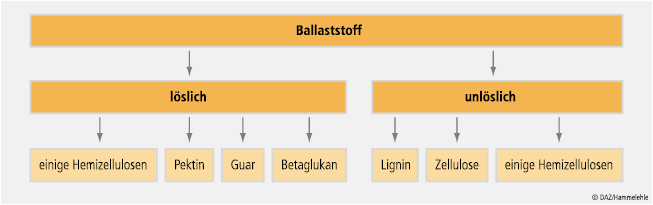
Löslichkeit. Seit Langem üblich ist die Unterscheidung zwischen wasserlöslichen und -unlöslichen Ballaststoffen (siehe Abb. 2). Während lösliche Ballaststoffe große Mengen an Wasser aufnehmen können (bis ca. 60 ml/g), ist diese Fähigkeit bei unlöslichen Ballaststoffen mit ca. 3 ml/g sehr gering. Mit Ausnahme von Zellulose, Lignin, resistenter Stärke und einigen Hemizellulosen sind alle übrigen, nicht-synthetischen Ballaststoffe wasserlöslich (siehe Tab. 2).
Wasserbindungsvermögen. Das Wasserbindungsvermögen beruht auf der Fähigkeit mancher Ballaststoffe, Wasser zu adsorbieren oder innerhalb der Matrix einzuschließen und festzuhalten. Es steht in einem direkten Zusammenhang zu der Quellfähigkeit eines Stoffs und der daraus resultierenden Viskositätserhöhung. Die meisten Ballaststoffe (Ausnahme: Lignin) haben das Potenzial, Wasser zu binden – wenn auch in unterschiedlichem Maße. Während Zellulose nur geringe Mengen Wasser anlagert (~ 0,4 ml/g), ist das Wasserbindungsvermögen von Hemizellulose deutlich ausgeprägter (~ 4 – 25 ml/g) [67]. Besonders stark ist die Wasserbindungskapazität von Pektin und anderen wasserlöslichen Ballaststoffen wie Guar und Psyllium. Sie bilden in Wasser visköse Lösungen und werden aufgrund ihrer gelbildenden Eigenschaften unter der Sammelbezeichnung Hydrokolloide zusammengefasst (siehe Tab. 2).
Einteilung nach der elektrischen Ladung
Ballaststoffe unterscheiden sich in ihrer elektrischen Ladung, so dass zwischen neutralen und negativ geladenen Substanzen unterschieden wird (siehe Tab. 2). Das Ladungsverhalten steht in direkter Beziehung zum Ionenaustauschvermögen der Ballaststoffe, d. h. zur Fähigkeit, Kationen zu binden. Verantwortlich hierfür sind meist freie Carboxylgruppen der Galakturonsäure (Beispiel: Pektin).
Einteilung nach der Fermentierbarkeit
Eine unter physiologischen Gesichtspunkten bedeutsame Unterteilung ist die zwischen bakteriell fermentierbaren und nicht-fermentierbaren Ballaststoffen. Erstere werden von der Mikroflora des Dickdarms enzymatisch abgebaut. Als Reaktionsprodukte entstehen neben Gasen (Kohlendioxid, Methan, Wasserstoff) die kurzkettigen Fettsäuren Essigsäure, Propionsäure und Buttersäure bzw. ihre entsprechenden Salze (Azetat, Propionat, Butyrat). Sowohl die Fermentationsrate als auch das Verhältnis der gebildeten Fettsäuren variieren je nach Ballaststoffkomponente, Passagezeit und Zusammensetzung der intestinalen Mikroflora [5; 69; 70]:
Fermentationsrate:Wasserlösliche Ballaststoffe und resistente Stärken unterliegen einem nahezu vollständigen Abbau, während Hemizellulosen zu 50 bis 70 %, Zellulose bis zu 30 % und Lignin sowie Cutin überhaupt nicht fermentiert werden (siehe Tab. 2). Die Abbaurate weist lokale Unterschiede auf und nimmt vom Zaekum zum Rektum kontinuierlich ab.
Fettsäurensynthese: Im Durchschnitt entstehen pro Gramm fermentierbaren Ballaststoffs 0,5 bis 0,6 g kurzkettige Fettsäuren, wobei das molare Verhältnis von Azetat, Propionat und Butyrat etwa 60: 20: 15 beträgt. Durch die Bildung von kurzkettigen Fettsäuren liefern die Ballaststoffe Energie (~ 2 kcal/g Ballaststoffe). Davon sollen bis zu 70 % vom Menschen genutzt werden können.
Quellen – wo Ballaststoffe zu finden sind
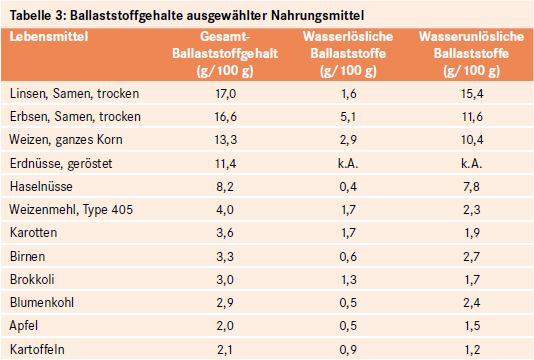
Ballaststoffe finden sich in Lebensmitteln pflanzlicher Herkunft, wobei die Gehalte je nach Quelle deutlich variieren (siehe Tab. 3):
Hohe Gehalte (>15 g/100 g) sind in Hülsenfrüchten enthalten.
Mittlere Gehalte (6 – 15 g/100 g) weisen Vollkornprodukte, Trockenfrüchte und Nüsse auf.
Geringe Gehalte (< 6 g/100 g) finden sich in stärkearmen Gemüse (z. B. Brokkoli), Nüssen sowie in Obst.
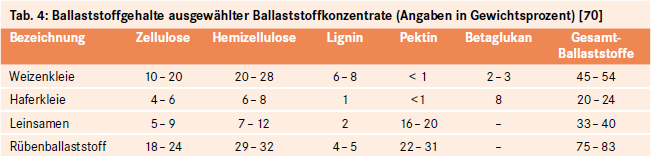
Neben den genannten, üblicherweise verzehrten Lebensmitteln, weisen Leinsamen und spezielle Konzentrate sehr hohe Mengen an Ballaststoffen auf (siehe Tab. 4). Sie finden vorzugsweise bei der diätetischen Therapie von Erkrankungen Verwendung und sind auch für die Apothekenpraxis von Relevanz.
Anzumerken ist, dass die Angaben zum Ballaststoffgehalt von Lebensmitteln methodisch bedingt variieren können. Das heute international gebräuchliche Verfahren ist enzymatischer Art (AOAC-Analysenmethode; Association of Official Analytical Chemistry). Es ermöglicht, neben dem Gesamtballaststoffgehalt die Menge an löslichen und unlöslichen Ballaststoffen zu erfassen. Ein Nachteil der Methode ist, dass der Gehalt an resistenter Stärke unberücksichtigt bleibt [52].
Neben dem Gesamtballaststoffgehalt eines Lebensmittels ist die Relation der einzelnen Ballaststoffgruppen zueinander von ernährungsphysiologischer Bedeutung. Während in Vollkornprodukten und Hülsenfrüchten wasserunlösliche Ballaststoffe (Zellulose und manche Hemizellulosen) dominieren, sind in Gemüse und Obst höhere Mengen an wasserlöslichem Pektin zu finden (siehe Tab. 3 und Tab. 4). Generell sind Zellulose und Hemizellulosen die in den meisten Lebensmitteln vorherrschenden Ballaststoffe [48].
Von der chemischen Struktur zur physiologischen Funktion
Das Funktionsprinzip der Ballaststoffe unterscheidet sich grundlegend von dem der anderen Nahrungsbestandteile. Während Makro- und Mikronährstoffe ihre biochemisch-physiologischen Effekte nach der Absorption entfalten, trifft dies für Ballaststoffe nicht zu. Ihre direkten Wirkungen sind vielmehr auf den Gastrointestinaltrakt beschränkt und primär physikalischer Art. Über ihre Abbauprodukte beeinflussen sie jedoch sekundär den gesamten Organismus. Damit üben Ballaststoffe sowohl lokale als auch systemische Effekte aus [29; 31; 43; 47; 77]:
Effekte in der Mundhöhle
Der Verzehr ballaststoffhaltiger Nahrungsmittel erfordert aufgrund der Faserstruktur (besonders bei Zellulose und Lignin) einen erhöhten Kauaufwand. Das ist in zweifacher Hinsicht von Relevanz [2; 76]:
Speichelsekretion: Durch das längere und intensivere Kauen wird die Speichelsekretion angeregt. Die Zähne werden besser umspült und von Nahrungsresten gereinigt. Gleichzeitig besitzt der Speichel aufgrund seines Bicarbonatgehalts eine Pufferfunktion. Die bakteriell gebildeten Säuren der Mundhöhle können so neutralisiert werden. Der vermehrte Speichelfluss sowie die Alkalität des Speichels tragen damit zur Erhaltung der Zahngesundheit bei.
Nahrungsaufnahme: Der höhere Kauaufwand bewirkt eine verlangsamte und verminderte Nahrungsaufnahme. Hieraus resultiert eine insgesamt niedrigere Energieaufnahme, die langfristig der Entstehung von Übergewicht entgegenwirkt; dazu trägt auch die Tatsache bei, dass eine ballaststoffreiche, pflanzlich orientierte Kostform im Allgemeinen eine geringere Energiedichte aufweist.
Effekte im Magen
Das Wasserbindungs- und Quellvermögen von Ballaststoffen (u. a. manche Hemizellulosen und Pektin) führt im Magen zu einer Volumen- und Viskositätserhöhung des Nahrungsbreis. Die Folge ist eine verzögerte Magenentleerung und eine durch Dehnungsrezeptoren vermittelte Aktivierung anorektischer Signalmoleküle im Hypothalamus. Insgesamt resultiert hieraus meist ein verbessertes und länger anhaltendes Sättigungsgefühl [7; 38; 44; 54; 63].
Effekte im Dünndarm
Im Dünndarm besitzen Ballaststoffe mehrere Wirkungen [2; 47; 51; 64; 70]:
Veränderung der Transitzeit: Die durch Ballaststoffe bedingte Zunahme des Speisebreivolumens verlangsamt den Durchgang des Nahrungsbreis. Dieser Effekt wurde allerdings nur für lösliche Ballaststoffe wie Pektin beschrieben, die unlösliche Zellulose (in Form von Weizenkleie) verkürzt die Transitzeit [56; 75].
-
Verzögerung und Verminderung von Digestion und Absorption: Ballaststoffe vermindern die enzymatische Aufspaltung und Aufnahme von Fetten, Proteinen und Polysacchariden im oberen Dünndarm. Zum Tragen kommen drei Mechanismen:
(1) Hydrokolloidale Ballaststoffe wie Pektin bilden eine gelartige Nahrungsmatrix aus, wodurch den Verdauungsenzymen (u. a. Amylase, Lipase und Trypsin) der Zugang zu den Makronährstoffen erschwert wird. Folge: verminderte enzymatische Hydrolyse.
(2) Manche Ballaststoffe (Pektin, Guar, Zellulose) scheinen die vom Pankreas sezernierten Verdauungsenzyme (Amylase, Lipase, Trypsin) zu hemmen, wenngleich die Studienergebnisse nicht einheitlich sind [25 – 26; 36; 40].
(3) Bedingt durch das größere Volumen des Nahrungsbreis ist die Diffusion der Nährstoffe zur Bürstensaummembran herabgesetzt, ihre Absorption dadurch verlangsamt.Besonders ausgeprägt sind die in (1) bis (3) beschriebenen Effekte bei Kohlenhydraten. So konnte wiederholt gezeigt werden, dass ein Zusatz von Guarmehl, Psyllium oder Pektin zur Nahrung den postprandialen Blutzuckeranstieg dosisabhängig um durchschnittlich 35% senkt (Lit. bei [70; 79]). Auch die Insulinausschüttung wird durch Ballaststoffe reduziert. Der Ballaststoffgehalt von Lebensmitteln ist somit eine wichtige, von anderen Faktoren unabhängige Determinante des glykämischen Index (siehe Kasten "Glykämischer Index").
Ausschüttung von Sättigungshormonen: Ballaststoffe modulieren die Sekretion gastrointestinaler Hormone (u. a. Cholecystokinin, gastroinhibitorisches Polypeptid (GIP)). Im Tierexperiment steigern fermentierbare Ballaststoffe wie Guar die Freisetzung von GLP-1 (glucagon-like-peptide), das im Hypothalamus als Sättigungssignal fungiert. Inwieweit ähnliche Effekte beim Menschen auftreten und welche Relevanz diese für die Sättigung besitzen, ist Gegenstand der Diskussion [31; 77].
Adsorption von Kationen: Über ihre negativ geladenen freien Carboxylgruppen sind Hemizellulosen und Pektine in der Lage, kationische Substanzen anzulagern und damit der Absorption zu entziehen. Soweit es sich um toxische Schwermetallionen (Blei, Cadmium etc.) handelt, ist dieser Effekt durchaus erwünscht. Andererseits können so auch Mineralstoffe wie Calcium, Eisen und Zink der Absorption entzogen und ihre Verfügbarkeit herabgesetzt werden. Allerdings zeigen Humanstudien, dass fermentierbare Ballaststoffe die Bioverfügbarkeit von Mineralstoffen eher verbessern [34]. Insbesondere für Inulin und Fructooligosaccharide wurde eine Verbesserung der Calciumverfügbarkeit beschrieben [21; 60]. Negative Effekte auf die Mineralstoffbilanz, wie sie nach Gabe von Getreideballaststoffen zu beobachten waren, sind vermutlich eher auf Begleitstoffe (u. a. Phytat) als auf die Ballaststofffraktion selbst zurückzuführen [34].
Adsorption von Gallensäuren: Neben Kationen können auch Gallensäuren oder Gallensäurederivate von Ballaststoffen adsorbiert und zur Ausscheidung gebracht werden. Dabei zeigen Pektin, Psyllium, Guar und Lignin die höchste Wirksamkeit [35].
-
Die Adsorptionsfähigkeit von Ballaststoffen ist in doppelter Hinsicht von Bedeutung:
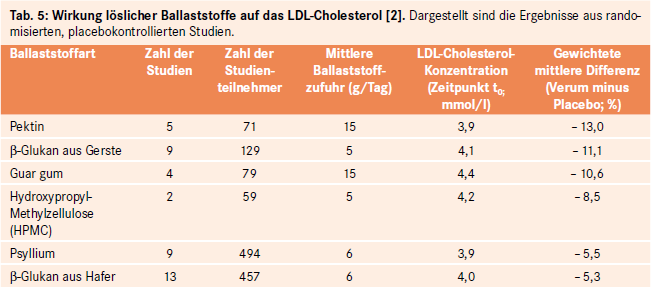
(1) Abnahme des Cholesterol-Pools. Die mit der Galle ins Dünndarmlumen sezernierten Gallensäuren werden gewöhnlich nahezu vollständig über ein im Ileum lokalisiertes, natriumabhängiges Transportsystem (ASBT; Apical Sodium-dependent Bile Salt Transporter) in das Pfortaderblut rückresorbiert. Von dort gelangen sie zur Leber und stehen für die erneute Abgabe mit der Galle zur Verfügung (enterohepatischer Kreislauf). Im Gegensatz hierzu werden ballaststoffgebundene Gallensäuren nicht rückresorbiert und stattdessen mit dem Stuhl ausgeschieden. Der hierdurch bedingte Verlust wird durch Neusynthese von Gallensäuren kompensiert. Das dafür erforderliche Cholesterol wird dem Cholesterol-Pool der Leber entzogen. Dadurch erfolgt eine Hochregulation der hepatischen LDL-Rezeptoren, so dass LDL-Cholesterol vermehrt aus dem Blut in die Leber gelangt. Auf diese Weise sinkt das Gesamt- und LDL-Cholesterol im Blut [35]. Im Gegensatz zu Zellulose und resistenter Stärke zeigen alle wasserlöslichen Ballaststoffe diese hypocholesterolämische Wirkung. Allgemein gilt: Pro 10 Gramm lösliche Ballaststoffe sinkt das Gesamtcholesterol um ca. 17 mg/dl und der LDL-Wert um 22 mg/dl [9]. Besonders ausgeprägt ist der cholesterolsenkende Effekt von Pektin und β-Glukanen aus Gerste (siehe Tab. 5).
(2) Hemmung der Lipidverdauung. Zur Viskositätsbildung neigende Ballaststoffe stören die für die Digestion und Absorption der Nahrungslipide erforderlichen Prozesse. Sie behindern die Gallensäure-Lipase-Lipid-Interaktion, hemmen die Mizellenbildung und blockieren den intraluminalen Transport sowie die via Diffusion erfolgte Aufnahme der Lipidfraktionen in das Mucosaepithel. Davon betroffen ist insbesondere das Nahrungscholesterol, das so vermehrt zur Ausscheidung kommt [20].
Glykämischer IndexParameter zur Erfassung der Blutzuckerwirksamkeit der Nahrung [30; 50]Konzept des Glykämischen Index (GI): Um die glykämische Wirkung der Kohlenhydratquellen quantitativ erfassen und vergleichen zu können, wurde das Konzept des glykämischen Index (GI) eingeführt. Der GI gibt an, in welchem Maß ein Lebensmittel mit einem Kohlenhydratgehalt von 50 g den Blutzuckerwert im Vergleich zu 50 g Glucose oder Weißbrot ansteigen lässt. Zur Ermittlung des GI werden die nach dem Verzehr des Test- und Referenzlebensmittels bestimmten Flächen unter den Blutzuckerkurven (AUC; area under the curve nach einem definierten Zeitintervall) zueinander in Beziehung gesetzt: GI = AUC (Testlebensmittel)/AUC (Referenzlebensmittel) Entsprechend ist die postprandiale Blutzuckerwirksamkeit von Lebensmitteln, die einen hohen GI aufweisen, pro Gramm Kohlenhydrate ausgeprägter als bei solchen mit einem niedrigen GI. Als niedrig gilt ein GI von < 55, als moderat einer von 55 – 69 und als hoch ein Wert von > 70. Einflussfaktoren des GI. Der GI eines Lebensmittels wird von einer Reihe von Faktoren bestimmt. Dazu zählen der Ballaststoffgehalt, der Verarbeitungsgrad sowie der Protein- und Fettgehalt des Lebensmittels und die Konzentration an Enzyminhibitoren (vor allem -Amylase-Inhibitoren). GI- Werte von Lebensmitteln: Für die Praxis gilt die einfache Regel: Der GI einer Kostform wird umso höher liegen, je höher der Anteil an ballaststoffarmen, stark verarbeiteten Produkten ist. Dagegen erlaubt der Polymerisationsgrad der Nahrungssaccharide („komplexe“ versus „einfache“ Kohlenhydrate) keine Rückschlüsse auf ihr Blutzuckerverhalten. |
Effekte im Kolon und Rektum
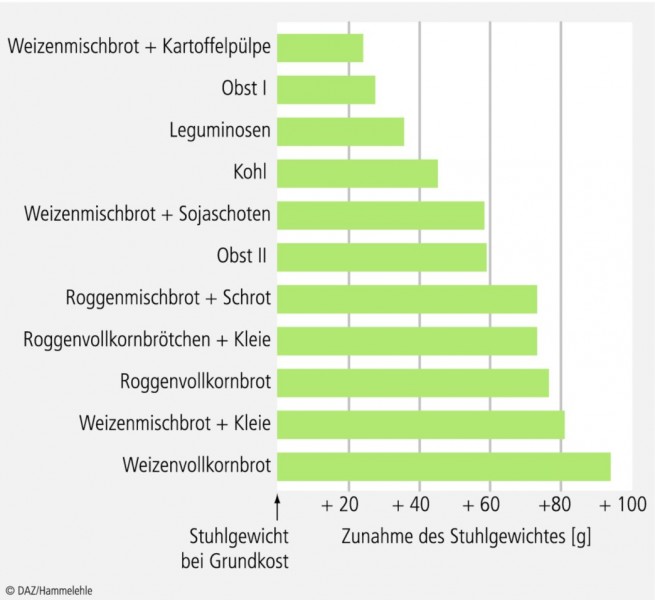
Stuhlbildung: Im Kolon erhöhen Ballaststoffe das Stuhlvolumen (wasserunlösliche Ballaststoffe über direkte Volumenzunahme; wasserlösliche durch Vermehrung der mikrobiellen Zellmasse) und modifizieren die Stuhlbeschaffenheit [18; 65]. Während bei Zufuhr hoher Mengen an Zellulose und Lignin ein fester, wasserarmer Stuhl zu beobachten ist, führt die Gabe von Inulin und Oligofructose zu einer weichen, wasserreichen Stuhlkonsistenz (Lit. bei [70]). Wie Abbildung 3 veranschaulicht, ist der Effekt von Getreideballaststoffen auf das Stuhlgewicht am stärksten: Die Zufuhr von 1 g Weizenballaststoffe erhöht das Stuhlgewicht im Mittel um 2,7 g [41]
Transitzeit: Die mit der Ballaststoffaufnahme einhergehende Volumenzunahme erhöht die Darmperistaltik. Dadurch sinkt die Transitzeit, was zu einem früheren und leichteren Absetzen des Stuhls führt. Allgemein gilt: Je höher das Stuhlgewicht, desto kürzer die Transitzeit. Entsprechend beschleunigen Getreideballaststoffe, insbesondere Weizen- und Haferkleie, die intestinale Transitzeit weit stärker als andere Ballaststoffe [46; 65; 80].
-
Mikroflora: Wie oben ausgeführt, werden lösliche Ballaststoffe von der Mikroflora des Dickdarms anaerob abgebaut und als Energiesubstrate genutzt. Ein höheres Angebot an fermentierten Ballaststoffen bewirkt zweierlei:
(1) Selektive Zunahme anaerober, physiologischer Keime in Abhängigkeit von der Ballaststoffquelle (z. B. Proliferation von Bifidus- und Laktobacilluskeimen unter Gabe von Oligofructose) [6; 8].
(2) Vermehrte Bildung der kurzkettige Fettsäuren Azetat, Propionat und Butyrat [5; 69]. Folge: Absenkung des pH-Werts im Dickdarm und Unterdrückung des Wachstums unerwünschter Mikroorganismen (Fäulniskeime und pathogene Mikroorganismen). Die Ansäuerung im Dickdarmlumen bewirkt darüber hinaus die Protonierung des gasförmigen Ammoniaks (NH3) zu Ammonium-Ionen (NH4 +), das in dieser Form ausgeschieden und so der Aufnahme ins Blut entzogen wird. Das bedingt eine Entlastung des Leberstoffwechsels. Entsprechend kommen spezielle Ballaststoffe (Laktulose, Laktitol) bei der diätetischen Therapie von Lebererkrankungen wie der hepatischen Enzephalopathie zum Einsatz [62].
Effekte auf das Dickdarmepithel
Die aus dem Abbau der fermentierbaren Ballaststoffe stammenden kurzkettigen Fettsäuren werden nahezu vollständig (95 – 99 %) vom Dickdarmepithel über Monocarboxylatransporter aufgenommen [32; 59]. Während Azetat und Propionat über die Pfortader zur Leber gelangen, verbleibt der Großteil des Butyrats in den Enterozyten. Hier fungiert es – noch vor Glucose – als Hauptenergiesubstrat und reguliert das Proliferations- und Differenzierungsverhalten der Zellen [69]. Insgesamt tragen diese Effekte zur Aufrechterhaltung der Integrität der Dickdarmschleimhaut bei. Die Verbesserung der Epithelbarriere zeigt sich in einer Optimierung der Strukturen und Mechanismen, welche die Passage von Bakterien, Antigenen und toxischen Substanzen aus dem Darmlumen in die Blutbahn vermindern [17; 37].
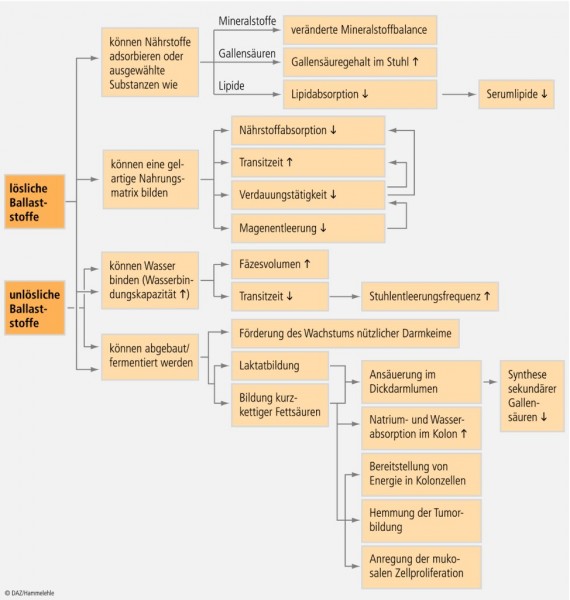
Abbildung 4 stellt die beschriebenen physiologischen Effekte der Ballaststoffe in einer Übersicht zusammen. Die systemischen Wirkungen der Ballaststoffe und ihre Bedeutung für die Prävention wird Gegenstand des zweiten Teils dieses Beitrags sein.
Literatur[1] American Association of Cereal Chemists. The definition of dietary fiber. Cereal Food World 2001;46:112-129[2] Anderson JW, Baird P, Davis RH Jr, Ferreri S, Knudtson M, Koraym A, Waters V, Williams CL. Health benefits of dietary fiber. Nutr Rev. 2009;67(4):188-205. [3] Aune D, Chan DS, Greenwood DC, Vieira AR, Rosenblatt DA, Vieira R, Norat T. Dietary fiber and breast cancer risk: a systematic review and meta-analysis of prospective studies. Ann Oncol. 2012 Jun;23(6):1394-402. [4] Aune D, Chan DS, Lau R, Vieira R, Greenwood DC, Kampman E, Norat T. Dietary fibre, whole grains, and risk of colorectal cancer: systematic review and dose-response meta-analysis of prospective studies. BMJ. 2011 10;343:d6617. [5] Bird AR, Conlon MA, Christophersen CT, Topping DL. Resistant starch, large bowel fermentation and a broader perspective of prebiotics and probiotics. Benef Microbes. 2010 Nov;1(4):423-31. [6] Blaut M. Relationship of prebiotics and food to intestinal microflora. Eur J Nutr. 2002 Nov;41 Suppl 1:I11-6.. [7] Blundell JE, Burley VJ. Satiation, satiety and the action of fibre on food intake. Int J Obes. 1987;11 Suppl 1:9-25[8] Bosscher D, Breynaert A, Pieters L, Hermans N. Food-based strategies to modulate the composition of the intestinal microbiota and their associated health effects. J Physiol Pharmacol. 2009 Dec;60 Suppl 6:5-11. [9] Brown L, Rosner B, Willett WW, Sacks FM. Cholesterol-lowering effects of dietary fiber: a meta-analysis. Am J Clin Nutr. 1999;69(1):30-42[10] Burkitt DP, Trowell HC. Dietary fibre and western diseases. Ir Med J. 1977 Jun18;70(9):272-7. [11] Burkitt DP, Walker AR, Painter NS. Dietary fiber and disease. JAMA. 1974 Aug 19;229(8):1068-74. [12] Burkitt DP, Walker AR, Painter NS. Effect of dietary fibre on stools and the transit-times, and its role in the causation of disease. Lancet. 1972 Dec 30;2(7792):1408-12. [13] Burkitt DP. Epidemiology of large bowel disease: the role of fibre. Proc Nutr Soc. 1973 Dec;32(3):145-9. [14] Burkitt DP. Possible relationships between bowel cancer and dietary habits. Proc R Soc Med. 1971 Sep;64(9):964-5. [15] Burkitt DP. Some diseases characteristic of modern Western civilization. Br Med J. 1973 Feb 3;1(5848):274-8. [16] Burkitt DP. Some diseases characteristic of modern western civilization. A possible common causative factor. Clin Radiol. 1973 Jul;24(3):271-80. [17] Canani RB, Costanzo MD, Leone L, Pedata M, Meli R, Calignano A. Potential beneficial effects of butyrate in intestinal and extraintestinal diseases. World J Gastroenterol. 2011 Mar 28;17(12):1519-28. [18] Chen HL, Haack VS, Janecky CW, Vollendorf NW, Marlett JA. Mechanisms by which wheat bran and oat bran increase stool weight in humans. Am J Clin Nutr. 1998 Sep;68(3):711-9. [19] Chuang SC, Norat T, Murphy N, Olsen A, Tjønneland A, Overvad K, Boutron-Ruault MC, Perquier F, Dartois L, Kaaks R, Teucher B, Bergmann MM, Boeing H, Trichopoulou A, Lagiou P, Trichopoulos D, Grioni S, Sacerdote C, Panico S, Palli D, Tumino R, Peeters PH, Bueno-de-Mesquita B, Ros MM, Brustad M, Asli LA, Skeie G, Quirós JR, González CA, Sánchez MJ, Navarro C, Ardanaz Aicua E, Dorronsoro M, Drake I, Sonestedt E, Johansson I, Hallmans G, Key T, Crowe F, Khaw KT, Wareham N, Ferrari P, Slimani N, Romieu I, Gallo V, Riboli E, Vineis P. Fiber intake and total and cause-specific mortality in the European Prospective Investigation into Cancer and Nutrition cohort. Am J Clin Nutr. 2012 Jul;96(1):164-74. [20] Cohn JS, Kamili A, Wat E, Chung RW, Tandy S. Reduction in intestinal cholesterol absorption by various food components: mechanisms and implications. Atheroscler Suppl. 2010 Jun;11(1):45-8. [21] Coxam V. Current data with inulin-type fructans and calcium, targeting bone health in adults. J Nutr. 2007 Nov;137(11 Suppl):2527S-2533S. [22] Deutsche Gesellschaft für Ernährung (DGE), Österreichische Gesellschaft für Ernährung (ÖGE), Schweizerische Gesellschaft für Ernährung (SGE), Schweizerische Vereinigung für Ernährung (SVE): Referenzwerte für die Nährstoffzufuhr. 1. Auflage, 3. vollständig durchgesehener und korrigierter Nachdruck. Neuer Umschau Buchverlag, Neustadt an der Weinstraße 2008 [23] Devries JW. Dietary fiber: the influence of definition on analysis and regulation. J AOAC Int. 2004 May-Jun;87(3):682-706. [24] DeVries JW: On defining dietary fibre. Proc Nutr Soc 62(1):37-43, 2003 [25] Dunaif G, Schneeman BO. The effect of dietary fiber on human pancreatic enzyme activity in vitro. Am J Clin Nutr. 1981 Jun;34(6):1034-5. [26] Dutta SK, Hlasko J. Dietary fiber in pancreatic disease: effect of high fiber diet on fat malabsorption in pancreatic insufficiency and in vitro study of the interaction of dietary fiber with pancreatic enzymes. Am J Clin Nutr. 1985 Mar;41(3):517-25. [27] Englyst HN, Kingman SM, Cummings JH. Classification and measurement of nutritionally important starch fractions. Eur J Clin Nutr. 1992 Oct;46 Suppl 2:S33-50. [28] Eshak ES, Iso H, Date C, Kikuchi S, Watanabe Y, Wada Y, Wakai K, Tamakoshi A; JACC Study Group. Dietary fiber intake is associated with reduced risk of mortality from cardiovascular disease among Japanese men and women. J Nutr. 2010 Aug;140(8):1445-53 [29] Fardet A. New hypotheses for the health-protective mechanisms of whole-grain cereals: what is beyond fibre? Nutr Res Rev. 2010 Jun;23(1):65-134. [30] Foster-Powell K, Holt SH, Brand-Miller JC. International table of glycemic index and glycemic load values: 2002. Am J Clin Nutr. 2002 Jul;76(1):5-56. [31] Galisteo M, Duarte J, Zarzuelo A. Effects of dietary fibers on disturbances clustered in the metabolic syndrome. J Nutr Biochem. 2008 Feb;19(2):71-84 [32] Ganapathy V, Thangaraju M, Gopal E, Martin PM, Itagaki S, Miyauchi S, Prasad PD. Sodium-coupled monocarboxylate transporters in normal tissues and in cancer. AAPS J. 2008;10(1):193-9 [33] Gaßmann B: Dietary reference Intakes (DRI), Report 6. Übersicht, Kommentar und Vergleich mit den D-A-C-H-Referenzwerten für die Nährstoffzufuhr. Teil 1: Nahrungsenergie, Kohlenhydrate und Faserstoffe. Ernähr-Umschau 50: 96-102, 2003 [34] Greger JL. Nondigestible carbohydrates and mineral bioavailability. J Nutr. 1999;129(7 Suppl):1434S-1435S [35] Gunness P, Gidley MJ. Mechanisms underlying the cholesterol-lowering properties of soluble dietary fibre polysaccharides. Food Funct. 2010 Nov;1(2):149-55 [36] Hansen WE, Schulz G. The effect of dietary fiber on pancreatic amylase activity in vitro. Hepatogastroenterology. 1982 Aug;29(4):157-60 [37] Havenaar R. Intestinal health functions of colonic microbial metabolites: a review. Benef Microbes. 2011 Jun;2(2):103-14 [38] Howarth NC, Saltzman E, Roberts SB. Dietary fiber and weight regulation. Nutr Rev. 2001 May;59(5):129-39 [39] Institiute of Medicine of the National Academy (Food and Nutrition Board): Dietary Reference Intakes for energy, carbohydrate, fiber, fat, fatty acids, cholesterol, protein, and amino acids. The National Academies Press, Washington D.C. 2002 [40] Isaksson G, Lundquist I, Ihse I. Effect of dietary fiber on pancreatic enzyme activity in vitro. Gastroenterology. 1982 May;82(5 Pt 1):918-24 [41] Jenkins DJ, Peterson RD, Thorne MJ, Ferguson PW. Wheat fiber and laxation: dose response and equilibration time. Am J Gastroenterol. 1987 Dec;82(12):1259-63 [42] Jones JR, Lineback DM, Levine MJ. Dietary reference intakes: implications for fiber labeling and consumption: a summary of the International Life Sciences Institute North America Fiber Workshop, June 1-2, 2004, Washington, DC. Nutr Rev. 2006 Jan;64(1):31-8 [43] King DE. Dietary fiber, inflammation, and cardiovascular disease. Mol Nutr Food Res. 2005 Jun;49(6):594-600 [44] Kristensen M, Jensen MG. Dietary fibres in the regulation of appetite and food intake. Importance of viscosity. Appetite. 2011 Feb;56(1):65-70 [45] Lu ZX, Walker KZ, Muir JG, Mascara T, O'Dea K. Arabinoxylan fiber, a byproduct of wheat flour processing, reduces the postprandial glucose response in normoglycemic subjects. Am J Clin Nutr. 2000 May;71(5):1123-8 [46] Lupton JR, Morin JL, Robinson MC. Barley bran flour accelerates gastrointestinal transit time. J Am Diet Assoc. 1993 Aug;93(8):881-5 [47] Lupton JR, Turner ND. Dietary fiber. In: Stipanuk MH. Biochemical, Physiological and Molecular Aspects of Human Nutrition. Saunders, Elsevier 2006, S. 240-253 [48] Marlett JA, Cheung TF. Database and quick methods of assessing typical dietary fiber intakes using data for 228 commonly consumed foods. J Am Diet Assoc. 1997 Oct;97(10):1139-48 [49] Meijer K, de Vos P, Priebe MG. Butyrate and other short-chain fatty acids as modulators of immunity: what relevance for health? Curr Opin Clin Nutr Metab Care. 2010 Nov;13(6):715-21 [50] Monro JA, Shaw M. Glycemic impact, glycemic glucose equivalents, glycemic index, and glycemic load: definitions, distinctions, and implications. Am J Clin Nutr. 2008 Jan;87(1):237S-243S [51] N.N. Fiber. In: Gropper SS, Smith JL, Groff JL. Advanced Nutrition And Human Metabolism. 5th edition, Wadsworth, Belmont (USA), 2009, pp. 107-123 [52] N.N.: Novellierung der Stellungnahme zu Ballaststoffen der LChG aus dem Jahre 1989. Lebensmittelchemie 56, 66-68, 2002 [53] Park Y, Subar AF, Hollenbeck A, Schatzkin A. Dietary fiber intake and mortality in the NIH-AARP diet and health study. Arch Intern Med. 2011 Jun 27;171(12):1061-8 [54] Pereira MA, Ludwig DS. Dietary fiber and body-weight regulation. Observations and mechanisms. Pediatr Clin North Am. 2001 Aug;48(4):969-80 [55] Pereira MA, O'Reilly E, Augustsson K, Fraser GE, Goldbourt U, Heitmann BL, Hallmans G, Knekt P, Liu S, Pietinen P, Spiegelman D, Stevens J, Virtamo J, Willett WC, Ascherio A. Dietary fiber and risk of coronary heart disease: a pooled analysis of cohort studies. Arch Intern Med. 2004 Feb 23;164(4):370-6 [56] Potkins ZV, Lawrence TL, Thomlinson JR. Effects of structural and non-structural polysaccharides in the diet of the growing pig on gastric emptying rate and rate of passage of digesta to the terminal ileum and through the total gastrointestinal tract. Br J Nutr. 1991 May;65(3):391-413 [57] Rubner M. Unsere Nahrungsmittel und die Ernährungskunde. Moritz, Stuttgart 1904 [58] Rubner, M.: Die Verdaulichkeit von Weizenbrot. Arch Anat Physiol. 1916, p. 61 [59] Ruppin H, Bar-Meir S, Soergel KH, Wood CM, Schmitt MG Jr. Absorption of short-chain fatty acids by the colon. Gastroenterology. 1980 Jun;78(6):1500-7 [60] Scholz-Ahrens KE, Schrezenmeir J. Inulin and oligofructose and mineral metabolism: the evidence from animal trials. J Nutr. 2007 Nov;137(11 Suppl):2513S-2523S. Review. PubMed PMID: 17951495 [61] Schulze MB, Schulz M, Heidemann C, Schienkiewitz A, Hoffmann K, Boeing H. Fiber and magnesium intake and incidence of type 2 diabetes: a prospective study and meta-analysis. Arch Intern Med. 2007 May 14;167(9):956-65 [62] Shukla S, Shukla A, Mehboob S, Guha S. Meta-analysis: the effects of gut flora modulation using prebiotics, probiotics and synbiotics on minimal hepatic encephalopathy. Aliment Pharmacol Ther. 2011 Mar;33(6):662-71 [63] Slavin JL. Dietary fiber and body weight. Nutrition. 2005 Mar;21(3):411-8 [64] Spiller RC. Pharmacology of dietary fibre. Pharmacol Ther. 1994;62(3):407-27 [65] Stevens J, VanSoest PJ, Robertson JB, Levitsky DA. Comparison of the effects of psyllium and wheat bran on gastrointestinal transit time and stool characteristics. J Am Diet Assoc. 1988 Mar;88(3):323-6 [66] Streppel MT, Ocké MC, Boshuizen HC, Kok FJ, Kromhout D. Dietary fiber intake in relation to coronary heart disease and all-cause mortality over 40 y: the Zutphen Study. Am J Clin Nutr. 2008 Oct;88(4):1119-25 [67] Thomas B. Definition, Zusammensetzung und Eigenschaften von Ballaststoffen. In: Rottka H (Hrsg.): Pflanzenfasern-Ballaststoffe in der menschlichen Ernährung. Thieme, Stuttgart/New York 1980, S. 10-19. Zitiert nach: Trepel F. Dietary fibre: more than a matter of dietetics. I. Compounds, properties, physiological effects. Wien Klin Wochenschr. 2004a Jul 31;116(14):465-76 [68] Todd S, Woodward M, Tunstall-Pedoe H, Bolton-Smith C. Dietary antioxidant vitamins and fiber in the etiology of cardiovascular disease and all-causes mortality: results from the Scottish Heart Health Study. Am J Epidemiol. 1999 Nov 15;150(10):1073-80 [69] Topping DL, Clifton PM. Short-chain fatty acids and human colonic function: roles of resistant starch and nonstarch polysaccharides. Physiol Rev. 2001 Jul;81(3):1031-64 [70] Trepel F. Dietary fibre: more than a matter of dietetics. I. Compounds, properties, physiological effects. Wien Klin Wochenschr. 2004 Jul 31;116(14):465-76 [71] Trowell H. Crude fibre, dietary fibre and atherosclerosis. Atherosclerosis. 1972 Jul-Aug;16(1):138-40 [72] Trowell H. Dietary fibre, ischaemic heart disease and diabetes mellitus. Proc Nutr Soc. 1973 Dec;32(3):151-7 [73] Trowell HC. Western diseases, Western diets and fibre. East Afr Med J. 1978 Jun;55(6):283-9 [74] Tunali G, Cremer H-D, Huth K. Vergleichende Untersuchungen der Glukose- und Galaktoseassimilation bei Verabfolgung von Füll- und Quellstoffen. Akt. Ernährungsmed 2; 76, 1976 [75] Vincent R, Roberts A, Frier M, Perkins AC, MacDonald IA, Spiller RC. Effect of bran particle size on gastric emptying and small bowel transit in humans: a scintigraphic study. Gut. 1995 Aug;37(2):216-9 [76] Watzl B, Leitzmann C: Bioaktive Substanzen in Lebensmitteln. 2. Auflage, Hippokrates, Stuttgart 1999 [77] Weickert MO, Pfeiffer AF. Metabolic effects of dietary fiber consumption and prevention of diabetes. J Nutr. 2008 Mar;138(3):439-42 [78] Wisker E, Becker HG, Steller W, Seibel F, Meuser P, Surkow W, Kulikowski I, Feldheim W. Ballaststoffe in unserer Kost – Ergebnisse einer Gemeinschaftsuntersuchung. AID-Verbraucherdienst. 1984;9. Zitiert nach Kasper H. Ernährungsmedizin und Diätetik. 11. Auflage, Urban&Fischer, München 2009 [79] Wolever TM, Jenkins DA. Effect of Dietary Fiber and Foods on Carbohydrate Metabolism. In: Spiller GA, ed. CRC Handbook of Dietary Fiber in Human Nutrition. 3rd ed. Boca Raton: CRC Press; 2001:321-360 [80] Wrick KL, Robertson JB, Van Soest PJ, Lewis BA, Rivers JM, Roe DA, Hackler LR. The influence of dietary fiber source on human intestinal transit and stool output. J Nutr. 1983 Aug;113(8):1464-79
Für die Autoren
Dr. Alexander Ströhle,
Leibniz Universität Hannover, Institut für Lebensmittelwissenschaft
und Humanernährung,
Am Kleinen Felde 30, 30167 Hannover
E-Mail: stroehle@nutrition.uni-hannover.de




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.