
- DAZ.online
- DAZ / AZ
- DAZ 7/2011
- Paracetamol: altbewährt ...
Debatte
Paracetamol: altbewährt oder riskant?
Lebertoxizität
Die Lebertoxizität überhöhter Paracetamol-Dosen von mehr als 6 g bei gesunden Erwachsenen ist bekannt [3]. Derzeit wird die Möglichkeit von Intoxikationen im Bereich der zugelassenen Höchstdosis (4 g pro Tag) und darunter diskutiert. Die von Brune [1] als Beleg für eine Toxizität niedriger Dosen angeführten Quellen bieten allerdings wenig belastbare Information: Eine Sekundärquelle mit einer unbelegten Mutmaßung [5] sowie eine retrospektive Studie, in der die Leberintoxikationen im Ruhrgebiet über sechs Jahre ausgewertet und sechs Fälle nach Tagesdosen von 3 bis 5 g Paracetamol identifiziert wurden [4], sind für diese Fragestellung nutzlos ohne weitere Dosisaufschlüsselung.
Auch andere deutsche Daten sind zur möglichen Toxizität niedriger Paracetamol-Dosen unergiebig. In einer retrospektiven Langzeitstudie am Klinikum Erlangen-Nürnberg wurden Daten der 5883 Patienten ausgewertet, die wegen Vergiftungen intensivmedizinisch betreut wurden. Von diesen Patienten verstarben neun, wobei keiner dieser Patienten Paracetamol eingenommen hatte [6]. In einem Interview bekräftigte Dr. Mühlberg, dass Vergiftungen durch ASS und Paracetamol nach seiner Erfahrung praktisch keine Rolle spielten. Dies ist auch das Ergebnis einer Analyse der Gesellschaft für klinische Toxikologie: In den Jahren 1996, 2001 und 2006 wurden ca. 11.000 Anfragen zu Intoxikationen mit Paracetamol gestellt, 63 bis 68% davon im Zusammenhang mit suizidaler Absicht. In diesen drei Jahren wurden aber nur drei Todesfälle im kausalen Zusammenhang mit Paracetamol verzeichnet [7].
Zum WeiterlesenAlte und möglicherweise neue Nebenwirkungen haben die Frage aufkommen lassen, ob eine Schmerzmitteltherapie mit Paracetamol im Rahmen der Selbstmedikation weiterhin vertretbar ist. Die Expertenmeinungen gehen auseinander. Lesen Sie dazu auch: Lebertoxizität: FDA fordert Dosislimit für Paracetamol DAZ 2011; Nr. 3: S. 34 – 35Muss Paracetamol auf den Prüfstand? Diskussion um neue Studien zu potenziellen Risiken von Paracetamol. DAZ 2010; Nr. 50; S. 67 – 69Paracetamol: Ein Wolf im Schafspelz läuft frei herum Kommentar von Prof. Dr. Dr. Kay Brune DAZ 2010; Nr. 49; S. 42 – 43 |
Asymptomatische Erhöhungen von Leberenzymen, die von den Autoren aber nicht als lebertoxische Wirkung interpretiert werden, können bei Anwendung der Tageshöchstdosis von Paracetamol sowohl bei gesunden Freiwilligen [8] wie auch bei Personen mit Alkoholabusus eintreten [9, 10]. In der Mehrzahl der Untersuchungen konnte kein oder nur ein leichter Anstieg nachgewiesen werden [10, 11]. In einer Metaanalyse zu Paracetamol-Studien an Osteoarthritis-Patienten (1,95 bis 4 g/d; 4 Wochen bis 12 Monate) fanden Kuffner et al. [12] nur gelegentlich eine vorübergehende Erhöhung der Alanin-Aminotransferase (ALAT) ohne klinische Symptome. Weitere Studien mit geringem oder fehlendem Transaminasen-Anstieg werden von Watkins et al. [13] angeführt.
Die divergierenden Resultate zum Effekt von Paracetamol auf die Leberenzyme erklären Heard et al. [10] mit Unterschieden in der Studienanlage und einem nur temporären Enzymanstieg. Durch häufige Bestimmungen in den ersten Tagen einer Paracetamol-Anwendung werden auch vorübergehende Erhöhungen erfasst, die nach längerer Behandlungsdauer nicht mehr nachweisbar sind. Insgesamt könnte es sich um nicht-toxische Anpassungsreaktionen der Leber handeln, wie sie für Isoniazid und Statine bekannt sind [14, 15]. Es gibt zahlreiche Ursachen für eine asymptomatische Erhöhung von Leberenzymen, insbesondere der ALAT. Nach Schätzungen einer amerikanischen Fachgesellschaft sind davon 1 bis 4% der Bevölkerung betroffen. Mögliche Ursachen sind eine vorübergehende "Fast-Food"-Diät, moderater Alkoholgenuss oder auch Leistungssport [16, 17, 18].
Die Evidenz für eine Lebertoxizität von Paracetamol-Dosen ≤ 4 g ist demnach unzureichend und auch Änderungen bei den Leberenzymen können eine solche Schlussfolgerung nicht begründen.
Kardiovaskuläres Risiko
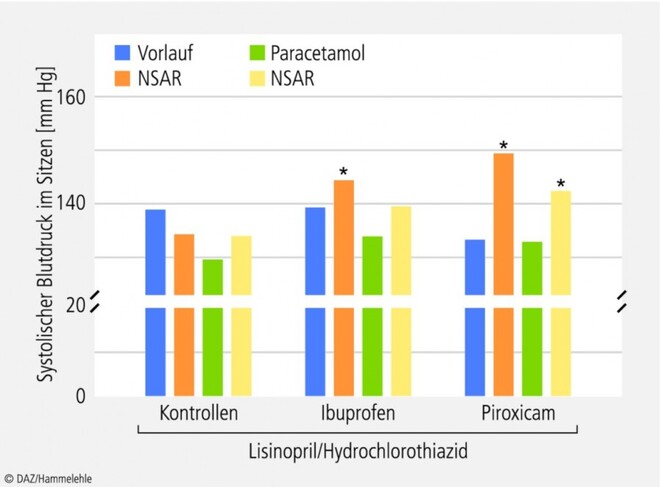
Blutdrucksteigerung bei hypertonen Patienten • Blutdruckerhöhungen unter traditionellen nichtsteroidalen Antirheumatika (NSAR) sind bereits seit den neunziger Jahren bekannt. Zunächst vor allem auf pharmakodynamische Wechselwirkungen mit Antihypertensiva zurückgeführt [3, 19, 20], wurden sie später auch bei normotonen Patienten beschrieben [21, 22]. Paracetamol, das keine der für NSAR diskutierten Interaktionen aufweist, wird vielfach als Alternative bei Hypertonikern gesehen. Diese Empfehlung wird auch durch neuere Untersuchungen bestätigt (Abb. 1 [23]). Paracetamol scheint für behandelte Hypertoniker ein geringeres Blutdruckrisiko darzustellen als bestimmte NSAR wie Indometacin und Ibuprofen (Abb. 1) [23, 24, 25].
Blutdrucksteigerung bei normotonen Patienten • Bei Normotonikern wurden unter NSAR und Paracetamol vergleichbare Blutdruckerhöhungen berichtet: In den Nurses Health Studies [21] und der Health Professionals Follow-up Study [22] stieg das relative Risiko einer neu diagnostizierten Hypertonie mit zunehmender täglicher Dosis bzw. der Einnahmehäufigkeit vergleichbar für NSAR und Paracetamol an.
Dies deutet auf einen weiteren Mechanismus hin, der diesmal Paracetamol wie auch die NSAR beträfe. Zu erwähnen bleibt, dass niedrig dosierte Acetylsalicylsäure (ASS) keinen praktisch bedeutsamen Einfluss auf den Blutdruck besitzt [20, 21, 22].
Generell erscheinen die mit NSAR oder Paracetamol beobachteten Blutdrucksteigerungen (ca. 3 mm Hg systolisch) quantitativ gering [20, 26, 27] und erfordern verhältnismäßig hohe Dosierungen (≥ 2,5 g für Paracetamol [28, 29]). In einer großen prospektiven Kohortenstudie wurden erhöhte kardiovaskuläre Risiken sowohl mit NSAR als auch mit Paracetamol vor allem bei regelmäßigem Gebrauch (> 22 Tage pro Monat) und Anwendung höherer Dosen (> 14 Tabletten pro Woche) signifikant [30].
Erhöhte kardiovaskuläre Gefahren von NSAR und Paracetamol setzen offenbar eine häufige bis kontinuierliche Anwendung voraus. In der Metaanalyse von Chan et al. [30] war ein Risiko bei weniger als täglicher Anwendung nicht erkennbar. Für den Alltag haben Wilson und Poulter [20] daher zutreffend festgestellt, dass bei normotonen, ansonsten gesunden Erwachsenen die Vorteile einer kurzdauernden Behandlung mit NSAR oder Paracetamol die möglichen Nachteile einer geringen Blutdrucksteigerung übertreffen. Bei bestehender Hypertonie ist das Ausmaß einer Blutdrucksteigerung weniger vorhersagbar und kann mit dem Alter, dem angewendeten NSAR und dem antihypertensiven Regime variieren [20]. Aufgrund der fehlenden Interaktion mit Antihypertensiva hat Paracetamol hier einen besonderen Platz.
Gastrointestinales Risiko
Bei regelmäßiger Einnahme von NSAR/ASS werden endoskopisch bei 15 bis 30% der Patienten gastroduodenale Schleimhautläsionen nachweisbar. Zu Komplikationen wie schweren Blutungen, Perforationen und Obstruktionen kommt es in etwa 1 bis 1,5% der Fälle, nicht selten nach symptomloser Vorgeschichte. Diese Effekte lassen sich zu weiten Teilen mit einer Hemmung der Cyclooxygenase Typ 1 (COX 1) erklären, die im Magen für die Synthese protektiver Prostaglandine verantwortlich ist.
Unterschiede bei der COX-1-Hemmung helfen auch, die bessere Magenverträglichkeit von Paracetamol zu verstehen: Während 100 µmol/l Paracetamol in isolierter Magenschleimhaut ohne jeden Hemmeffekt auf die PGE2-Synthese blieb, zeigte Naproxen als Vertreter der NSAR (therapeutische Konzentrationen 90 – 220 µmol/l) be-reits bei einer Konzentration < 1 µmol/l eine halbmaximale Inhibition [72]. Dazu passen neuere Ergebnisse von Hinz et al. [33], die Freiwilligen 1000 mg Paracetamol verabreichten und sodann ex vivo die COX-1-Aktivität im Vollblut bestimmten. Die höchste in vivo erreichte Plasmakonzentration betrug etwa 100 µmol/l und führte zu einer COX-1-Hemmung von nur 56%. Wie die Autoren ausführen, könnten auch physikochemische Differenzen und weitere, nicht durch die COX-Hemmung vermittelte Effekte zu den vergleichsweise vorteilhaften Eigenschaften von Paracetamol beitragen [33].
Es ist daher nicht verwunderlich, dass in einer großen Fall-Kontrollstudie bei üblichen Dosierungen keine gastroduodenalen Komplikationen für Paracetamol nachweisbar waren. Erst bei Dosen > 2000 mg zeigte sich eine erhöhte Inzidenz gastroduodenaler Blutungen und Perforationen [34], während für NSAR wie Naproxen und Ibuprofen dies bereits auf niedrige/mittlere Dosierungen zutraf. Neuere retrospektive Studien [35] kommen zu keinem anderen Ergebnis: Auch höher dosiertes Paracetamol (> 3000 mg) bleibt bei der Zahl spezifischer Krankenhauseinweisungen (Ulzeration, Blutung, Perforation) hinter den traditionellen NSAR zurück.
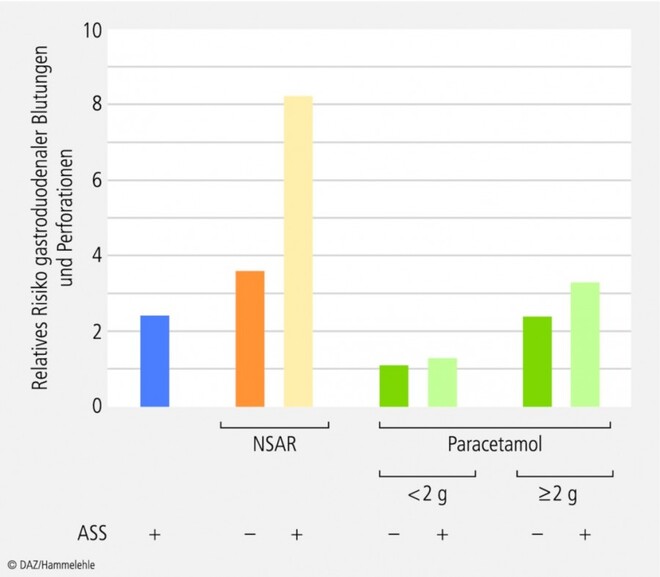
Ähnliche Daten werden in einer weiteren Publikation von Garcia-Rodrigues et al. [36] referiert. Der Vorteil von Paracetamol bleibt auch in Kombination mit niedrig dosierter ASS erhalten (Abb. 2).
Es gilt also weiterhin, dass das Risiko gastrointestinaler Komplikationen durch die üblicherweise eingesetzten Dosen von Paracetamol nur geringfügig oder nicht erhöht wird. Paracetamol kann hinsichtlich des Ulkusrisikos weiterhin als sicherere Alternative gegenüber den traditionellen NSAR gelten [33, 37, 38].
Kryptorchismus und männliche Fertilitätsstörungen
Seit Jahrzehnten wird Paracetamol als Schmerzmittel erster Wahl in Schwangerschaft und Stillzeit eingesetzt [39]. Ein erhöhtes Risiko für kongenitale Anomalien wurde bislang nicht angenommen. Neuere retrospektive Studien vermuten einen Zusammenhang zwischen der Einnahme von Paracetamol und Hodenhochstand (Kryptorchismus) und männlichen Fertilitätsstörungen [40, 41]. Inwieweit mit diesen Studien eine Kausalität nachgewiesen werden kann, ist kritisch zu hinterfragen.
In Tierversuchen mit Mäusen [42] und Ratten [43, 44] zeigten sich keine teratogenen Effekte. Lediglich sehr hohe Paracetamol-Dosen (400 bis 600 mg/kg täglich) führten bei Ratten und Mäusen zu Einschränkungen der Spermiogenese und Hodenatrophie [45 – 47]. Kristensen et al. [41] zeigten mithilfe von trächtigen Ratten, dass sich bei den männlichen Nachkommen der Abstand zwischen Anus und Penisbasis (anogenital distance) unter hohen Paracetamol-Dosen von 250 mg/kg/d um 9% verringerte.
Eine prospektive Studie zum Einsatz von Analgetika in der Schwangerschaft fand eine erhöhte Abortrate unter NSAR, nicht aber unter Paracetamol [48]. Zahlreiche Fall-Kontroll-Studien ergaben keine Hinweise auf ein erhöhtes Fehlbildungsrisiko nach Einnahme von Paracetamol in der Schwangerschaft [49 – 54]. Nach Anwendung von Paracetamol im ersten Trimenon beobachtete man bei den Nachkommen von 697 Schwangeren keine Zunahme von Fehlbildungen [55]. Unter 538 Kindern mit Neuralrohrdefekten ergab sich kein Zusammenhang mit einer Paracetamol-Einnahme im ersten Trimenon. Eine Fall-Kontroll-Studie im Rahmen der National Birth Defects Prevention Study in den USA zeigte auf der Basis von 11.610 Fällen keinen Zusammenhang zwischen der Anwendung von Paracetamol in der Schwangerschaft und kongenitalen Anomalien. Bei Applikation von Paracetamol wegen Fiebers bzw. Infektionen in der Frühschwangerschaft sank vielmehr das Risiko für Neuralrohr- oder Ohrmuscheldefekte, Lippenspalten und Gastroschisis [57]. Selbst nach Überdosen von Paracetamol registrierten McElhatton et al. [58] in 300 Schwangerschaften keinen Anstieg der Fehlbildungsrate.
Jensen et al. [40] berichten von einem Zusammenhang zwischen der Gabe von Paracetamol im ersten oder zweiten Trimenon und der Diagnose Kryptorchismus bei den Nachkommen, allerdings mit einem statistisch grenzwertigen Resultat (adjusted hazard ratio 1,33, 95%-Konfidenzintervall 1,00 – 1,77). Eine weitere Analyse von dänischen und finnischen Schwangerschaften [41] postuliert einen Zusammenhang zwischen der Anwendung von milden Analgetika im ersten und/oder zweiten Trimenon und der Entwicklung eines Kryptorchismus. Tatsächlich trat in der finnischen Teilpopulation der Studie kein Anstieg des Kryptorchismus-Risikos auf. In der kleineren dänischen Gruppe konnte ein signifikant erhöhtes Kryptorchismus-Risiko nur für die Einnahme der Einzelsubstanzen ASS bzw. Ibuprofen gezeigt werden, nicht aber für Paracetamol. Das höchste Risiko ergab sich für die Therapie mit verschiedenen Analgetika über mehr als zwei Wochen im ersten bzw. zweiten Trimenon (adjusted odds ratio 21,7; 95%-Konfidenzintervall 1,83 – 258). Bei der Bewertung der Daten muss bedacht werden, dass die Angaben zur Arzneimittelexposition nicht parallel zur Schwangerschaft erhoben wurden, sondern erst im letzten Trimenon für die ersten beiden Drittel abgefragt wurden. Weiterhin führten die relativ geringen Fallzahlen der dänischen Teilstudie (42 von Kryptorchismus betroffene Jungen) zu sehr weiten Konfidenzintervallen.
Daraus lässt sich schließen, dass eine Medikamentenanwendung in der Schwangerschaft grundsätzlich nur unter strenger Indikationsstellung erfolgen sollte. Dies gilt auch für die Anwendung milder Analgetika. Angesichts der sehr inhomogenen Datenlage erscheint es jedoch nicht angebracht, die Einnahme von Paracetamol als Auslöser für eine allgemeine Verschlechterung der Spermienqualität in den letzten Jahrzehnten verantwortlich zu machen. Stattdessen sollte die Datenlage Anlass zu umfangreicheren Untersuchungen geben. Durch prospektiv kontrollierte Follow-up Studien, wie sie im Rahmen des European Network of Teratology Information Services durchgeführt werden, werden hoffentlich die aufgeworfenen Fragen mit überzeugenden Fallzahlen geklärt.
Asthma-Risiko
Der deutliche Anstieg der Diagnose Asthma über die letzten Jahrzehnte hat zu einer weltweiten Suche nach den möglichen Ursachen geführt. In zum Teil sehr großen retrospektiven epidemiologischen Studien wird ein leicht erhöhtes Risiko berichtet, wenn Paracetamol in der Schwangerschaft, in den ersten Lebensmonaten oder Lebensjahren angewendet wurde [59 – 65]. Diese epidemiologischen Studien haben den generellen Nachteil, dass sie Daten erheben, die (zum Teil Jahre) zurückliegen und daher mit einer hohen Irrtumswahrscheinlichkeit belastet sind. Ob ein gefundenes (ermitteltes) Risiko tatsächlich vorhanden ist, bleibt fraglich, da bereits ein einziger nicht berücksichtigter Störfaktor (confounding factor) die ganze Aussage zunichte machen kann.
In diesem Zusammenhang kann gar nicht genug darauf hingewiesen werden, dass Rhinoviren die Hauptursache von Asthma bei Kindern über sechs Jahre darstellen [66]. Daher besteht die Wahrscheinlichkeit, dass Paracetamol eingenommen wurde, um das Fieber bei dieser Viruserkrankung zu senken. Es spricht auch für die Annahme, dass die Infektion, nicht aber die Therapie, auslösender Faktor für das Asthma ist ("confounding by indication"), da die Gabe von Antibiotika in den ersten Lebensmonaten gleichermaßen mit dem Auftreten von Asthma bei älteren Kindern korreliert [67]. Die Gefahr ist offensichtlich, dass Paracetamol nachträglich fälschlich angelastet wird, es habe Asthma verursacht, vergleichbar dem Fehlschluss, dass die Erblindung eines Diabetikers auf dem Gebrauch von Insulin beruht. Auch Schnabel und Heinrich [68] gingen dem Zusammenhang Infektion/Paracetamol/Asthma in einer prospektiven Studie nach, in die über 3000 Neugeborene eingeschlossen wurden. Sie kommen zu dem Ergebnis, dass nicht die Paracetamol-Anwendung per se, sondern vielmehr Atemwegsinfektionen entsprechend disponierter Kinder mit der Entwicklung von Asthma assoziiert sind.
Zur Relevanz einer pränatalen Paracetamol-Exposition liegen zwei prospektive Studien vor. Persky et al. [69] berichten, dass die Anwendung von Paracetamol im mittleren und späten Abschnitt der Schwangerschaft mit respiratorischen Symptomen im ersten Lebensjahr assoziiert ist, während Kang et al. [70] keinerlei Hinweis darauf finden. Ein bemerkenswerter Unterschied zwischen den beiden Studien liegt darin, dass Persky et al. [69] ihre Untersuchung auf Berichte von pfeifender Atmung im ersten Lebensjahr als Asthmasurrogat stützten, während Kang et al. [70] ein Asthma erst dann konstatierten, wenn im sechsten Lebensjahr Fragen nach pfeifender Atmung wie auch nach einer ärztlichen Asthmadiagnose mit ja beantwortet wurden. Der letztgenannte Endpunkt ist überzeugender, da auch Persky et al. [69] einräumen, dass Pfeifen ein unzuverlässiger Indikator für Asthma ist, das mit Sicherheit erst in späteren Lebensjahren diagnostiziert werden kann.
Daher ist Scialli et al. [65] beizupflichten, wenn sie in ihrem kritischen Review konstatieren, dass die vorhandenen Daten für eine kausale Beziehung zwischen Paracetamoleinnahme in der Schwangerschaft und späterem Asthma bei Kindern nicht ausreichen. Paracetamol bleibt das bevorzugte Medikament gegen Schmerzen und Fieber in der Schwangerschaft [65] und bei Asthmaerkrankungen [71].
Trotz allem bleiben wir mit einer Verunsicherung zurück, ob die Einnahme von Paracetamol ursächlich das Risiko erhöht, an Asthma zu erkranken. Vielmehr müssen weitere Studien klären, ob die Einnahme von Paracetamol ursächlich das Risiko erhöht, an Asthma zu erkranken.
Analgetika wie Paracetamol sollten natürlich, wie alle anderen Pharmaka, nur in begründeten Fällen, rational und in der jeweils richtigen Dosierung eingenommen werden. Die Deutsche Migräne- und Kopfschmerzgesellschaft (DMKG) empfiehlt in ihren Leitlinien Paracetamol als Mittel der ersten Wahl in der Schwangerschaft und Stillzeit. Zudem wird Paracetamol in der kürzlich erschienenen PRISCUS-Liste, in der 83 in Bezug auf unerwünschte Arzneimittelwirkungen für Senioren potenziell inadäquate Wirkstoffe (u. a. einige NSAR) aufgelistet sind, als geeignete Therapiealternative aufgeführt.
Es darf nicht sein, dass in jüngster Zeit publizierte Arbeiten zu Verwirrung und Verunsicherung bei Fachkreisen und Verbrauchern führen, woraus unkontrollierte Wirkstoffwechsel zu Präparaten mit einem weitaus größeren Nebenwirkungsspektrum resultieren. Um der hohen ethischen Verantwortung gerecht zu werden, sollte das oberste Ziel in einer fundierten, objektiven Darstellung der Tatsachen und einer evidenzbasierten Datenanalyse liegen.
Literatur
[1] Brune K (2010) Paracetamol: ein Wolf im Schafspelz läuft frei herum. DAZ 42: 5646-47.
[2] Petersen KU, Friderichs E (2010) Paracetamol – klinischer Einsatz und neue Erkenntnisse zum analgetischen Wirkmechanismus. Intensiv-und Notfallbehandlung 35: 16–25.
[3] Dukes MNG (Hrsg). Meyler´s side effects of drugs (13. Aufl.), p 212, Elsevier, Amsterdam (1996)
[4] Canbay A et al. (2009) Acute liver failure in a metropolitan area in Germany. Z Gastroenterol 47: 807813.
[5] Lee WM (2007) Acetaminophen toxicity. Hepatology; 46: 966–970.
[6] Mühlberg W et al. (2005) Acute poisoning in old and very old patients: a longitudinal retrospective study of 5883 patients in a toxicological intensive care unit. Zeitschrift für Gerontologie und Geriatrie 38:182-189.
[7] Stürer A. (2008) Paracetamol-Vergiftungen in Deutschland. Mitteilung der Gesellschaft für Klinische Toxikologie (GfKT) und der deutschen Giftinformationszentren (GIZ) 3:1-3.
[8] Watkins PB et al. (2006) Aminotransferase Elevations in Healthy Adults Receiving 4 Grams of Acetaminophen daily: A randomized controlled trial. JAMA 2006; 296(1):87-93.
[9] Dart RC et al. (2010) The effects of paracetamol (acetaminophen) on hepatic tests in patients who chronically abuse alcohol - a randomized study. Aliment Pharmacol Ther 32: 478-486.
[10] Heard K et al. (2007) A randomized trial to determine the change in alanine aminotransferase during 10 days of paracetamol (acetaminophen) administration in subjects who consume moderate amounts of alcohol. Aliment Pharmacol Ther 26:283-290.
[11] Kuffner EK et al. (2001) Effect of Maximal Daily Doses of Acetaminophen on the Liver of Alcoholic Patients. A randomized, double-blind, placebo-controlled trial. Arch Intern Med 161:2247-2252.
[12] Kuffner EK et al. (2006) Retrospective analysis of transient elevations in alanine aminotransferase during long-term treatment with acetaminophen in osteoarthritis clinical trials. Current Medical Research & Opinion 22(11):2137-2148.
[13] Watkins PB et al. (2006) Aminotransferase elevations in healthy adults receiving 4 grams of acetaminophen daily: a randomized controlled trial. JAMA 296(1):87-93.
[14] Chalasani et al. (2004) Patients with elevated liver enzymes are not at higher risk for statin hepatotoxicity. Gastroenterology 126: 1287-1292.
[15] Stirnimann et al. (2010) Liver injury caused by drugs: an update. Swiss Med Wkly 140: w13080.
[16] Giboney PT. (2005) Mildly elevated liver transaminase levels in the asymptomatic patient. American Family Physician 71(6): 1105-1110.
[17] Pratt DS and Kaplan MM. (2000) Evaluation of abnormal liver-enzyme results in asymptomatic patients. The New England Journal of Medicine 342(17): 1266-1271.
[18] Kechagias S et al. (2008) Fast-food-based hyper-alimentation can induce rapid and profound elevation of serum alanine aminotransferase in healthy subjects. Gut 57: 649-654.
[19] Chrischilles EA and Wallace RB. (1993) Nonsteroidal anti-inflammatory drugs and blood pressure in an elderly population. J Gerontol 48: M91-M96.
[20] Wilson SL and Poulter NR. (2006) The effect of non-steroidal anti-inflammatory drugs and other commonly used non-narcotic analgesics on blood pressure level in adults. J Hypertens 24: 1457-1469.
[21] Forman JP et al. (2005) Non-narcotic analgesic dose and risk of incident hypertension in US women. Hypertension 46: 500-507.
[22] Forman JP et al. (2007) Frequency of analgesic use and risk of hypertension among men. Arch Intern Med 167: 394-399.
[23] Pavlicević I et al. (2008) Interaction between antihypertensives and NSAIDs in primary care: a controlled trial. Can J Clin Pharmacol 5: e372-e382.
[24] Radack et al. (1987) Ibuprofen interferes with the efficacy of antihypertensive drugs. A randomized, doubleblind, placebo-controlled trial of ibuprofen compared with acetaminophen. Ann Intern Med 107: 628-635.
[25] MacDonald TM et al. (2010) The effects of lumiracoxib 100 mg once daily vs. ibuprofen 600 mg three times daily on the blood pressure profiles of hypertensive osteoarthritis patients taking different classes of antihypertensive agents. Int J Clin Pract 64: 746-755.
[26] Johnson J und Weinryb J (2006) Safe pharmacologic treatment strategies for osteoarthritis pain in African Americans with hypertension, and renal and cardiac disease. J Natl Med Assoc 98: 1126-1135.
[27] Morrison A et al. (2007) Systematic review of trials of the effect of continued use of oral nonselective NSAIDs on blood pressure and hypertension. Curr Med Res Opin 23: 2395-2404.
[28] Chalmers JP et al. (1984) Effects of indomethacin, sulindac, naproxen, aspirin, and acetaminophen in treated hypertensive patients. Clin Exp Hypertens A6: 1077-1093.
[29] Sudano I et al. (2010) Acetaminophen increases blood pressure in patients with coronary artery disease. Circulation 122: 1789-1796.
[30] Chan AT et al. (2006) Nonsteroidal anti-inflammatory drugs, acetaminophen, and the risk of cardiovascular events. Circulation 113: 1578-1587.
[31] Laine L. (2006) GI risk and risk factors of NSAIDs. J Cardiovasc Pharmacol 47 (Suppl 1): S60-S66
[32] Cryer B and Feldman M (2002) Comparison of effects of celecoxib, rofecoxib, naproxen and acetaminophen on gastric COX inhibition (abstract). Am J Gastroenterol 97(suppl 9): S57.
[33] Hinz B et al. (2008) Acetaminophen (paracetamol) is a selective cyclooxygenase-2 inhibitor in man. FASEB J. 22: 383-390.
[34] Garcia Rodriguez LA and Hernandez-Diaz S. (2001a) Relative risk of upper gastrointestinal complications among users of acetaminophen and nonsteroidal anti-inflammatory drugs. Epidemiology 12: 570–576.
[35] Rahme E et al. (2008) Hospitalizations for upper and lower GI events associated with traditional NSAIDs and acetaminophen. Am J Gastroenterol 103: 872 – 882.
[36] Garcia Rodriguez LA and Hernandez-Diaz S. (2001 b) The risk of upper gastrointestinal complications associated with nonsteroidal anti-inflammatory drugs, glucocorticoids, acetaminophen, and combinations of these agents. Arthritis Resorption 3: 98-101.
[37] González-Pérez A und Rodríguez LA (2006) Upper gastrointestinal complications among users of paracetamol. Basic Clin Pharmacol Toxicol 98: 297-303.
[38] Nielsen OH et al. (2006) Systematic review: coxibs, non-steroidal anti-inflammatory drugs or no cyclooxygenase inhibitors in gastroenterological high-risk patients? Aliment Pharmacol Ther 23: 27-33.
[39] Black RA and Hill DA (2003) Over-the-counter medications in pregnancy. Am Fam Physician 67: 2517-24
[40] Jensen MS et al. (2010) Maternal use of acetaminophen, ibuprofen, and acetylsalicylic acid during pregnancy and risk of cryptorchism. Epidemiology 21: 779-785.
[41] Kristensen DM et al. (2011) Intrauterine exposure to mild analgesics is a risk factor for development of male reproductive disorders in human and rat. Hum Reprod 26(1):235-44.
[42] Reel JR et al. (1992) Reproductive toxicity evaluation of acetaminophen in Swiss CD-1 mice using a continuous breeding protocol. Fundam Appl Toxicol 18: 233-9.
[43] Burdan F (2002) Effects of prenatal exposure to combination of acetaminophen, isopropylantipyrine and caffeine on intrauterine development in rats. Hum Exp Toxicol 21: 25-31.
[44] Burdan F (2003) Intrauterine growth retardation and lack of teratogenic effects of prenatal exposure to the combination of paracetamol and caffeine in Wistar rats. Reprod Toxicol 17: 51-58.
[45] Jaqueson A et al. (1984) Effects of daily high doses of paracetamol given orally during spermatogenesis in the rat testis. Arch Toxicol Suppl 7: 164-6.
[46] Placke ME et al. (1987) Extrahepatic lesions induced by acetaminophen in the mouse. Toxicol Pathol 15: 381-7.
[47] Wiger R et al. (1995) Effects of acetaminophen and hydroxyurea on spermatogenesis and sperm chromatin structure in laboratory mice. Reprod Toxicol 9: 21-33.
[48] Li DK et al. (2003) Exposure to non-steroidal anti-inflammatory drugs during pregnancy and risk of miscarriage: population based cohort study. BMJ 327: 368-70.
[49] Heinonen OP et al. (1977) Birth defects and drugs in pregnancy. Publishing Sciences Group, Littleton. 286-95.
[50] Thulstrup AM et al. (1999) Fetal growth and adverse birth outcomes in women receiving prescriptions for acetaminophen during pregnancy. EuroMap Study Group. Am J Perinatol 16: 321-6.
[51] Pastore LM et al. (1999) Risk of stillbirth from medications, illnesses and medical procedures. Paediatr Perinat Epidemiol 13: 421-430.
[52] Cleves MA et al. (2004) Maternal use of acetaminophen and nonsteroidal anti-inflammatory drugs (NSAIDs), and muscular ventricular septal defects. Birth defects Research (Part A) 70: 107-113.
[53] Werler MM et al. (2003) Epidemiologic analysis of maternal factors and amniotic band defects. Birth Defect Research (Part A) 67: 68-72.
[54] Rebordosa C et al. (2008) Pre-natal exposure to paracetamol and risk of wheezing and asthma in children: a birth cohort study. Int J Epidemiol 37: 583-590.
[55] Aselton P et al. (1985) First-trimester drug use and congenital disorders. Obstet Gynecol 65: 451-5.
[56] Shaw GM et al. (1998) Maternal illness, including fever, and medication use as risk factors for neural tube defects. Teratology 57: 1-7.
[57] Feldkamp ML et al. (2010) Acetaminophen use in pregnancy and risk of birth defects: findings from the National Birth Defects Prevention Study. Obstet Gynecol 115: 109-115.
[58] McElhatton PR et al. (1997) Paracetamol overdosage in pregnancy. Analysis of the outcomes of 300 cases referred to the teratology information service. Reprod Toxicol 11: 85-94.
[59] Koniman R et al. (2007) A matched patient-sibling study on the usage of paracetamol and the subsequent development of allergy and asthma. Pediatr Allergy Immunol 18: 128-134.
[60] Beasley R et al. (2008) Association between paracetamol use in infancy and childhood, and risk of asthma, rhinoconjunctivitis, and eczema in children aged 6–7 years: analysis from Phase Three of the ISAAC programme. Lancet 372: 1039–48 (2008).
[61] Rebordosa C et al. (2008) Pre-natal exposure to paracetamol and risk of wheezing and asthma in children: a birth cohort study. Int J Epidemiol 37: 583–90.
[62] Etminan M et al. (2009) Acetaminophen use and the risk of asthma in children and adults. Chest 136: 1316–1323.
[63] Garcia-Marcos L et al. (2009) Is the effect of prenatal paracetamol exposure on wheezing in preschool children modified by asthma in the mother? Int Arch Allergy Immunol 149: 33–37.
[64] Perzanowski MS et al. (2010) Prenatal acetaminophen exposure and risk of wheeze at age 5 years in an urban low income cohort. Thorax 65: 118–23.
[65] Scialli AR et al. (2010) Childhood asthma and use during pregnancy of acetaminophen. A critical review. Reprod Toxicol 30: 508-519.
[66] Busse WW et al. (2010) Role of viral respiratory infections in asthma and asthma exacerbations. Lancet 376: 826-834.
[67] Risnes KR et al. (2011) Antibiotic exposure by 6 months and asthma and allergy at 6 years: Findings in a cohort of 1,401 US children. Am J Epidemiol. 173: 310-8.
[68] Schnabel E und Heinrich J (2010) LISA Study Group. Respiratory tract infections and not paracetamol medication during infancy are associated with asthma development in childhood. J Allergy Clin Immunol. 126(5): 1071-3.
[69] Persky V et al. (2008) Prenatal exposure to acetaminophen and respiratory symptoms in the first year of life. Ann Allergy Asthma Immunol 101: 271–8.
[70] Kang EM et al. (2009) Prenatal exposure to acetaminophen and asthma in children. Obstet Gynecol 114: 1295–306.
[71] Beasley R (2008 b): http://podcast.thelancet.com/audio/lancet/2008/9643_20september.mp3
[72] Cryer B and Feldman M (2002) Comparison of effects of celecoxib, rofecoxib, naproxen and acetaminophen on gastric COX inhibition (abstract). Am J Gastroenterol 97(suppl 9): S57.
Autoren
Dr. rer. nat. Maren Kops
Meisenweg 15, 52078 Aachen
Dr. med. Wolfgang E. Paulus
Institut für Reproduktionstoxikologie
KH St. Elisabeth
(Akademisches Lehrkrankenhaus der Universität Ulm)
Elisabethenstraße 17, 88212 Ravensburg
Prof. Dr. med. Konrad Heintze,
apl. Prof. Dr. med Karl-Uwe Petersen
an der Medizinischen Fakultät der
RWTH Aachen
Wendlingweg 2,
52057 Aachen
Autorenerklärung Die Publikation wurde auflagenfrei von bene-Arzneimittel unterstützt.





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.