
- DAZ.online
- News
- Politik
- „Mäßig innovativ, ...
TK-Innovationsreport
„Mäßig innovativ, aber extrem kostenintensiv“
Berlin - 16.09.2020, 10:30 Uhr

TK-Chef Jens Baas: „Wir fallen auf die Preismechanismen der Pharmaindustrie rein.“ (Foto: TK)
Es ist erst ein paar Jahre her, da sorgte das Hepatitis-C-Arzneimittel Sovaldi mit einem Preis von fast 20.000 Euro pro Packung für Aufregung. Mittlerweile sind fünfstellige Preise bei neuen Arzneimitteln keine Seltenheit mehr. Derzeit gilt Zolgensma als teuerstes Arzneimittel der Welt – doch auch schon das 2017 eingeführte Spinraza kommt auf fast 100.000 Euro. Für TK-Chef Jens Baas ist klar: Es muss wieder über Arzneimittelpreise gesprochen werden. Selbst bei echten Innovationen seien die nach wie vor von der Industrie „aufgedrücken“ Preise nicht nachvollziehbar.
Seit bald zehn Jahren wirkt das Arzneimittelmarkt-Neuordnungsgesetz (AMNOG) – das Gesetz, das sich erstmals die Preise patentgeschützter Arzneimittel vorknöpfte. Es war die Geburtsstunde der frühen Nutzenbewertung und der Erstattungspreisverhandlungen. Das AMNOG und die wirtschaftlich gute Lage, die sich auch bei den Krankenkassen bemerkbar machte, führten dazu, dass die zuvor geführte Dauerdebatte um zu hohe Arzneimittelpreise in den letzten Jahren stark in den Hintergrund rückte.
Der Vorstandsvorsitzende der Techniker Krankenkasse (TK), Jens Baas, bedauert, dass die Zeit nicht genutzt wurde. Denn nun schmelzen die Rücklagen der Kassen – und das Thema ist angesichts von Hochpreisern wie Zolgensma® oder auch Spinraza® wieder hochaktuell. Bei der Vorstellung des TK-Innovationsreports 2020 am heutigen Dienstag in Berlin sagte Baas, er rechne damit, dass es bald wieder neue Zwangsrabatte geben wird. Das sei zwar ein ungezielter „Schrotschuss“ – aber er verschaffe Zeit, eine Lösung des Problems auf gesellschaftlicher und politischer Ebene zu finden.
Was ist die Gesellschaft bereit zu zahlen?
Baas stellt nicht in Abrede, dass es wirklich innovative Arzneimittel gibt – nicht zuletzt die beiden bereits genannten gegen Spinale Muskelatrophie (SMA). Und er gesteht den Pharmafirmen auch zu, dass sie Gewinn machen wollten – aber wie hoch darf der sein? Laut Baas machte Biogen mit Spinzara® bereits 4 Milliarden Euro Gewinn, Novartis mit Zolgensma® 2,5 Milliarden.
Auch wenn es seit einigen Jahren die Preisverhandlungen gibt, ist es doch die Industrie, die den Aufschlag macht und einen Vergleichspreis präsentiert, sofern es einen solchen überhaupt gibt – bei Orphan Drugs haben die Unternehmen freie Hand. „Wir lassen uns deren Prämissen aufdrücken“, so Baas. Das Problem ist, dass wir es hier nicht mit einem „normalen Markt“ zu tun haben. Das Arzneimittel, das der Arzt für den Patienten verordnet, muss keiner von beiden zahlen, sondern ein Dritter. Allerdings: Es ist auch nicht „die Krankenkasse“, die zahlt, sondern die Solidargemeinschaft. Daher muss aus Baas‘ Sicht die Diskussion über Arzneimittelpreise auch auf gesellschaftlicher Ebene geführt werden: Was ist die Gesellschaft bereit zu zahlen – beispielsweise für ein Arzneimittel, das dafür sorgt, dass ein an SMA erkranktes Kind laufen lernen wird?
Professor Gerd Glaeske von der Universität Bremen und Herausgeber des TK-Innovationsreports würde überdies gerne mehr darüber wissen, wie die Preise überhaupt zustande kommen. Forschung und Entwicklung sind es wohl eher nicht. Der Trend bei großen Firmen geht eher dahin, Start-ups mit vielversprechenden Molekülen aufzukaufen, wenn die klinischen Studien bereits durch sind. So war es auch im Fall von Zolgensma®. Glaeske vermisst hier Transparenz, Daten, die Entscheidungen nachvollziehbar machen.
Wie steht es um die Innovationskraft der Neueinführungen?
Und zu welchen Erkenntnissen kommt nun der TK-Innovationsreport? Baas‘ Kurzfazit lautet: „Mäßig innovativ, aber extrem kostenintensiv“. Der Report 2020 bewertet 31 Präparate, die im Jahr 2017 neu auf den deutschen Arzneimittelmarkt gekommen sind. Mit Cladribin und Dimethylfumarat sind zwei bekannte Wirkstoffe in neuen Indikationen berücksichtigt. Betrachtet man die Indikationen, haben zahlenmäßig Krebsarzneimittel die Nase vorn. Zehn antineoplastische Mittel nimmt der Report unter die Lupe. Am zweithäufigsten folgen immunsuppressive Wirkstoffe (sieben). Zudem ist festzustellen, dass 14 Arzneimittel Biologika sind und acht Orphan-Drug-Status haben. Vier Wirkstoffe kamen im Rahmen eines beschleunigten Zulassungsverfahrens auf den Markt (Avelumab, Cenegermin, Nusinersen und Obeticholsäure).
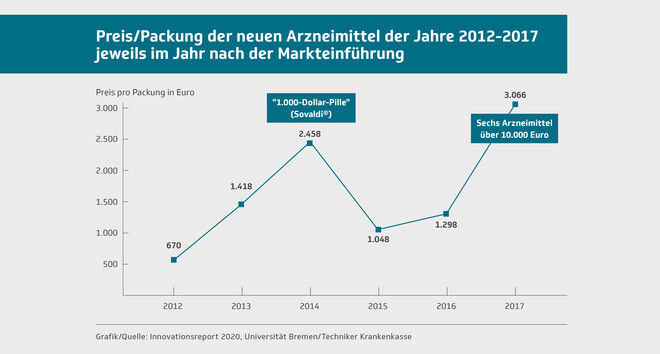
Allein diese 31 Arzneimittel sorgten im Jahr 2018 bei der TK für Ausgaben von 178,4 Millionen Euro. Der durchschnittliche Packungspreis stieg im Vergleich zum Vorjahr um knapp 140 Prozent auf 3.066 Euro – obwohl die Menge der verordneten Packungen mit 58.200 um 45 Prozent gegenüber dem Vorjahr zurückging. Hauptverantwortlich dafür waren laut TK neben Spinraza®, dem ersten Arzneimittel in der Geschichte des Reports mit sechsstelligem Packungspreis (mittlerweile liegt er laut Lauer-Taxe leicht darunter), fünf Arzneimittel, für die je Packung fünfstellige Preise fällig werden.
Acht grüne Ampeln, sieben gelbe, 16 rote
Doch wie steht es sonst um die Innovationskraft der neuen Substanzen? Wie haben sie sich im Versorgungsalltag bewährt? Wie leuchten die für den TK-Report bekannten Ampeln? Die Autoren verwenden hier ein System, das drei Aspekte berücksichtigt: Gibt es schon Therapien auf dem Gebiet? Hat das Arzneimittel einen Zusatznutzen gegenüber der Vergleichstherapie? Und ist es teurer als diese? Anhand dieser Kriterien wird ein Gesamtscore gebildet, wobei die Kostenfrage bei Orphan Drugs ausgespart wird. Insgesamt erhielten acht der neuen Arzneimittel (26 %) die Bestnote: die grüne Gesamtampel. Sieben (23 %) bekamen ein „gelb“ – aber für 16 und damit mehr als die Hälfte leuchtete die rote Gesamtampel.
Über die grüne Ampel können sich vier Arzneimittel gegen Leukämie freuen (Inotuzumab Ozogamicin, Midostaurin, Venetoclax). Eines der bestbewerteten Präparate kommt beim Bronchialkarzinom zum Einsatz (Alectinib), zwei bei Psoriasis (Ixekizumab, Guselkumab), eins bei Neurodermitis (Dupilumab) – und auch Nusinersen zur Behandlung der SMA konnte trotz seines hohen Preises, der bei dem Orphan Drug ohnehin nicht in die Wertung einfloss, mit seinem Nutzen überzeugen.
Glaeske forderte auch in diesem Jahr wieder eine obligatorische Spätbewertung von neuen Arzneimitteln. Denn viele Wirkungen zeigen sich erst später. So wurden zu den 31 Neueinführungen mittlerweile fünf Rote-Hand-Briefe und fünf Blaue-Hand- Informationen veröffentlicht. Er kritisierte zudem, dass sich die Pharmaunternehmen bei ihren Neueinführungen vor allem auf Arzneimittel konzentrieren, die viel Gewinn versprechen. Antibiotika oder gegen Demenz eingesetzte Neurologika, die man dringend bräuchte, seien dagegen auf dem Rückzug, obwohl der Bedarf hier riesig sei.





















1 Kommentar
Schuld
von Reinhard Rodiger am 16.09.2020 um 11:34 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
Das Kommentieren ist aktuell nicht möglich.