
- DAZ.online
- News
- Pharmazie
- FDA zu Ranitidin: Je ä...
Endgültiges Aus durch Nitrosamin-Verunreinigung?
FDA zu Ranitidin: Je älter das Präparat, desto höher der NDMA-Gehalt
Stuttgart - 06.04.2020, 10:14 Uhr
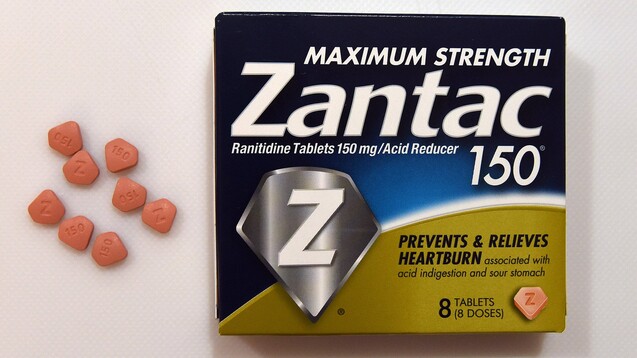
Nicht nur das Original Zantac, auch alle Ranitidin-Generika werden in den USA vom Markt genommen. (t/Foto: imago images / ZUMA Press)
In den USA hat die Arzneimittelbehörde FDA am 1. April mit sofortiger Wirkung Hersteller zur Marktrücknahme aller Ranitidin-Präparate aufgefordert. Der Grund: Die FDA bestätigt nun, was bereits von anderen Laboren vermutet worden war. Die Menge an der Nitrosaminverunreinigung NDMA in Ranitidin steigt mit der Lagerdauer und Temperatur – und wird somit zu einem unkalkulierbaren Risiko.
Auch wenn es in Deutschland und Europa bislang keinen vollumfänglichen Marktrückruf für Ranitidin-Präparate gibt, ein Blick in die CEP-Datenbank (Certificate of Suitability of Monographs of the European Pharmacopoeia) des EDQM (Europäisches Direktorat für die Qualität von Arzneimitteln) zeigt, dass kein Wirkstoffhersteller mehr über ein CEP für Ranitidin verfügt. (Zur Erinnerung: Ein CEP belegt, dass eine Monographie des Europäischen Arzneibuchs geeignet ist, die Qualität eines Wirkstoffs angemessen zu prüfen.) Auch ein Blick in die Lieferengpassliste des BfArM (Bundesinstitut für Arzneimittel und Medizinprodukte) verrät, dass es zahlreiche Ranitidin-Lieferengpässe gibt.
Mehr zum Thema
Prämedikation in der Tumortherapie
Ranitidin fehlt – oder doch nicht?
Schon früh war auch von Seiten des BfArMs darauf hingewiesen worden, dass verschiedene Arzneimittel, die im gleichen Indikationsgebiet wie Ranitidin eingesetzt werden können, als Alternativen zur Verfügung stehen. Es dürfte also nicht mehr viele Patienten in Deutschland geben, die weiterhin Ranitidin einnehmen.
Dieses Szenario ist auch in Deutschland die Folge der Untersuchungen einer US-Versand-Apotheke mit angeschlossenem Labor: „Valisure“ hatte bei eigenen Analysen im Oktober vergangenen Jahres – als Folge des weltweiten Valsartan-Skandals im Sommer 2018 – Nitrosamin-Verunreinigungen im Magensäureblocker Ranitidin (in den USA Zantac und Generika) entdeckt und daraufhin per „citizen petition“ (Bürgerantrag) die FDA dazu aufgefordert, die Präparate zurückzurufen.

Valisure, FDA, EMA und Health Canada
NDMA in Ranitidin: Verunreinigt beim Hersteller oder vom Wirkstoff selbst?
Allerdings kamen die immens hohen von Valisure gefundenen Mengen von bis zu 3mg NDMA durch die (Temperatur-)Bedingungen während der Analyse zustande. Die FDA forderte daher die Hersteller lediglich auf, alle Chargen zu testen und die, die einen bestimmten NDMA-Grenzwert überschreiten, zurückzuhalten. Die Behörde verwies dabei auf eine Analysemethode, die den Abbau von Ranitidin während der Analyse und somit auch die NDMA-Bildung verringern soll.
Einige Hersteller riefen daraufhin freiwillig ihre Ware zurück, während Valisure auch auf kritische Nachfrage gegenüber DAZ.online weiterhin betonte, dass es sich bei Ranitidin wahrscheinlich um kein Problem bei der Herstellung handle, sondern dass der Wirkstoff selbst instabil ist und NDMA bilden kann.

NDMA entsteht bei Wärme
Sollte Ranitidin besser in den Kühlschrank?
Sodann schaltete sich auch ein anderes Labor namens Emery Pharma ein. Dessen Analysen hätten ergeben, dass der NDMA-Gehalt oft erst ansteigt, wenn die Packungen die Fabrik lange verlassen haben. Nämlich dann, wenn Ranitidin beim Transport oder der Lagerung hohen Temperaturen ausgesetzt wird. Und das passiert nach Ansicht des Labors regelmäßig, wenn es beispielsweise in die Südstaaten der USA, den mittleren Osten, Südostasien oder andere warme Gegenden transportiert wird. Emery Pharma hatte deswegen ebenfalls eine „citizen petition“ erstellt und forderte verschiedene Maßnahmen: So sollten beispielsweise alle im Handel befindlichen Packungen zurückgerufen und gesperrt werden.
Sowohl auf den Bürgerantrag von Valisure als auch den von Emery hat die FDA nun mit der Marktrücknahme von Ranitidin in der USA geantwortet.
Wird es jemals wieder Ranitidin in den USA geben?
So erklärt die FDA ihre Entscheidung: „Die Behörde hat festgestellt, dass sich die Menge an Verunreinigung in manchen Ranitidin-Präparaten über die Zeit – und bei Lagerung über der Raumtemperatur – erhöht. Das kann zu für den Verbraucher unakzeptabel hohen Werten der Verunreinigung führen. Als Folge dieser sofortigen Marktrücknahme werden Ranitidin-Produkte in den USA weder für neue oder bestehende Verschreibungen noch für die rezeptfreie Verwendung verfügbar sein.“
Janet Woodcock, M.D., Direktorin des Zentrums für Arzneimittelbewertung und -forschung der FDA, erklärte außerdem: „Wir haben nicht in vielen Präparaten, die wir getestet haben, unakzeptable Werte an NDMA gefunden. Da wir aber nicht wissen, wie und für wie lange die Präparate gelagert werden, haben wir entschieden, dass Ranitidin für Verbraucher und Patienten nicht erhältlich sein sollte – sofern nicht seine Qualität sichergestellt werden kann.“
Die FDA betont in ihren Erläuterungen, dass sich die NDMA-Werte in Ranitidin-Präparaten auch unter normalen Lagerbedingungen erhöhen. Die Temperatur beschleunigt die Bildung offenbar zusätzlich signifikant. Je älter ein Präparat also sei, desto höher sei der NDMA-Gehalt.
Mehr zum Thema

Keine Nitrosamin-Bildung im Magenmilieu
Ranitidin: FDA hat erhöhte NDMA-Werte veröffentlicht
Die FDA rät nun auch Patienten in der Selbstmedikation dazu, Präparate, die sie bereits erworben haben, zu entsorgen und keine neuen zu kaufen. Wer Ranitidin auf Verschreibung einnimmt, soll mit seinem Arzt sprechen, bevor das Arzneimittel abgesetzt wird. Dabei erinnert die FDA daran, dass es genügend alternative Therapie-Optionen gibt.
Offenbar schließt die FDA allerdings (noch) nicht aus, dass Ranitidin irgendwann wieder auf den Markt zurückkehren könnte: „Falls eine Firma mit wissenschaftlichen Daten belegen kann, dass ihr Ranitidin-Präparat stabil ist und dass die NDMA-Werte nicht mit der Zeit auf unsichere Werte ansteigen, wird die FDA in Betracht ziehen, zu erlauben, Ranitidin wieder auf den Markt zu bringen.“
Auf die Frage, wie lange NDMA bereits in Ranitidin enthalten gewesen ist, antwortet die FDA allerdings nur, dass ihr dazu keine wissenschaftlichen Daten vorliegen. Zudem stellt sie auch die Ursachensuche noch nicht als abgeschlossen dar.





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.