
- DAZ.online
- News
- Pharmazie
- Wegen NDMA: Kein ...
Rote-Hand-Brief zu Ranitidin
Wegen NDMA: Kein Ranitidin bei Zollinger-Ellison-Syndrom
Stuttgart - 11.11.2019, 17:00 Uhr
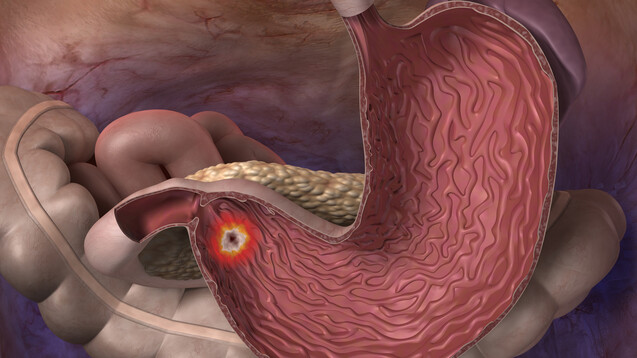
Die exzessive Gastrin-Sekretion beim Zollinger-Ellison-Syndrom führt zu rezidivierenden Ulzerationen des Magens, Duodenums und Jejunums, sowie unbehandelt zu oberen gastrointestinalen Blutungen, Diarrhö, Steatorrhö und Refluxbeschwerden. ( r / Foto: Alex / stock.adobe.com)
Die mit einem Zollinger-Ellison-Syndrom einhergehende Übersekretion von Magensäure bedarf einer lebenslangen Hochdosistherapie. Ranitidin ist in dieser Indikation zwar nicht erste Wahl, ein Einsatz war bislang aber möglich. Allerdings würde mit den auf dem Markt befindlichen Präparaten von Stada und Al, die wie andere Ranitidin-Präparate mit dem Nitrosamin NDMA veruneinigt sind, die akzeptable Aufnahmemenge für NDMA derzeit überschritten werden. Deshalb soll Ranitidin von Stada und Al bis auf weiteres nicht mehr in dieser Indikation eingesetzt werden. Das geht aus einem Rote-Hand-Brief vom vergangenen Freitag hervor.
Nach dem Valsartan-Skandal vom Sommer 2018 war im September 2019 schließlich auch im Antazidum Ranitidin eine Nitrosaminverunreinigung (NDMA) nachgewiesen worden. Von der europäischen Arzneimittelbehörde EMA wird der Fall derzeit noch geprüft. Im Oktober 2019 berichtete DAZ.online darüber, dass noch nicht alle Präparate, die das Antazidum Ranitidin als Wirkstoff enthalten, vom deutschen Markt zurückgerufen wurden. Insgesamt erscheint die Rückrufsituation (auch weltweit) eher unübersichtlich. Laut der kanadischen Arzneimittelbehörde (Health Canada) gibt es aber Hinweise, dass NDMA unabhängig vom Hersteller in allen Ranitidin-Präparaten enthalten sein kann.
Mehr zum Thema

Valisure, FDA, EMA und Health Canada
NDMA in Ranitidin: Verunreinigt beim Hersteller oder vom Wirkstoff selbst?

Nitrosamin-Spuren in Fertigarzneimitteln
Hexal: Weiterer Ranitidin-Rückruf

NDMA in Ranitidin
USA: Andere Antazida wohl frei von Nitrosaminen
In Deutschland zeigt ein Blick auf die Rückrufliste der AMK und ein Blick in die Lauer-Taxe, dass die Aliud Pharma GmbH, die Axcount Generika GmbH und die Stadapharm GmbH bislang gar nicht von den Ranitidin-Rückrufen betroffen waren. (Aliud gehört zur Stada Gruppe, Axcount zum Bristol Laboratories Ltd. Konzern). Ein Rote-Hand-Brief vom vergangenen Freitag, der am heutigen Montag auf den Seiten des BfArM (Bundesinstitut für Arzneimittel und Medizinprodukte) veröffentlicht wurde, verrät nun aber, dass auch Stada und Aliud sich intensiv mit der Nitrosamin-Problematik in Ranitidin auseinandergesetzt haben. Und so heißt es auf dem Internetauftritt des BfArM:
„Die Zulassungsinhaber Stadapharm GmbH und Aliud Pharma GmbH informieren in Abstimmung mit den zuständigen Landesüberwachungsbehörden, den Regierungspräsidien Tübingen und Darmstadt, über eine Einschränkung der Indikation für die Arzneimittel Ranitidin AL 150 und Ranitidin AL 300 sowie Ranitidin STADA 150 mg und Ranitidin STADA 300 mg.
Da für die lebenslange Hochdosistherapie des Zollinger-Ellison-Syndroms die akzeptable Aufnahmemenge für die Verunreinigung N-Nitrosodimethylamin (NDMA) überschritten würde, sollen diese Arzneimittel bis auf weiteres nicht mehr in dieser Indikation eingesetzt werden.“
Internetauftritt des BfArM
Aus toxikologischer Sicht sei gemäß Leitlinie ICH M7(R1) bei einer Therapiedauer von einem bis zehn Jahren zwar eine tägliche Aufnahme von bis zu 643 ng NDMA pro Tag noch akzeptabel, heißt es in dem Rote-Hand-Brief weiter. Dieser Wert reduziere sich aber auf 96 ng NDMA pro Tag bei lebenslanger Therapie – der Wert dürfte den meisten Apothekern aus dem Valsartan-Skandal vom Sommer 2018 bekannt sein.





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.