
- DAZ.online
- News
- Pharmazie
- PUMA-Arzneimittel: Eine ...
Melatonin, Hydrocortison & Co. für Kinder
PUMA-Arzneimittel: Eine bedrohte Spezies?
Stuttgart - 20.04.2019, 08:00 Uhr
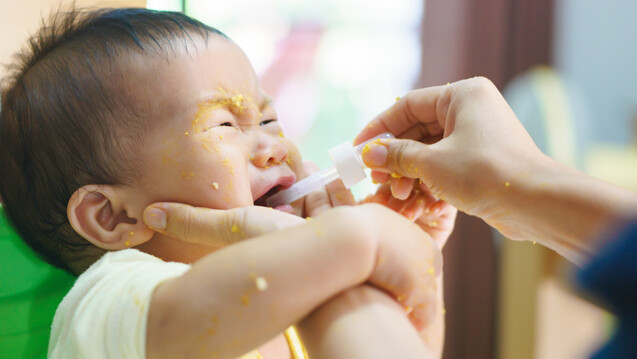
Wenn es schon beim Füttern Probleme gibt … Kinder zeigen sich bei der Arzneimitteleinnahme oft unkooperativ. (s / Foto: bonnontawat / stock.adobe.com)
Nachdem Alkindi vor circa einem halben Jahr vom Gemeinsamen Bundesausschuss keinen Zusatznutzen bescheinigt bekommen hat, droht dem ebenso speziell für Kinder entwickelten Slenyto nun ein ähnliches Schicksal – wenn der G-BA der aktuellen IQWiG-Empfehlung folgt. Werden die „intensiven Bemühungen“ der Arzneimittelhersteller zur Verbesserung der Versorgungssituation bei Kindern in Deutschland durch die Nutzenbewertung konterkariert? Das jedenfalls meint der Bundesverband der Arzneimittelhersteller. DAZ.online bietet eine Übersicht über die PUMA-Arzneimittel der letzten Jahre.
„Ein weiterer Rückschlag für PUMA-Zulassungen“, titelte der Bundesverband der Arzneimittel-Hersteller (BAH) am vergangenen Dienstag in einer Pressemitteilung. Anlass war die vom Gemeinsame Bundesausschuss (G-BA) am Montag zuvor veröffentlichte Nutzenbewertung des IQWiG (Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen) zu dem PUMA-Arzneimittel (Paediatric use marketing authorisation) Slenyto® (Melatonin).
Mehr zum Thema

PUMA: Slenyto und Kigabeq
Zulassungsempfehlung für Melatonin und Vigabatrin speziell für Kinder
„Dass einem Arzneimittel, das speziell für Kinder entwickelt wurde, wieder einmal kein Zusatznutzen zugeschrieben werden soll, ist ein weiterer Rückschlag für die PUMA-Regelung“, kommentiert Dr. Elmar Kroth, Geschäftsführer Wissenschaft beim BAH, den Sachverhalt. Denn das IQWiG kommt in seiner Bewertung zu dem Schluss, dass sich aus den vorgelegten Daten kein Anhaltspunkt für einen Zusatznutzen von Melatonin gegenüber der zweckmäßigen Vergleichstherapie ergibt. Der BAH befürchtet, dass – sollte der G-BA die Sichtweise des IQWiG bestätigen – die Therapieoption Kindern in Deutschland möglicherweise nicht mehr zur Verfügung stehen könnte: „Solche Entscheidungen führen dazu, dass speziell für Kinder entwickelte Arzneimittel unwirtschaftlich werden. Damit könnte Deutschland bei innovativen Kinderarzneimitteln mit PUMA-Charakter in Zukunft leer ausgehen“, meint Kroth und denkt dabei auch an das Arzneimittel Alkindi®, dem der G-BA erst vor einem knappen halben Jahr keinen Zusatznutzen bescheinigte.
Zusatznutzen durch die Einstufung als PUMA bereits belegt?
Das hydrocortisonhaltige Arzneimittel Alkindi® wurde 2018 zugelassen und soll bei einer Nebennieren-Insuffizienz für Säuglinge, Kinder und Jugendliche bis 18 Jahre das fehlende Steroidhormon ersetzen. Die Kapseln für Kinder enthalten ein Granulat und eignen sich somit zum Öffnen. So soll eine bessere Dosierung und eine Maskierung des bitteren Geschmacks möglich sein.
Mehr zum Thema
Pharmakotherapie.blog
widmete sich im Dezember 2018 der Nutzenbewertung von Alkindi® und beleuchtete
beide Seiten der Diskussion: Während Apothekerin und Redakteurin Solvejg Langer es für „beschämend“ hielt, dass das Hydrocortison für Kinder keinen Zusatznuzten
zugesprochen bekommen hatte, schrieb Apotheker und Redakteur Dr. Stefan Fischer,
das Urteil des G-BA sei „verständlich“.
Fischer meint, den G-BA treffe keine Schuld. Was nicht bedeutet, dass er
Alkindi® nicht als sinnvoll erachtet – auch Pädiater hatten vom G-BA einen Zusatznutzen
für Alkindi® gefordert. Fischer weiß aus eigener Erfahrung, dass speziell für
Kinder entwickelte Arzneiformen sinnvoll sind, und er würde es bedauerlich
finden, würde Alkindi® vom Markt genommen werden. Dennoch meint er: „Wenn
Kinderarzneimitteln mit einer PUMA-Zulassung automatisch oder auf Basis von
Meinungen ein Zusatznutzen gewährt werden soll, muss das so wie bei Orphan
Drugs im Gesetz festgeschrieben werden. Der Handlungsbedarf liegt nicht bei der
Institution, sondern bei der Legislative.“ Denn laut Fischer gab es einfach
nicht genügend Evidenz (kleine Patientenzahl und Einarmigkeit der Studien), als dass der G-BA
hätte anders entscheiden können.
Im Grunde sind sich Stefan Fischer und Solvejg Langer in diesem Punkt auch einig, auch wenn Langer die Entscheidung des G-BA für „unnachvollziehbar“ und „kurzsichtig“ erachtet – denn Langer schreibt: „Meiner Meinung nach sollte für PUMA-Arzneimittel dasselbe gelten wie für Arzneimittel mit Orphan-Drug-Status – nämlich dass der Zusatznutzen durch die Einstufung als PUMA belegt ist.“
Mehr zum Thema

Kinderarzneimittel erfahren in Deutschland keine Sonderbehandlung
PUMAs bald vom Aussterben bedroht?
Dass der medizinische Zusatznutzen durch die Zulassung als Kinderarzneimittel bereits als belegt gilt, kommt für das Bundesministerium für Gesundheit (BMG) derzeit jedoch nicht in Frage, wie in der DAZ 15/2019 zu lesen war. So muss man wohl zunächst bei Alkindi® akzeptieren, dass für einen Zusatznutzen die Evidenz fehlt. Doch wie sieht es bei der aktuellen Diskussion um Slenyto® (Melatonin) aus?
Wenn die zweckmäßige Vergleichstherapie kein Placebo ist
Nach den Vorgaben des G-BA hätte der Zusatznutzen von Melatonin in Slenyto® gegenüber „Best supportive Care“ (BSC) als zweckmäßige Vergleichstherapie gezeigt werden müssen – in der Indikation: Behandlung von Schlafstörungen bei Kindern und Jugendlichen im Alter von zwei bis 18 Jahren mit Autismus-Spektrum-Störung und / oder Smith-Magenis-Syndrom, wenn Schlafhygienemaßnahmen unzureichend waren.
Dieser Vorgabe des G-BAs sei der pharmazeutische Unternehmer formal auch gefolgt, indem er die BSC als zweckmäßige Vergleichstherapie benennt. Allerdings betrachte der pharmazeutische Unternehmer in der Studienpraxis die BSC durch eine Placebo-Kontrolle als erfüllt. Der G-BA versteht unter der BSC aber kein Placebo, sondern „begleitende/fortführende psychotherapeutische Maßnahmen entsprechend Psychotherapieleitlinie“, die sowohl Teil des Interventionsarms als auch des Vergleicharms sein sollten.
Die vom pharmazeutischen Unternehmer herangezogene Studie (NEU_CH_7911) ist eine doppelblinde RCT, die Melatonin mit Placebo vergleicht und 125 an Schlafstörungen leidende Kinder im Alter von zwei bis 17,5 Jahren untersucht, die zuvor unzureichend auf Schlafhygienemaßnahmen angesprochen hatten (mit Autismus-Spektrum-Störung und / oder bestimmten neurogenetischen Erkrankungen).
Es ist also nicht so, dass die Kinder nie andere Behandlungsmöglichkeiten zur Verfügung hatten. Denn diejenigen, die in der Vergangenheit noch keine dokumentierte Verhaltenstherapie (Schlafhygienemaßnahmen) erhalten hatten, durchliefen vor Studienbeginn noch eine vierwöchige Basistherapie mit Schlafhygienetraining und Verhaltenstherapie.
Warum der pharmazeutische Hersteller diese Maßnahmen dann aber nicht in beiden Studienarmen fortgeführt hat, bleibt offen – vielleicht wäre das Urteil des G-BA dann anders ausgefallen. So wurde die Studie – auch aufgrund anderer Limitationen – jedenfalls nicht für die Nutzenbewertung herangezogen. Direkt vergleichbar sind die Fälle Alkindi® (gar keine Vergleichstherapie) und Slenyto® somit eher nicht.
Mehr zum Thema

Rote-Hand-Brief
Buccolam: Die durchsichtige Kappe muss weg
Seit dem 1. Januar 2011 werden alle Arzneimittel mit neuen Wirkstoffen sowie Indikationserweiterungen von Arzneimitteln, deren Wirkstoff erstmals ab 2011 in den Verkehr gebracht wurde, einer frühen Nutzenbewertung unterzogen. Buccolam® (Midazolam), das im Juni 2011 zum ersten Mal überhaupt für eine PUMA-Zulassung empfohlen wurde, erhielt jedoch noch keine Nutzenbewertung. Anders bei Hemangiol® (Propranolol), das 2014 die zweite PUMA-Zulassungsempfehlung erhielt.
|
Wirkstoff |
Darreichungsform |
Indikation |
Zusatznutzen |
|---|---|---|---|
|
Midazolam (Buccolam®) |
oromukosale Lösung |
Epilepsie (akute Krämpfe), 3 Monate bis 18 Jahre |
Nicht bewertet |
|
Propranolol hydrochlorid (Hemangiol®) |
Lösung zum Einnehmen |
Hämangiom (proliferativ), ab 5 Wochen bis 5 Monate |
ja! |
|
Glycopyrroniumbromid (Sialanar®) |
Lösung zum Einnehmen |
Sialorrhö (chronischer krankhaft gesteigerter Speichelfluss), ab 3 Jahren |
nein |
|
Hydrocortison (Alkindi®) |
Granulat in Kapsel |
Nebennieren-Insuffizienz, ab Geburt |
nein |
|
Melatonin (Slenyto®) |
Retardtabletten |
Schlafstörungen bei Autismus-Spektrum-Störungen, ab 2 Jahren |
nein? |
|
Vigabatrin (Kigabeq®) |
soll als lösliche Tablette erhältlich sein, die sich in weiteren 50-mg-Schritten teilen und so an das Körpergewicht anpassen lässt |
West-Syndrom, auch bekannt als BNS-Epilepsie (Blitz-Nick-Salaam) und bei Kindern im Lebensalter von 1 Monat bis 7 Jahre, die an resistenter fokaler Epilepsie leiden |
hat 2018 die Zulassung erhalten und soll in Deutschland am 1. Juli 2019 auf den Markt kommen |
In einer Liste des Verbands der Forschenden Arzneimittelhersteller e.V. (vfa) vom 25. März 2019 finden sich Zulassungen und Zulassungserweiterungen für Arzneimittel oder Applikationshilfen für Kinder und Jugendliche seit 2001. Die oben in der Tabelle (chronologisch) aufgeführten Präparate verfügen über eine PUMA-Zulassung (patentfreies, speziell für Kinder entwickeltes Produkt).
Die anderen PUMA-Arzneimittel: Es geht auch anders, oder?
Hemangiol® war der erste Wirkstoff, dem im Rahmen der frühen Nutzenbewertung erstmalig ein erheblicher Zusatznutzen attestiert wurde – und das zweite PUMA-Arzneimittel überhaupt. Zudem einigte man sich bei Hemangiol® noch vor Ablauf des ersten Jahres nach Markteintritt – in dem der Hersteller den Preis noch selbst festlegen kann – auf einen Erstattungsbetrag.
Dem dritten PUMA-Arzneimittel Sialanar® (Glycopyrroniumbromid gegen chronischen krankhaft gesteigerten Speichelfluss) wurde 2018 schließlich aber kein Zusatznutzen anerkannt. Auch dort machte wieder die Vergleichstherapie Probleme: In keiner der drei vorgelegten Studien sei die zweckmäßige Vergleichstherapie, wie beispielsweise die funktionelle Dysphagietherapie, umgesetzt worden.
Mehr zum Thema
Seit 2007 ist in Europa die sogenannte Kinderarzneimittel-Verordnung in Kraft. Die Tatsache, dass bis dahin mehr als 50 Prozent der bei Kindern eingesetzten Arzneimittel nicht an Kindern geprüft und für Kinder zugelassen waren, war laut Bundesinstitut für Arzneimittel und Medizinprodukte der Grund für eine solche Verordnung: Seit Juli 2008 muss für jedes neu zuzulassende Arzneimittel ein pädiatrisches Prüfkonzept vorgelegt werden – außer bei Generika, Arzneimitteln mit mindestens zehnjähriger allgemeiner medizinischer Verwendung in der EU („Well Established Use"), Homöopathika und traditionellen pflanzlichen Arzneimitteln sowie vergleichbaren biologische Arzneimitteln (Biosimilars). Außerdem gibt es eine neue Form der Arzneimittelzulassung, eben für die oben besprochenen PUMA-Arzneimittel. Es handelt sich um eine zusätzliche Genehmigung für Arzneimittel, die bereits für Erwachsene zugelassen sind und für die eine weitere Zulassung ausschließlich für die Verwendung in der pädiatrischen Bevölkerung beantragt wird. PUMA steht für „Paediatric use marketing authorisation“.
Mehr zum Thema

BPI zu Kinderarzneimitteln
PUMAs sollen es leichter haben
Ob Deutschland in Zukunft „bei innovativen Kinderarzneimitteln mit PUMA-Charakter leer ausgehen“ könnte, wie es in der Pressemitteilung des BAH heißt, weil ihnen kein Zusatznutzen zugesprochen wird und speziell für Kinder entwickelte Arzneimittel so unwirtschaftlich werden, bleibt abzuwarten. Denn wie in der DAZ 15/2019 zu lesen war, spielt zumindest der Hersteller Diurnal von Alkindi® nicht mit dem Gedanken, Alkindi® in Deutschland vom Markt zu nehmen.



















1 Kommentar
Kigabeq
von Dr Schweikert-Wehner am 20.04.2019 um 10:36 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
Das Kommentieren ist aktuell nicht möglich.