
- DAZ.online
- News
- Pharmazie
- PUMA-Arzneimittel: Eine ...
Melatonin, Hydrocortison & Co. für Kinder
PUMA-Arzneimittel: Eine bedrohte Spezies?
Stuttgart - 20.04.2019, 08:00 Uhr
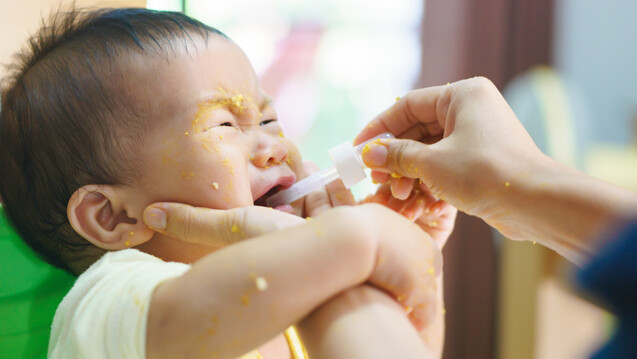
Wenn es schon beim Füttern Probleme gibt … Kinder zeigen sich bei der Arzneimitteleinnahme oft unkooperativ. (s / Foto: bonnontawat / stock.adobe.com)
Die anderen PUMA-Arzneimittel: Es geht auch anders, oder?
Hemangiol® war der erste Wirkstoff, dem im Rahmen der frühen Nutzenbewertung erstmalig ein erheblicher Zusatznutzen attestiert wurde – und das zweite PUMA-Arzneimittel überhaupt. Zudem einigte man sich bei Hemangiol® noch vor Ablauf des ersten Jahres nach Markteintritt – in dem der Hersteller den Preis noch selbst festlegen kann – auf einen Erstattungsbetrag.
Dem dritten PUMA-Arzneimittel Sialanar® (Glycopyrroniumbromid gegen chronischen krankhaft gesteigerten Speichelfluss) wurde 2018 schließlich aber kein Zusatznutzen anerkannt. Auch dort machte wieder die Vergleichstherapie Probleme: In keiner der drei vorgelegten Studien sei die zweckmäßige Vergleichstherapie, wie beispielsweise die funktionelle Dysphagietherapie, umgesetzt worden.
Mehr zum Thema
Seit 2007 ist in Europa die sogenannte Kinderarzneimittel-Verordnung in Kraft. Die Tatsache, dass bis dahin mehr als 50 Prozent der bei Kindern eingesetzten Arzneimittel nicht an Kindern geprüft und für Kinder zugelassen waren, war laut Bundesinstitut für Arzneimittel und Medizinprodukte der Grund für eine solche Verordnung: Seit Juli 2008 muss für jedes neu zuzulassende Arzneimittel ein pädiatrisches Prüfkonzept vorgelegt werden – außer bei Generika, Arzneimitteln mit mindestens zehnjähriger allgemeiner medizinischer Verwendung in der EU („Well Established Use"), Homöopathika und traditionellen pflanzlichen Arzneimitteln sowie vergleichbaren biologische Arzneimitteln (Biosimilars). Außerdem gibt es eine neue Form der Arzneimittelzulassung, eben für die oben besprochenen PUMA-Arzneimittel. Es handelt sich um eine zusätzliche Genehmigung für Arzneimittel, die bereits für Erwachsene zugelassen sind und für die eine weitere Zulassung ausschließlich für die Verwendung in der pädiatrischen Bevölkerung beantragt wird. PUMA steht für „Paediatric use marketing authorisation“.
Mehr zum Thema

BPI zu Kinderarzneimitteln
PUMAs sollen es leichter haben
Ob Deutschland in Zukunft „bei innovativen Kinderarzneimitteln mit PUMA-Charakter leer ausgehen“ könnte, wie es in der Pressemitteilung des BAH heißt, weil ihnen kein Zusatznutzen zugesprochen wird und speziell für Kinder entwickelte Arzneimittel so unwirtschaftlich werden, bleibt abzuwarten. Denn wie in der DAZ 15/2019 zu lesen war, spielt zumindest der Hersteller Diurnal von Alkindi® nicht mit dem Gedanken, Alkindi® in Deutschland vom Markt zu nehmen.



















1 Kommentar
Kigabeq
von Dr Schweikert-Wehner am 20.04.2019 um 10:36 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
Das Kommentieren ist aktuell nicht möglich.