
- DAZ.online
- DAZ / AZ
- DAZ 8/2023
- Stahl, Strahl, Chemie...
Onkologie
Stahl, Strahl, Chemie – oder Abwarten?
Zu den Therapieoptionen nach einer Prostatakrebsdiagnose
Prostatakarzinom, diese Diagnose erhalten jährlich 60.000 bis 70.000 Männer in Deutschland [1]. Das Karzinom der Vorsteherdrüse stellt mit diesen Zahlen die häufigste Krebsart bei Männern dar. Dabei steigt die Zahl der Erkrankungen mit dem Alter zunehmend an. Vor dem 50. Lebensjahr wird die Diagnose selten gestellt, das mittlere Erkrankungsalter betrug 2016 72 Jahre. In den nächsten Jahren und Jahrzehnten ist bedingt durch die demografische Entwicklung damit zu rechnen, dass die Fallzahlen steigen werden. Neben dem Risikofaktor Alter erhöht außerdem eine positive Familienanamnese das Risiko, selbst an Prostatakrebs zu erkranken [2]. Auch verschiedene Risikogene sind mittlerweile identifiziert, z. B. Mutationen der BRCA1- und BRCA2-Gene, die auch bei Brustkrebs eine Rolle spielen. Zu den weiteren möglichen Risikofaktoren, die diskutiert werden, zählen das metabolische Syndrom, Diabetes, Übergewicht, Ernährung, lokale Entzündungen (z. B. nach sexuell übertragbaren Erkrankungen) und Adipositas [3]. Eine Testosteron-Substitution, z. B. bei Hypogonadismus, erhöht das Risiko dem aktuellen Kenntnisstand nach nicht [4].
Prävention durch gesunden Lebensstil
Gezielte Präventionsstrategien gegen den Prostatakrebs existieren zwar nicht, doch kann man mit einem gesunden Lebensstil Krebserkrankungen allgemein und damit auch Prostatakrebs vorbeugen. Die American Cancer Society empfiehlt, ein gesundes Körpergewicht zu halten, körperlich aktiv zu sein (150 bis 300 Minuten mittlere oder 75 bis 100 Minuten starke körperliche Aktivität pro Woche) und eine gesunde Ernährung mit nährstoffreichen, pflanzlichen Nahrungsmitteln, wenig Fleisch und wenig hochverarbeiteten Lebensmitteln. Alkohol sollte vermieden, oder zumindest auf bis zu zwei Getränke pro Tag reduziert werden [5]. Pharmakotherapeutisch ließ sich zwar mit Finasterid dem Prostate Cancer Prevention Trial zufolge das Risiko für Prostatakarzinome verringern, jedoch nicht die Mortalität [6]. Da gesunde Männer therapiert würden, wird der DHT-Reduktasehemmer angesichts möglicher Nebenwirkungen nicht zur Prävention des Prostatakrebs empfohlen [3].
Tasten oder Testen?
Umso wichtiger sind deshalb regelmäßige Vorsorgeuntersuchungen. In Deutschland bezahlen die gesetzlichen Krankenkassen einmal pro Jahr die digitale rektale Untersuchung, also die Tastuntersuchung der Prostata für Männer über 45 Jahren. Der Nutzen dieser Untersuchung ist allerdings umstritten, werden so nur ein Drittel aller Tumore erkannt. Als individuelle Gesundheitsleistung (iGeL) wird außerdem der PSA-Test empfohlen, den die Patienten aber selber bezahlen müssen. Dabei wird das Prostataspezifische Antigen PSA bestimmt, das vom Drüsenepithel produziert wird und bei erhöhten Werten auf ein bösartiges Krankheitsgeschehen hinweisen kann. Als auffällig gelten Werte altersabhängig über 2,5 bis 4 ng/ml. Zu den iGeL-Leistungen zählt das Verfahren nicht umsonst, denn das Nutzen-Risiko-Verhältnis ist gleichfalls unsicher. Zwar ermittelte die ERSPC-Studie, dass das relative Risiko, an Prostatakrebs zu sterben mit dem Screening signifikant um 27% reduziert wurde, auf der anderen Seite steht aber eine hohe Zahl von falsch-positiven Ergebnissen (20%) und eine hohe Rate an Überdiagnosen von 40% [7]. Diese betreffen Karzinome, die in der Lebenszeit der Patienten nie auffällig geworden wären und nicht zum Tod geführt hätten. Die Überdiagnosen sorgen bei Betroffenen nicht nur für Sorgen und Ängste, sondern auch dazu, dass möglicherweise Therapien eingeleitet werden, deren Nebenwirkungen die Lebensqualität stark einschränken können.
Symptome oft erst spät
Das liegt nicht zuletzt daran, dass viele Geschwüre in die Low-Risk-Kategorie fallen und nur langsam wachsen. Deshalb bleiben die Karzinome auch lange Zeit symptomlos. Erst im fortgeschrittenen Stadium können z. B. Blasenentleerungsstörungen, Blut im Urin oder Schmerzen durch Metastasen auftreten. Besteht der Verdacht auf ein Prostatakarzinom, so wird die Diagnose mittels Stanzbiopsie verifiziert. Bei positivem Befund erfolgt dann das Staging des Karzinoms anhand verschiedener Scores. Die TNM-Klassifizierung der Union for International Cancer Control beschreibt zum einen die lokale Ausdehnung des Tumors (T), einen möglichen Lymphknotenbefall (N) und Metastasen (M). Anhand der ermittelten Ausdehnung kann man das Karzinom dann in die Stadien „lokal begrenztes Prostatakarzinom“, „lokal fortgeschrittenes Karzinom“ (ein Geschwür, das sich über die Prostatakapsel hinaus ausgedehnt hat) und „fortgeschrittenes bzw. metastasiertes Prostatakarzinom“ einteilen (s. Tab. 1). Der Gleason-Score charakterisiert zusätzlich die Beschaffenheit der Drüsen im Gewebe der Stanzbiopsie oder der entfernten Prostata. Je weniger differenzierter diese sind, umso höher der Score und umso schlechter die Prognose. Dafür vergeben die Histologen Werte zwischen 6 und 10. Grundsätzlich stellen fortgeschrittene und metastasierte Tumore Hochrisiko-Tumore dar. Für lokal begrenzte Karzinome kann anhand der Zusammenschau von TNM-Klassifizierung, Gleason-Score und PSA-Wert das Risikoprofil/Progressionsrisiko abgeschätzt werden [8]:
- niedriges Risiko: PSA ≤ 10 ng/ml und Gleason-Score 6 und T1c bis T2a
- mittleres Risiko: PSA > 10 bis 20 ng/ml oder Gleason-Score 7 oder T2b
- hohes Risiko: PSA > 20 ng/ml oder Gleason-Score ≥ 8 oder T2c StadiumAusdehnung Tumor (T)Lymphknotenbefall (N)Metastasen (M)lokal begrenztes ProstatakarzinomT1nicht tastbarer TumorN0–M0–T1aT ≤ 5% des resezierten GewebesN0–M0–T1bT > 5% des resezierten GewebesN0–M0–T1cNachweis in StanzbiopsieN0–M0–T2T tastbar und auf Prostata beschränktN0–M0–T2aT ≤ 50% eines SeitenlappensN0–M0–T2bT > 50% eines SeitenlappensN0–M0–T2cT in beiden SeitenlappenN0–M0–lokal fortgeschrittenes ProstatakarzinomT3T-Wachstum außerhalb ProstataN0–M0–T3aT-Gewebe außerhalb ProstataN0–M0–T3bInfiltration SamenblasenN0–M0–T4Infiltration NachbarorganeN0–M0–fortgeschrittenes bzw. metastasiertes Prostatakarzinomjedes TumorstadiumN1LymphknotenbefallM0–jedes TumorstadiumN1LymphknotenbefallM1Metastasierung
Abwarten als Alternative
Zu welcher Therapie nach der Diagnose gegriffen wird, hängt nicht nur vom Stadium des Karzinoms ab, auch Patientenparameter wie das Alter bzw. die Lebenserwartung und gegebenenfalls vorhandene Komorbiditäten fließen in die Entscheidungsfindung ein. Gerade bei Tumoren niedrigen Risikos stellt sich aber die Frage, ob der Chirurg oder Strahlenmediziner überhaupt aktiv werden muss. Low-risk-Prostatakarzinome wachsen in den meisten Fällen relativ langsam und bereiten wenig Beschwerden. Dagegen abgewogen werden müssen hingegen die Risiken eines Eingriffs: Inkontinenz, Erektionsstörungen sowie Dickdarm- und Enddarmbeschwerden können nach der Therapie auftreten. Ein wichtiger Anhaltspunkt für die Entscheidung für eine Therapie oder die sogenannte aktive Überwachung (Active Surveillance) bietet das Alter. Die meisten Leitlinien definieren eine verbleibende Lebenserwartung von mindestens zehn Jahren in solchen Fällen als Grenze, ab der eine kurative Therapie überhaupt Sinn ergibt [3, 9]. So soll auch der Übertherapie von Karzinomen, die durch Vorsorgeuntersuchungen entdeckt werden, entgegengewirkt werden. In regelmäßigen Abständen werden dann die PSA-Werte weiter bestimmt und die Prostata abgetastet. Psychisch ist das Abwarten für die Patienten nicht immer einfach zu bewältigen, Ängste und Unsicherheit können die Lebensqualität belasten [10, 11].
Eine andere abwartende Strategie besteht im sogenannten Watchful Waiting, dem kontrollierten Zuwarten. Der Unterschied zur aktiven Überwachung liegt im palliativen Charakter der Maßnahme. Geheilt werden soll der Krebs nicht mehr. Ziel ist es, die Lebensqualität zu erhalten, um die letzten Lebensjahre nicht mit den Nebenwirkungen einer Therapie zu belasten. Besonders bei alten Patienten bzw. Patienten mit schwerwiegenden Begleiterkrankungen und einer Lebenserwartung von unter zehn Jahren, kann dieser Ansatz gewählt werden, prinzipiell bei allen Stadien der Erkrankung. Im Gegensatz zum aktiven Abwarten entfallen die regelmäßigen Vorsorgeuntersuchungen. Stattdessen wird nur bei aufkommenden Symptomen gehandelt. Die einzige mögliche Therapie, die diskutiert werden kann, ist eine sofortige medikamentöse Hormonablation.
Testosteron als Ansatzpunkt
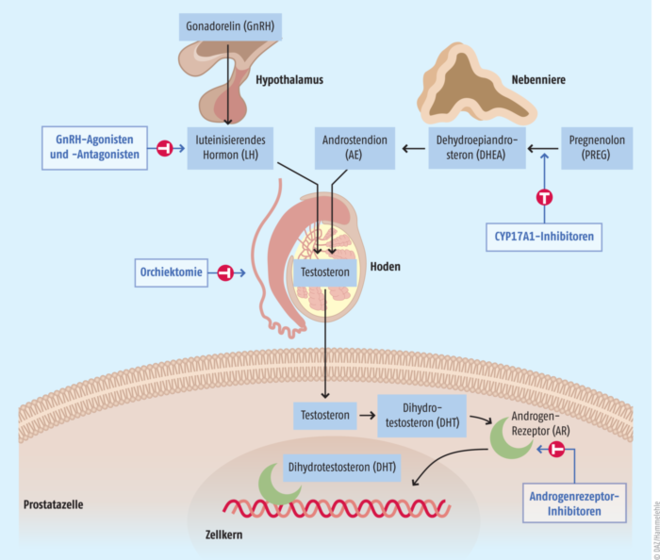
Eine solche Hormontherapie (auch Androgen-Deprivation, chemische Kastration) kann generell in verschiedenen Stadien der Erkrankung zum Einsatz kommen. Da die Tumorzellen für ihr Wachstum auf Testosteron angewiesen sind, sollen mit dieser Therapie die Werte des Hormons im Blut unter 50 ng/dl abgesenkt werden (bzw. unter 20 ng/dl nach neueren Standards). Konventionell werden im Rahmen dieser pharmakotherapeutischen Intervention Gonadorelin-(GnRH)-Agonisten (z. B Buserelin [Profact®], Goserelin [Zoladex®]), GnRH-Antagonisten (z. B. Degarelix [Firmagon®
]) und nichtsteroidale Androgenrezeptor-Antagonisten (z. B. Flutamid [Fluta-Cell®], Bicalutamid [Casodex®]) verordnet (s. Tab. 2 und Abb.). Die Chirurgische Alternative besteht in der bilateralen Orchiektomie, einer beidseitigen Entfernung der Hoden. Diese Operation wird heutzutage seltener vorgenommen. Der Eingriff ins Hormonsystem, sei es mit Medikamenten oder Chirurgie, bleibt nicht ohne Nebenwirkungen: Hitzewallungen, Libidoverlust, Erektionsstörungen, Gynäkomastie, Muskelschwund, verringerte Knochendichte und Anämie gehören zu den unerwünschten Wirkungen [3].
Klasse | Wirkstoff mit Indikation | Anwendung |
|---|---|---|
Androgen-Deprivation | ||
GnRH-Agonist | Buserelin (Profact®) fortgeschrittenes hormonsensitives Prostatakarzinom | nasal 1,2 mg täglich entspricht sechsmal zwei Sprühstöße gleichmäßig über den Tag verteilt |
Implantat alle zwei Monate 6,3 mg oder alle drei Monate 9,45 mg | ||
Goserelin (Zoladex®) fortgeschrittenes Prostatakarzinom | Implantat alle 28 Tage 3,6 mg oder alle 3 Monate 10,8 mg | |
Leuprorelin (Eligard) fortgeschrittenes hormonsensitives Prostatakarzinom | Depotinjektion jeden Monat 7,5 mg alle drei Monate 22,5 mg alle sechs Monate 45 mg | |
Triptorelin (Pamorelin®) fortgeschrittenes oder metastasiertes hormonabhängiges Prostatakarzinom | Depotinjektion jeden Monat 3,75 mg alle drei Monate 11,25 mg alle sechs Monate 22,5 mg | |
GnRH-Antagonist | Degarelix (Firmagon®) fortgeschrittenes hormonabhängiges Prostatakarzinom | Depotinjektion 240 mg Startdosis jeden Monat 80 mg zur Erhaltung |
nichtsteroidale Androgenrezeptor-Antagonisten (erste Generation) | Bicalutamid (Casodex®) (lokal) fortgeschrittenes Prostatakarzinom | Filmtabletten 50 mg/Tag + GnRH-Agonist oder Orchiektomie bzw. 150 mg/Tag allein |
Flutamid (Fluta-Cell®) fortgeschrittenes Prostatakarzinom | Tabletten dreimal 250 mg täglich | |
nichtsteroidale Androgenrezeptor-Antagonisten(zweite Generation) | Apalutamid (Erleada®) nmCRPC, mHSPC | Filmtabletten 240 mg täglich |
Darolutamid (Nubeqa®) nmCRPC | Filmtabletten zweimal 600 mg täglich | |
Enzalutamid (Xtandi™) mHSPC, nmCRPC, mCRPC | Filmtabletten 160 mg täglich | |
CYP17A1-Inhibitor | Abirateron (Zytiga®) mHSPC, mCRPC | Filmtabletten 1000 mg täglich |
Chemotherapie | ||
Taxan | Docetaxel (Taxotere®) mHSPC, mCRPC | Infusion alle drei Wochen 75 mg/m2 alle drei Wochen in sechs Zyklen + 10 mg Prednisolon täglich |
Cabazitaxel (Jevtana®) mCRPC | Infusion 25 mg/m2 alle drei Wochen + 10 mg Prednisolon täglich | |
PARP(Poly-ADP-Ribose-Polymerase)-Inhibitor | Olaparib (Lynparza®) fortgeschrittenes Prostatakarzinom mit BRCA1/2-Mutation | Filmtabletten zweimal 300 mg täglich |
Radionuklidtherapie | ||
Radionuklid | Radium223 (Xofigo®) mCRCP | Injektion sechsmal 55 kBq alle vier Wochen |
Abb.: Angriffspunkte der Hormontherapie Die länger und stärker als Gonadorelin (GnRH) wirkenden GnRH-Agonisten binden an die GnRH-Rezeptoren in der Hypophyse und bewirken zunächst, dass mehr Luteinisierendes Hormon (LH) freigesetzt wird. Da die Analoga im Gegensatz zum natürlichen Hormon kontinuierlich und nicht pulsatil freigesetzt werden, kommt es zur Downregulation der Rezeptoren in der Hypophyse. Die körpereigene LH- und damit Testosteron(T)-Sekretion wird so unterbunden. Die initial stimulierte Hormonfreisetzung kann das Tumorwachstum stimulieren. Deshalb besteht die Möglichkeit, anfangs parallel Gonadorelin-Antagonisten einzusetzen, die diesen Flare-Up verhindern. Auch als alleinige Deprivationstherapie können die Antagonisten eingesetzt werden. Der CYP17A1-Inhibitor Abirateron hemmt die Testosteron-Synthese aus Pregnenolon (PREG) über die Zwischenstufen DHEA und Andronstendion (AE) in Hoden, Prostata und Nebenniere. Androgenrezeptor-Antagonisten der ersten und zweiten Generation hemmen den zytosolischen Androgenrezeptor (AR) und damit das Ablesen von Testosteron-gesteuerten Genen.
Radikale Prostatektomie
Sind die Voraussetzungen für eine Überwachung nicht (z. B. bei einer erwarteten Lebenserwartung von mehr als zehn Jahren) oder nicht mehr gegeben (z. B. bei einer sinkenden PSA-Verdopplungszeit während der aktiven Überwachung), so muss ein kurativer Behandlungsansatz verfolgt werden. Eine der Möglichkeiten, die dann diskutiert wird, ist die radikale Prostatektomie, also die komplette chirurgische Entfernung der Prostata. Bei lokal begrenzten Tumoren kann der Patient so geheilt werden. Ziel der Operation ist es nicht nur, die Prostata zu entfernen, sondern gleichzeitig möglichst die Kontinenz und gegebenenfalls auch die Erektionsfähigkeit zu erhalten. Der Operateur muss dabei mit äußerster Vorsicht vorgehen, damit die direkt entlang der Prostata verlaufenden Nervenstränge, die den Penis innervieren, nicht verletzt werden. Meist glückt dies aber nur bei Karzinomen im frühen Stadium, da ansonsten das Risiko für eine sogenannte R1-Resektion besteht, das heißt, dass kleine Tumoranteile im Resektionsrand verbleiben können [3]. Weitere Risiken der Operation bestehen unter anderem in starken Blutungen oder rektalen Verletzungen [3].
Bestrahlung von innen und außen
Als weitere mögliche Therapieform kommt die Bestrahlung infrage. Die Strahlung kann von außen, perkutan, mittels intensitätsmodulierter Strahlentherapie (IMRT) unter gleichzeitiger Bildgebung erfolgen. Dabei wird der Linearbeschleuniger um den Patienten bewegt und das Strahlungsfeld so moduliert, dass das umliegende Gewebe bestmöglich geschont wird. Bestrahlt wird über sieben bis acht Wochen mit einer Dosis von 74 bis 80 Gy. Eine zusätzliche Androgen-Deprivation über sechs bis 36 Monate ist bei Tumoren des mittleren und höheren Risikos indiziert.
Die Strahlung kann aber auch mittels Brachytherapie von innen erfolgen (griech. brachys = kurz, nah). Dabei werden kleine Strahlenquellen, sogenannte Seeds, direkt in der Prostata platziert, entweder als Low-Dose-Rate- oder High-Dose-Rate-Therapie (LDR/HDR). Bei dem Verfahren der geringen Dosisrate werden schwach aktive Seeds mit kurzer Halbwertzeit (z. B. 125I) in die Prostata eingebracht [12]. Die Strahlung des Nuklids hat nur eine kurze Reichweite und setzt damit vor allem den Tumor hoher Strahlung aus und verschont das gesunde Gewebe. Die Seeds verbleiben in der Regel für immer in der Prostata, die Strahlung klingt aber schon nach einigen Wochen ab. Beim Hochdosisraten-Verfahren werden andere Strahlenquellen verwendet, z. B. 192Ir. Aufgrund der höheren Strahlungsintensität werden die Strahlungsquellen in mehreren Sitzungen nur kurz, für Minuten, in die Prostata eingebracht und dann wieder entfernt [12]. Beide Verfahren werden unter örtlicher Betäubung oder Vollnarkose durchgeführt. Die Low-Dose-Rate-Therapie soll als Monotherapie nur bei Niedrigrisiko-Tumoren eingesetzt werden, die Hochdosistherapie ist für lokal begrenzte Tumore höheren Risikos vorgesehen, in Kombination mit perkutaner Bestrahlung. Eine zusätzliche Androgen-Deprivation kann im Einzelfall erwogen werden [3]. Das Nebenwirkungsspektrum der Strahlentherapie unterscheidet sich von dem der radikalen Prostatektomie [3]: Eine erektile Dysfunktion tritt z. B. mit Bestrahlung seltener auf, ebenso wie Harninkontinenz und Harnverhalten. Enddarmbeschwerden, z. B. Diarrhö bzw. rektale Blutungen dafür häufiger. Am besten schneidet in diesem Gesichtspunkt noch die Low-Dose-Rate-Therapie ab. Radiotherapien können außerdem Fatigue verursachen und bergen das Risiko für Zweitmalignome.
Verfügbare Therapien grundsätzlich gleichwertig
Gerade in Anbetracht der vermehrten Diagnosen von Tumoren niedrigen und mittleren Risikos im Rahmen der Früherkennung stellt sich nicht nur die Frage, ob überhaupt therapiert oder lieber abgewartet werden sollte, sondern auch, welche Therapieform langfristig den meisten Erfolg verspricht. Schließlich haben die Patienten oft noch viele Lebensjahre vor sich.
Kürzlich berichteten spanische Forscher neue Daten zu dieser Frage [13]. In einer nicht-randomisierten Kohortenstudie beobachteten die Autoren 704 Patienten mit lokalisiertem Prostatakrebs niedrigen bis intermediären Risikos nach radikaler Prostatektomie, perkutaner Bestrahlung oder Niedrigdosis-Brachytherapie über zehn Jahre und werteten die Mortalitätszahlen sowie die Inzidenz eines biochemischen Rezidivs aus, also dem Wiederanstieg des PSA-Werts nach der Intervention (s. u.). Im Punkt Gesamtmortalität waren die beiden Strahlentherapien der Prostatektomie nicht unterlegen, jedoch entwickelte sich nach Brachytherapie (Hazard Ratio: 1,93; p = 0,004) oder perkutaner Bestrahlung (Hazard Ratio 2,56; p < 0,001) häufiger ein biochemisches Rezidiv.
Die randomisierte ProtecT-Studie aus dem Jahr 2016 untersuchte außerdem prospektiv das Outcome der aktiven Überwachung, der Prostatektomie oder perkutanen Bestrahlung bei lokalem Prostatakrebs niedrigen bzw. mittleren Risikos von 1643 Patienten nach zehn Jahren [14]. Bezüglich der Gesamtmortalität unterschieden sich die Behandlungsansätze nicht. Auch das Prostatakrebs-spezifische Überleben betrug in allen Studienarmen mindestens 98,8 Prozent. Bei der aktiven Überwachung traten vermehrt Metastasen auf (33 Fälle) im Vergleich zur Prostatektomie (13 Fälle) oder Bestrahlung (16 Fälle). Die Autoren der S3-Leitlinie urteilen insgesamt, dass die verfügbaren Behandlungsoptionen grundsätzlich gleichwertig sind [3].
Multimodale Therapie des lokal fortgeschrittenen Geschwürs
Auch für das lokal fortgeschrittene Karzinom stellen die radikale Prostatektomie und die perkutane Strahlentherapie geeignete Therapieverfahren dar. Arzt und Patient müssen die Vor- und Nachteile individuell abwägen [3]. Bei einer Prostatektomie besteht im fortgeschrittenen Stadium grundsätzlich das Risiko, dass tumorpositive Resektionsränder zurückbleiben können. Das Risiko für Inkontinenz und Erektionsstörungen ist meist höher. Wird die Prostata entfernt, kann das Tumorstadium aber genauer festgestellt werden, was die Entscheidung über eine gegebenenfalls adjuvante Therapie, z. B. eine Strahlentherapie oder hormonablative Therapie, erleichtert. Die Strahlentherapie wird in der Regel in Kombination mit einer Androgen-Deprivation über mindestens 24, besser 36 Monate durchgeführt [3]. Auch eine HDR-Brachytherapie kann die perkutane Strahlentherapie ergänzen. Sind die Lymphknoten befallen, so können sie operativ entfernt oder bestrahlt werden. Der Stellenwert dieser Verfahren kann allerdings aufgrund der schlechten Studienlage nicht festgestellt werden [3].
PSA-Wert markiert biochemisches Rezidiv
Nach der erfolgreichen Therapie des Prostatakarzinoms wird im Rahmen der Krebsnachsorge weiterhin regelmäßig der PSA-Wert bestimmt. Im Gegensatz zur Vorsorge ist der Nutzen des Wertes in der Nachsorge gesichert. Steigen die Werte an, so gilt dies als erstes Zeichen, dass die Krankheit fortschreitet. Man spricht von einem sogenannten biochemischen Rezidiv, wenn der PSA-Wert nach radikaler Prostatektomie in mindestens zwei Messungen über 0,2 ng/ml liegt, bzw. nach Strahlentherapie in zwei Messungen 2 ng/ml über dem tiefsten postinterventionellen Wert [3]. Ein PSA-Rezidiv bedeutet aber nicht immer, dass therapeutische Maßnahmen ergriffen werden müssen, denn auch das Rezidiv verläuft oft langsam. Patienten mit einer langen PSA-Verdopplungszeit von über zwölf Monaten und einem Gleason-Score unter 8 kommen für eine abwartende Strategie infrage [3].
Gehen die Ärzte andererseits von einem behandlungsbedürftigen Lokalrezidiv aus, so wird die passende Behandlung abhängig vom Therapieverfahren des initialen Tumors ausgewählt. Ein PSA-Rezidiv nach radikaler Prostatektomie wird mit einer perkutanen Salvage-Strahlentherapie behandelt (Salvage, engl. Rettung), gegebenenfalls in Kombination mit einer Androgen-Deprivation, z. B. bei Hochrisiko-Tumoren (PSA vor SRT > 0,7 ng/ml) oder ungünstigen prognostischen Kriterien [3]. Bei initial bestrahlten Patienten stellt die Salvage-Prostatektomie eine mögliche, aufgrund des strahlungsgeschädigten Gewebes aber herausfordernde Therapieoption dar [3].
Neue Antiandrogene und Chemo bei fortgeschrittener Erkrankung
Die herkömmliche Form der hormonablativen Therapie wirkt nicht für immer. Mit der Zeit sorgen Veränderungen und Mutationen in der Androgen-Signalkaskade dazu, dass der Tumor trotz der supprimierten Testosteron-Spiegel proliferieren kann. Man spricht dann vom kastrationsresistenten Prostatakarzinom. Seit einigen Jahren stehen auch für Patienten mit dieser Form des Prostatakrebs antiandrogene Behandlungsalternativen zur Verfügung (s. Tab. 2). Die nichtsteroidalen Androgenrezeptorantagonisten der zweiten Generation, Apalutamid (Erleada®), Darolutamid (Nubeqa®) und Enzalutamid (Xtandi™) verlängerten den Studien SPARTAN, ARAMIS und PROSPER zufolge bei nichtmetastasiertem kastrationsresistentem Prostatakrebs das (metastasenfreie) Überleben der Patienten um über 20 Monate [15, 16, 17]. Der Testosteron-Synthese-Hemmer Abirateron (Zytiga®) und der Androgenantagonist Enzalutamid verlängerten außerdem das progressionsfreie Überleben bei metastasiertem kastrationsresistentem Prostatakarzinom [18, 19].
Grund für die Wirkung auch gegen kastrationsresistente Krankheitsstadien, liegt in der verbesserten Affinität dieser Second-Generation-Androgenrezeptorantagonisten zum Androgenrezeptor gegenüber z. B. Flutamid oder Bicalutamid [20]. Außerdem inhibieren die Vertreter der zweiten Generation die Translokation des Androgenrezeptors in den Zellkern [20]. Abirateron auf der anderen Seite präsentiert einen komplett neuen Wirkansatz. Das Molekül inhibiert die in Hoden, Prostata und Nebenniere exprimierte Steroid-17α-Hydroxylase (CYP17A1), welche an der Produktion von Testosteron beteiligt ist (s. Abb.) [20]. Da das Enzym auch die Synthese des körpereigenen Cortisols vermittelt, sinken die Cortisol-Spiegel ab. Um einen reflektorischen Anstieg von Mineralocorticoiden zu verhindern und damit verbunden Hypertonie, Flüssigkeitsretention und Hyperkaliämie, wird Abirateron nur zusammen mit Prednison oder Prednisolon verordnet (5 bis 10 mg). Grundsätzlich wird trotz Gabe der neueren Wirkstoffe die bereits eingeleitete herkömmliche Androgen-Deprivation weiter aufrechterhalten.
Sobald der Prostatakrebs nicht geheilt werden konnte und Metastasen gestreut hat, bzw. ein metastasierter Prostatakrebs neu diagnostiziert wurde, ist die Krankheit nicht mehr heilbar. Die neueren Antiandrogene Apalutamid, Enzulatamid sowie der Testosteron-Synthesehemmer Abirateron können aber die Progression verzögern. In Kombination mit einer herkömmlichen Androgen-Deprivation verlängerten sie das progressionsfreie Überleben bzw. das Gesamtüberleben bei hormonsensitivem metastasiertem Prostatakarzinom signifikant [21, 22, 23, 24]. Ein weiterer Kombinationspartner für die Androgen-Deprivationstherapie bei metastasiertem hormonsensitivem Prostatakrebs mit hoher Metastasenlast ist das Zytostatikum Docetaxel (in Kombination mit Prednisolon), wie die CHAARTED-Studie zeigen konnte [25]. Die Teilnehmer überlebten mit dem Taxan im Schnitt 51,1 Monate im Vergleich zu den 34,4 Monaten, die Teilnehmer mit alleiniger Androgen-Deprivation überlebten (Hazard Ratio: 0,63; p < 0,001). Patienten mit geringerer Tumorlast profitierten hingegen nicht.
Bei Patienten mit metastasiertem kastrationsresistentem Prostatakrebs sind Abirateron, Enzalutamid und Docetaxel wirksame Kandidaten, um das Leben zu verlängern [3]. Jedoch hängt das Vorgehen davon ab, welcher der Wirkstoffe schon in der Vortherapie verwendet wurde. Nach einer Therapie mit Docetaxel kommt auch eine Therapie mit dem Taxan Cabazitaxel (Jevtana®) infrage. Eine weitere Therapieoption bietet außerdem Prednisolon, das nicht nur Tumorschmerzen und Appetitlosigkeit lindert, sondern auch die PSA-Werte und damit womöglich die Progression reduzieren kann [3].
Als Drittlinien-Therapie kann, wenn alle geeigneten Alternativen ausgeschöpft wurden, auch eine Radionuklidtherapie angeboten werden, z. B. Radium223 (Xofigo®), wenn Knochenmetastasen vorhanden sind, (aber keine viszeralen Metastasen). Können Mutationen in den BRCA1- und BRCA2-Tumorsuppressorgenen nachgewiesen werden, stellt zudem der PARP-Inhbitior Olaparib (Lynparza®) eine Behandlungsoption dar [3]. |
Literatur
[1] Krebs in Deutschland für 2017/2018. Robert Koch-Institut (RKI) und Gesellschaft der epidemiologischer Krebsregister in Deutschland (GEKID), 13. Ausgabe 2021
[2] Johns LE, Houlston RS. A systematic review and meta-analysis of familial prostate cancer risk. BJU Int 2003;91:789-794
[3] Prostatakarzinom. S3-Leitlinie, Hrsg. Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF), AWMF-Registernummer: 043/022O, Stand Oktober 2021, www.awmf.org/leitlinien
[4] Boyle P et al. Endogenous and exogenous testosterone and the risk of prostate cancer and increased prostate-specific antigen (PSA) level: a meta-analysis. BJU Int 2016;118:731-741
[5] Rock Cl et al. American Cancer Society guideline for diet and physical activity for cancer prevention. CA Cancer J Clin 2020;70:245-271
[6] Thompson IA et al. The influence of finasteride on the development of prostate cancer. N Engl J Med 2003;349:215-224
[7] Schröder FT et al. The European Randomized Study of Screening for Prostate Cancer – Prostate Cancer Mortality at 13 Years of Follow-up. Lancet 2014;384:2027-2035
[8] D’Amico AV et al. Biochemical Outcome After Radical Prostatectomy, External Beam Radiation Therapy, or Interstitial Radiation Therapy for Clinically Localized Prostate Cancer. JAMA 1998;280:969–974
[9] Mottet N et al. Guidelines on Prostate Cancer. European Association of Urology Guidelines Office 2022
[10] Dale W et al. The role of anxiety in prostate carcinoma: a structured review of the literature. Cancer 2005;104:467-478
[11] Kronenwetter C et al. A qualitative analysis of interviews of men with early stage prostate cancer: the Prostate Cancer Lifestyle Trial. Cancer Nurs 2005;28:99-107
[12] Zaorsky NG et al. The evolution of brachytherapy for prostate cancer. Nat Rev Urol 2017;14:415-439
[13] Suárez JF et al. Mortality and biochemical recurrence after surgery, brachytherapy, or external radiotherapy for localized prostate cancer: a 10-year follow-up cohort study. Sci Rep 2022;12:12589
[14] Hamdy FC et al. 10-Year Outcomes after Monitoring, Surgery, or Radiotherapy for Localized Prostate Cancer. N Engl J Med 2016;375:1415-1424
[15] Smith MR et al. Apalutamide Treatment and Metastasis-free Survival in Prostate Cancer. N Engl J Med 2018;378:1408-1418
[16] Fizazi K et al. Darolutamide in Nonmetastatic, Castration-Resistant Prostate Cancer. N Engl J Med 2019;380:1235-1246
[17] Sternberg CN et al. Enzalutamide and Survival in Nonmetastatic, Castration-Resistant Prostate Cancer. N Engl J Med 2020;382:2197-2206
[18] Ryan CJ et al. Abiraterone in metastatic prostate cancer without previous chemotherapy. N Engl J Med 2013;368:138-148
[19] Beer TM et al. Enzalutamide in metastatic prostate cancer before chemotherapy. N Engl J Med 2014;371:424-433
[20] Desai K et al. Hormonal Therapy for Prostate Cancer. Endocr Rev 2021;42:354-373
[21] Chi KN et al. Apalutamide for Metastatic, Castration-Sensitive Prostate Cancer. N Engl J Med 2019;381:13-24
[22] Armstrong AJ et al. ARCHES: A Randomized, Phase III Study of Androgen Deprivation Therapy With Enzalutamide or Placebo in Men With Metastatic Hormone-Sensitive Prostate Cancer. J Clin Oncol 2019;37:2974-2986
[23] Fizazi K et al. Abiraterone plus Prednisone in Metastatic, Castration-Sensitive Prostate Cancer. N Engl J Med 2017;377:352-360
[24] James ND et al. Abiraterone for Prostate Cancer Not Previously Treated with Hormone Therapy. N Engl J Med 2017;377:338-351
[25] Kyriakopoulos CE et al. Chemohormonal Therapy in Metastatic Hormone-Sensitive Prostate Cancer: Long-Term Survival Analysis of the Randomized Phase III E3805 CHAARTED Trial. J Clin Oncol 2018;36:1080-1087























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.