
- DAZ.online
- DAZ / AZ
- DAZ 8/2023
- Eisiges Verknäulen
Medizin
Eisiges Verknäulen
Wie bei der Kälteagglutinin-Krankheit durch niedrige Temperaturen Erythrozyten verklumpen
Eine Anämie bezeichnet einen Zustand mit verminderter Erythrozytenzahl oder unzureichender Sauerstofftransportkapazität, der sich klinisch als niedriger Hämoglobinwert manifestiert. Ursächlich können eine verringerte Bildung, die Zerstörung oder der Verlust von Erythrozyten durch Blutungen dahinterstecken [1]. Der Mangel an roten Blutkörperchen durch einen vorzeitigen Zerfall zählt zu den hämolytischen Anämien. Bevor der physiologische Abbau nach einer Lebensdauer von etwa 120 Tagen erfolgt, werden die Erythrozyten hierbei hauptsächlich in Leber und Milz (extravasal) oder im Gefäßkreislauf (intravasal) zerstört [2]. Sind dafür Autoantikörper verantwortlich, nennt sich diese Form autoimmunhämolytische Anämie. Das Immunsystem bildet in dem Fall Antikörper, die sich gegen die Erythrozyten richten und deren Hämolyse induzieren. Man unterscheidet zwei verschiedene Autoantikörper: Wärmeantikörper, die Erythrozyten bei 37 °C angreifen und Kälteantikörper, die bei niedrigerer Temperatur an die roten Blutkörperchen binden und diese agglutinieren (= verkleben, verklumpen). Mischformen, bei der beide Antikörper vorkommen, sind möglich.
Kälteantikörper verklumpen Erythrozyten
Bei der Kälteagglutinin-Krankheit führen Kälteantikörper zu einer Agglutination und anschließender Komplement-induzierter Hämolyse von Erythrozyten [3].
Kälteantikörper (auch Kälteagglutinine genannt) sind überwiegend IgM-Antikörper, die von B-Zellen produziert werden und sich gegen Antigene auf der Erythrozytenoberfläche richten. Die optimale Bindungstemperatur liegt bei 0 bis 4 °C [4]. Kälteantikörper kommen in geringem Maße auch bei gesunden Menschen vor [5], die physiologische Funktion bleibt jedoch bislang ungeklärt. Wissenschaftler vermuten, dass sie „Überreste eines primitiven Wirbeltierimmunsystems“ darstellen [4]. In geringer Konzentration besitzen die Kälteantikörper keine klinische Relevanz [5].
Erhöhte Titer von IgM-Antikörpern mit kleiner thermischer Amplitude, wie sie bei Erkrankten vorkommen, benötigen keine tiefen Temperaturen nahe dem Gefrierpunkt. In der akralen Zirkulation z. B. in Händen und Füßen binden sie an Erythrozyten und induzieren die Agglutination [6]. Da die Antikörper-Antigen-Interaktion auf Wasserstoffbrückenbindungen und Van-der-Waals-Kräften beruht, ist die Bindungswahrscheinlichkeit umso höher, je stärker sich die Bluttemperatur und damit auch die Brownsche Molekularbewegung reduziert. Das erklärt die Kälteaktivität der Antikörper [7].
Die Komplementkaskade führt zur Hämolyse
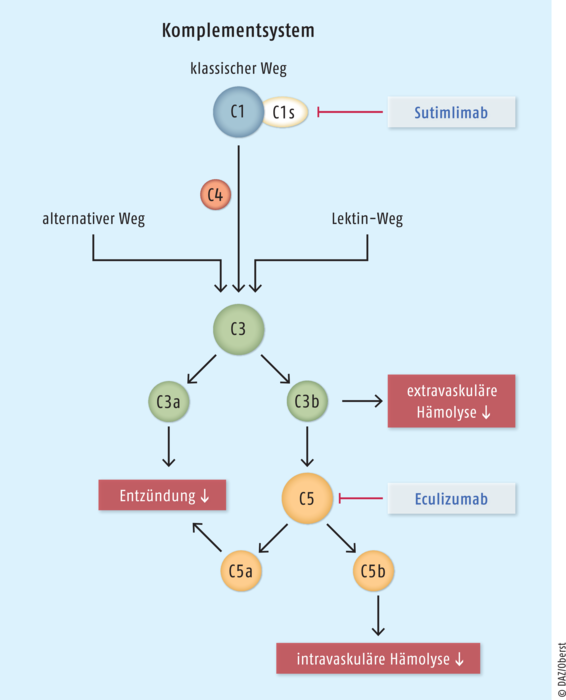
Die antigengebundenen Kälteantikörper fixieren das Komplementprotein C1q und aktivieren damit den klassischen Komplementweg. In dessen Verlauf bildet sich eine C3-Konvertase, die den Komplementfaktor C3 spaltet und so das Opsonin C3b erzeugt (s. Abb.). C3b bindet an die Erythrozyten und markiert diese für die Phagozytose.
Sobald die agglutinierten Erythrozyten zum wärmeren Körperkern zurück zirkulieren, lösen sich die Kälteantikörper ab, die Komplementfaktoren bleiben dagegen gebunden.
Das mononukleäre-phagozytäre System erkennt die C3b-markierten Erythrozyten und phagozytiert diese extravasal hauptsächlich in der Leber. Auf den „überlebenden“ Blutkörperchen wird C3b in inaktive Spaltprodukte abgebaut (u. a. C3d). Seltener kommt es im Rahmen von Operationen, fiebrigen Infektionen oder Entzündungen im Körper zur akuten Exazerbation mit intravasaler Hämolyse, bei der die Komplementkaskade über die C3b-Fixierung hinaus zur Bildung eines Membranangriffskomplexes aus verschiedenen Komplementfaktoren führt. Die Erythrozyten platzen dann bereits in den Gefäßen. Der Schweregrad der Hämolyse hängt mehr von der thermischen Amplitude als vom Antikörpertiter ab: Je empfindlicher die Antikörper auf eine Temperatursenkung reagieren, desto stärker ist die Hämolyse [4, 6].
Abb.: Die monoklonalen Antikörper Sutimlimab und Eculizumab greifen an unterschiedlichen Stellen der Komplementkaskade an, um den Niedergang der Erythrozyten (Hämolyse) bei Kälteagglutinin-Krankheit zu verhindern. Die Behandlung mit Eculizumab erwies sich bisher als nicht ausreichend wirksam. Das früher in der Kaskade angreifende Sutimlimab zeigt Ansprechraten von bis zu 73% und gilt als gut verträglich.
Schwäche, Schwindel, Schlaganfall
Symptome manifestieren sich mit unterschiedlichem Schweregrad. Durch eine kältebedingt gestörte Blutzirkulation kommt es zur bläulichen Verfärbung (Akrozyanose) und Marmorierung (Livedo reticularis) der Haut im Bereich der Akren [4]. Die Minderversorgung kann Vasospasmen (Raynaud-Syndrom) auslösen, bei der sich die betroffenen Körperteile weiß verfärben. Selten führt dies zu Gewebsnekrosen. Typische Symptome einer Anämie wie Müdigkeit, Kurzatmigkeit und Schwäche sind möglich [2, 8]. Die seltene intravaskuläre Hämolyse geht mit einer Dunkelfärbung des Urins einher (Hämoglobinurie) und stellt ein Risiko für thrombotische Komplikationen wie Lungenembolie dar [9]. 3% der Erkrankten entwickeln ein B-Zell-Lymphom [7]. Eine größere multinationale Studie zeigte eine Mortalität von 11%, das mediane Überleben wird auf 16 Jahre ab der Diagnose geschätzt, was vergleichbar mit einer altersangepassten Vergleichsgruppe ist [10].
B-Zell-lymphoproliferative Störung als Ursache
Der primären (idiopathischen) Kälteagglutinin-Krankheit, die etwa 15 bis 30% der autoimmunen hämolytischen Anämien ausmacht, liegt eine erworbene, nicht maligne klonale B-Zell-lymphoproliferative Störung zugrunde. Jedes Jahr kommt es etwa zu einer Neuerkrankung unter einer Million Menschen [8]. In der Regel befinden sich die Patienten im siebten Lebensjahrzehnt, betroffen sind überwiegend Frauen [6]. Neben der idiopathischen Erkrankung können Kälteantikörper im Rahmen eines sekundären Kälteagglutininsyndroms nach Virusinfektionen mit Mykoplasmen oder Epstein-Barr-Virus sowie bei einem aggressiven B-Zell-Lymphom auftreten [4].
Infektionsassoziierte Kälteantikörper sind polyklonal, stammen folglich von verschiedenen B-Lymphozyten ab und bilden sich spontan von allein zurück. Sowohl bei der primären Kälteagglutinin-Krankheit als auch bei der sekundären Form im Kontext lymphatischer Malignität handelt es sich dagegen um monoklonale IgM-Antikörper. Diese leiten sich von einem einzigen B-Lymphozytenklon ab und verschwinden nicht von selbst [6, 7].
Arzneimittel in der Pipeline
- Der C5-Inhibitor Eculizumab (Soliris®), der unter anderem zur Behandlung der paroxysmalen nächtlichen Hämoglobinurie (PNH) zugelassen ist, führte in Studien nur zu einem marginalen Hämoglobinanstieg bei Patienten mit Kälteagglutinin-Krankheit. Eculizumab bindet an das Komplementprotein C5 und hemmt somit die Bildung des Membranangriffskomplexes, der bei PNH unkontrolliert auftritt und zur intravaskulären Hämolyse führt (s. Abb.) [25]. Selbst bei Probanden mit ausgeprägter intrazellulärer Hämolyse erwies sich die Behandlung mit Eculizumab bei Kälteagglutinin-Krankheit als nicht ausreichend wirksam [26].
- Aktuell läuft eine Phase-III-Studie zur Beurteilung von Wirksamkeit und Sicherheit des C3-Inhibitors Pegcetacoplan bei Patienten mit Kälteagglutinin-Krankheit. Das pegylierte zyklische Peptid soll über eine C3-Hemmung die C3-induzierte extra- und intravaskuläre Hämolyse verhindern [27]. Zugelassen ist es bereits als Aspaveli® zur Behandlung der PNH [28].
- In einer Phase-II-Studie befindet sich der Faktor-B-Inhibitor Iptacopan. Faktor B ist ein in der Leber synthetisiertes Glykoprotein, das im Rahmen der alternativen Komplementaktivierung bei der Erzeugung der C3-Konvertase eine Rolle spielt. Diese C3-Konvertase wird von Iptacopan blockiert [29].
- Weitere Wirkstoffkandidaten sind ANX005, ein C1q-Inhibitor und ARGX-117, ein C2-Inhibitor, für die bisher In-vitro-Daten vorliegen, sowie der C1s-Inhibitor BIVV020, der sich in einer bereits abgeschlossenen Verträglichkeitsstudie befindet [30, 31, 32].
- Parsaclisib, ein oraler B-Zell-Rezeptor-Inhibitor, zeigte in einer Phase-II-Studie zur Behandlung der autoimmunhämolytischen Anämie gute Verträglichkeit und eine zügige Hämoglobinerhöhung [33].
In Handschuhen zum Kühlschrank
Das A und O für Patienten mit Kälteagglutinin-Krankheit ist ein adäquater Kälteschutz für exponierte Körperteile, der nicht nur bei niedrigen Außentemperaturen erforderlich ist. Einige Patienten benötigen Handschuhe, um Lebensmittel aus dem Kühlschrank oder der Gefriertruhe zu nehmen, sogar der Verzicht auf kalte Speisen oder Getränke kann notwendig sein.
Warme Bluttransfusion zur Behandlung
Für Patienten mit Kälteagglutinin-Krankheit, die nur leichte Anämien und keine lebensbeeinträchtigenden Symptome aufweisen, besteht keine Indikation einer pharmakologischen Therapie [4]. Eine medikamentöse Behandlung sollte bei schwerer chronischer Hämolyse und starken kältebedingten Krankheitszeichen erfolgen.
Eingesetzte Wirkstoffe richten sich gegen die pathologisch veränderten B-Zellen und das Komplementsystem mit dem Ziel, den Hämoglobinwert zu erhöhen und Symptome wie Akrozyanose und Raynaud-Syndrom zu reduzieren [11]. Eine Heilung ist bisher nicht möglich [12]. Da Infektionen in 40 bis 70% der Fälle zu Exazerbationen führen, sollten diese stets behandelt werden [11].
Bei sehr niedrigen Hämoglobinwerten kommen Plasmapherese, Transfusionen und unterstützend auch Erythropoetin zur Überbrückung bis zum Ansprechen von pharmakologischen Therapien zum Einsatz. Mehr als 40% der Patienten benötigen Bluttransfusionen. Eine Besonderheit stellt hier die Notwendigkeit dar, diese auf ein kleines Temperaturfenster zwischen 37 bis 40 °C zu erwärmen. Unterhalb der Körpertemperatur besteht das Risiko einer Erythrozytenagglutination, darüber einer thermischen Hämolyse.
Zur Entfernung der IgM-Antikörper aus dem Blut dient im Akutfall die Plasmapherese. Da jedoch keine Reduktion der Kälteagglutininproduktion stattfindet, stellt das Verfahren nur eine vorübergehende Maßnahme dar, bis medikamentöse Behandlungen greifen. Evidenzbasierte Angaben zum optimalen Austauschvolumen fehlen, auch die Wirksamkeit kann nicht durch eine umfangreiche Studienlage belegt werden. Dennoch erfüllt die Methode in der Praxis ihren Zweck.
Patienten mit schwerer Anämie und unzureichender Retikulozytose, das heißt mit wenigen Erythrozyten-Vorstufen im Blut, können von einer unterstützenden Behandlung mit rekombinantem Erythropoetin profitieren. Die Evidenz für eine Anwendung des Glykoproteinhormons, das die Erythrozytenbildung fördert, ist nicht hinreichend geklärt [7]. Eine Studie zeigte jedoch eine Hämoglobinerhöhung bei mehr als 70% der Patienten mit autoimmunhämolytischer Anämie [13].
Mehr als Symptombekämpfung
Bis zur Zulassung des ersten Komplementinhibitors umfasste das medikamentöse Portfolio ausschließlich B-Zell-gerichtete Therapien im Off-Label-Use (s. Tab.). Prospektive, nicht-randomisierte Studien mit kleiner Probandenzahl bildeten die Grundlage für einen Therapieentscheid. Als relativ gut verträglich mit akzeptabler Ansprechrate erwies sich Rituximab in Kombination mit dem Alkylanz Bendamustin [11]. Der monoklonale Antikörper bindet an das CD20-Antigen auf B-Lymphozyten und löst dessen Lyse aus [14].
Therapie | Ansprechrate | Erläuterung |
|---|---|---|
Rituximab (MabThera®) | 45% | mediane Ansprechdauer: 6 Monate Zeit bis zum Ansprechen: 3 Monate gute Verträglichkeit der Behandlung |
Rituximab (MabThera®) | 54% | mediane Ansprechdauer: 11 Monate Zeit bis zum Ansprechen: 1,5 Monate gute Verträglichkeit der Behandlung |
Rituximab + Fludarabin (Fludara®) | 76% | geschätzte mediane Ansprechdauer: 66 Monate Zeit bis zum Ansprechen: 4 Monate erhebliche hämatologische Toxizität erhöhtes Infektionsrisiko |
Rituximab + Bendamustin (Levact®) | 78% | geschätzte mediane Ansprechdauer: 88 Monate Zeit bis zum Ansprechen: 1,9 Monate hämatologische Toxizität schwächer als bei Fludarabin-Kombination erhöhtes Infektionsrisiko |
Ähnlich erfolgreich schlug die Kombination mit dem Zytostatikum Fludarabin an. Die Anwendung sollte jedoch aufgrund der erheblich höheren Toxizität nur nach individueller Abwägung erfolgen [7]. Für gebrechliche Patienten ist die Rituximab-Monotherapie vorbehalten.
Neben der hämatologischen Toxizität und dem erhöhten Infektionsrisiko stellt der langsame Wirkeintritt eines Rituximab-haltigen Regimes einen Nachteil dar [11].
Der Proteasom-Inhibitor Bortezomib (Velcade®), der zur Therapie entarteter Plasmazellen bei Multiplem Myelom eingesetzt wird, zeigte eine Ansprechrate von 32% [12].
Positive Resultate in Bezug auf Anämie und kältebedingte Symptome sind auch für den Bruton-Tyrosinkinasehemmer Ibrutinib (Imbruvica®) dokumentiert [15]. Als Vorteil könnte sich die Elimination von langlebigen B-Plasmazellen erweisen, welche kein CD20-Antigen exprimieren und daher von Rituximab nicht erkannt werden [16].
Im November 2022 erteilte die EMA die Zulassung für den monoklonalen IgG-Antikörper Sutimlimab (Enjaymo®) zur Behandlung der Kälteagglutinin-Krankheit in der Europäischen Union. Die Marktfreigabe durch die FDA erfolgte in den USA bereits im Februar 2022 [11].
Sutimlimab bindet an die Serinprotease C1s des Komplementkomplexes C1 und blockiert dadurch den klassischen Komplementweg. Die alternative und Lektin-induzierte Komplementkaskade bleiben dagegen unbeeinflusst (s. Abb.) [22]. Die zulassungsrelevante CARDINAL-Studie zeigte eine rasch einsetzende Hemmung der Hämolyse bereits nach der ersten Infusion mit Erhöhung des Hämoglobinspiegels und eine Reduktion der anämiebedingten Müdigkeit [23]. Dabei wurden Ansprechraten von 54 bis 73% erreicht, vergleichbar mit Rituximab-haltigen Regimes [11, 23, 24].
Um das Risiko für bakterielle Infektionen zu senken, sind vor Beginn der Therapie umfassende Impfungen gegen bekapselte Bakterien wie Neisseria meningitidis, Streptococcus pneumoniae und Haemophilus influenzae notwendig.
Da Sutimlimab im Gegensatz zur B-Zell-gerichteten Therapie keine zytotoxischen Eigenschaften besitzt, zeigt die Behandlung eine gute Verträglichkeit und bei vollständigem Impfschutz ein geringes Risiko für schwerwiegende Nebenwirkungen. Nachteilig ist die zügig wieder einsetzende Hämolyse nach Beendigung der Therapie, die eine lebenslängliche Behandlung erfordert [11, 22]. Zudem bleibt es gegen agglutinationsvermittelte Symptome wirkungslos. Sutimlimab eignet sich besonders bei kontraindizierter oder therapierefraktärer Zytostatikatherapie sowie bei schwerer Anämie und akuten Exazerbationen, die ein schnelles Ansprechen erfordern.
Aufgrund der lokal begrenzten Verfügbarkeit, der längeren Ansprechdauer und der fehlenden Wirksamkeit bei kältebedingten Symptomen wird die B-Zell-gerichtete Therapie weiterhin Relevanz besitzen [11]. |
Auf einen Blick
- Die Kälteagglutinin-Krankheit ist eine Form der autoimmunhämolytischen Anämie, bei der monoklonale IgM-Antikörper in niedrig temperierten Akrengefäßen kälteinduziert zur Erythrozytenagglutination und anschließender Komplement-vermittelter extravasaler Hämolyse führen.
- Symptomatisch manifestiert sich die Erkrankung mit Akrozyanose, Raynaud-Syndrom und Abgeschlagenheit.
- Therapeutische Ziele sind die Antikörper-produzierenden B-Zellen und das Komplementsystem.
- Eine kurative Behandlung ist bisher nicht möglich.
- B-Zell-gerichtete Therapien beinhalten Rituximab-haltige Regimes im Off-Label-Use, eine Komplementhemmung wird mit dem kürzlich zugelassenen Sutimlimab erreicht.
Literatur
[1] Newhall DA, Oliver R, Lugthart S. Anaemia: A disease or symptom. Neth J Med 2020;78(3):104-110
[2] Palmer D, Seviar D. How to approach haemolysis: Haemolytic anaemia for the general physician. Clin Med (Lond), 2022, 22(3):210-213
[3] Liebman HA, Weitz IC. Autoimmune Hemolytic Anemia. Med Clin North Am 2017;101(2):351-359
[4] Berentsen S. New Insights in the Pathogenesis and Therapy of Cold Agglutinin-Mediated Autoimmune Hemolytic Anemia. Front Immunol 2020;11:590
[5] Dreizler T, Bara V, Botha CA et al. Schweres Kälteautoantikörpersyndrom bei Aortenaneurysma. Kardiotechnik 2008;(2):42-45
[6] Swiecicki PL, Hegerova LT, Gertz MA. Cold agglutinin disease. Blood 2013;122(7):1114-1121
[7] Burgnara C, Berentsen S. Cold agglutinin disease. RA Brodsky, UpToDate, 2022
[8] Berentsen S. How I treat cold agglutinin disease. Blood 2021;137(10):1295-1303
[9] Barcellini W, Zaninoni A, Giannotta JA et al. New Insights in Autoimmune Hemolytic Anemia: From Pathogenesis to Therapy. J Clin Med 2020;9(12):3859
[10] Berentsen S, Barcellini W, D‘Sa S et al. Cold agglutinin disease revisited: a multinational, observational study of 232 patients. Blood, 2020, 136(4):480-488
[11] Berentsen S, Barcellini W, D‘Sa S et al. Sutimlimab for treatment of cold agglutinin disease: why, how and for whom? Immunotherapy 2022;14(15):1191-1204
[12] Rossi G, Gramegna D, Paoloni F et al. Short course of bortezomib in anemic patients with relapsed cold agglutinin disease: a phase 2 prospective GIMEMA study. Blood 2005;132(5):547–550
[13] Fattizzo B, Michel M, Zaninoni A et al. Efficacy of recombinant erythropoietin in autoimmune hemolytic anemia: a multicenter international study. Haematologica 2021;106(2):622-625
[14] MabThera® Fachinformation. Roche Pharma AG, www.roche.com/solutions/pharma/productid-b0eb216f-addf-4ed1-b01e-0b12fe0b1ef6/, Stand August 2022
[15] Jalink M, Berentsen S, Castillo JJ et al. Effect of ibrutinib treatment on hemolytic anemia and acrocyanosis in cold agglutinin disease/cold agglutinin syndrome. Blood 2021;138(20):2002-2005
[16] Fattizzo B, Motta I. Rise of the planet of rare anemias: An update on emerging treatment strategies. Front Med (Lausanne) 2023;9:1097426
[17] Schöllkopf C, Kjeldsen L, Bjerrum OW et al. Rituximab in chronic cold agglutinin disease: a prospective study of 20 patients. Leuk Lymphoma 2006;47(2):253-260
[18] Berentsen S, Ulvestad E, Gjertsen BT et al. Rituximab for primary chronic cold agglutinin disease: a prospective study of 37 courses of therapy in 27 patients. Blood 2004;103(8):2925-2928
[19] Berentsen S, Randen U, Vågan AM et al. High response rate and durable remissions following fludarabine and rituximab combination therapy for chronic cold agglutinin disease. Blood 2010;116(17):3180-3184
[20] Berentsen S, Randen U, Oksman M et al. Bendamustine plus rituximab for chronic cold agglutinin disease: results of a Nordic prospective multicenter trial. Blood 2017;130(4):537-541
[21] Berentsen S, Barcellini W, D‘Sa S, et al. Cold agglutinin disease revisited: a multinational, observational study of 232 patients. Blood 2020;136(4):480-488
[22] Enjaymo: EPAR-Product Information. EMEA/H/C/005776, www.ema.europa.eu/en/documents/product-information/enjaymo-epar-product-information_de.pdf, Stand November 2022
[23] Röth A, Barcellini W, D‘Sa S et al. Sutimlimab in Cold Agglutinin Disease. N Engl J Med 2021;384(14):1323-1334
[24] Röth A, Berentsen S, Barcellini W et al. Sutimlimab in patients with cold agglutinin disease: results of the randomized placebo-controlled phase 3 CADENZA trial. Blood 2022;140(9):980-991
[25] Soliris® Fachinformation. https://imedikament.de/soliris, Alexion Europe SAS, Stand August 2017
[26] Jäger U, D‘Sa S, Schörgenhofer C et al. Inhibition of complement C1s improves severe hemolytic anemia in cold agglutinin disease: a first-in-human trial. Blood 2019;133(9):893-901
[27] Jilma B, Roman E, Ueda Y et al. Trial in Progress: Randomized, Double-Blind, Placebo-Controlled Multicenter Phase 3 Study to Evaluate the Efficacy and Safety of Pegcetacoplan in Patients with Cold Agglutinin Disease (CASCADE). Blood 2022;140(1):5326-5327
[28] Aspaveli® Fachinformation. https://sobi-deutschland.de/produkte/aspaveli, Swedish Orphan Biovitrum AB, Stand Dezember 2021
[29] Schubart A, Flohr S, Junt T et al. Low-molecular weight inhibitors of the alternative complement pathway. Immunol Rev 2023;313(1):339-357
[30] Gertz MA, Qiu H, Kendall L et al. ANX005, an inhibitory antibody against C1q, blocks complement activation triggered by cold agglutinins in human disease. Blood 2016;128(22):1265
[31] Van de Walle I, Silence K, Budding K et al. ARGX-117, a therapeutic complement inhibiting antibody targeting C2. J Allergy Clin Immunol 2021;147(4):1420-1429.e7
[32] Ye J, Yang P, Yang Y et al. Complement C1s as a diagnostic marker and therapeutic target: Progress and propective. Frontiers in Immunology 2022;13:1015128
[33] Jang JH, Gomez RD, Bumbea H et al. Ling-term efficacy and safety results from an ongoing open-label phase 2 study of parsyclisib for the treatment of autoimmune hemolytic anemia (AIHA). Vortrag auf dem EHA 2022, 9 bis 12 Juni 2022, Abstract S.286
[34] Murphy K, Weaver C. Janeway Immunologie. Springer, 2018, 9. Auflage, S. 54ff
[35] Berentsen S, Barcellini W. Autoimmune Hemolytic Anemias. N Engl J Med 2021;385:1407-1419
[36] Paroxysmale nächtliche Hämoglobinurie. Kurzmeldung der Roche Pharma AG, 13. Februar 2023























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.